
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення молекулярної маси газу
Правила техніки безпеки: дотримуватися загальних правил безпеки при роботі в хімічних лабораторіях. Необхідні прилади і реактиви: прилад для одержання вуглекислого газу (апарат Кіппа), технічні ваги, плоскодонна колба, мірний циліндр.
Виконання досліду 1. Суху плоскодонну колбу закрийте пробкою до мітки і зважте на технохімічних вагах з точністю ±0,01 г – маса колби з повітрям (m1). Результат внесіть до таблиці 1.1. 2. Зважену колбу заповніть вуглекислим газом з апарату Кіпа на протязі 4 – 5 хвилин. По закінченню зазначеного часу газовідвідну трубку повільно вийміть з колби і припиніть подачу газу. Наявність достатньої кількості газу перевірте за допомогою палаючої лучини, яку піднесіть до вихідного отвору колби. Якщо лучина гасне (колба заповнена), то пропускайте вуглекислий газ ще близько хвилини, повільно вийміть газовідвідну трубку і лише тоді припиніть подачу газу. 3. Колбу з вуглекислим газом закрийте пробкою до мітки і знову зважте – маса колби з вуглекислим газом (m2). Результат внесіть до таблиці 1.1. 4. Визначте об'єм колби: для цього заповніть колбу до мітки водою і перелийте її в мірний циліндр – об'єм колби (V). 5. За допомогою об'єднаного газового закону приведіть об'єм колби до нормальних умов – об'єм колби за н.у. (V 0). 6. Прийнявши молярну масу повітря Мпов = 29,0 г/моль, обчисліть масу повітря в об'ємі V 0 – маса повітря (m3):
7. Розрахуйте масу порожньої колби (m4 = m1 – m3) – маса порожньої колби (m4). 8. Розрахуйте масу вуглекислого газу (m5 = m2 – m4) – маса вуглекислого газу (m5). 9. Запишіть тиск і температуру, за яких проводився дослід. 10. Експериментальні і розраховані величини занесіть послідовно у таблицю 1.1. Таблиця 1.1 – Дані визначення молекулярної маси газу
11. Розрахуйте молекулярну масу вуглекислого газу трьома способами з точністю до третьої значущої цифри. Обробка результатів досліду 1) За молярним об'ємом. Використовуючи величини: масу газу (m5, г) та його об'єм за нормальних умов (V0, л), маємо:
Звідси знайдіть молярну масу газу М, що чисельно дорівнює відносній молекулярній масі (а.о.м.):
2) За відносною густиною. Використовуючи величини: маси однакових об'ємів вуглекислого газу (m5) та повітря (m3), обчисліть відносну густину вуглекислого газу за повітрям Dпов: Dпов = m5 /m3 Молярну масу повітря прийміть рівною 29,0 г/моль. Тоді відповідно наведеного виразу знаходимо молярну масу вуглекислого газу, що чисельно дорівнює його відносній молекулярній масі: Мексп = 29Dпов (а.о.м.) 3) За рівнянням Менделєєва-Клапейрона. Використовуючи величини: маса газу (m5, г), його об'єм (V, л), температура (T, К) і тиск (Р, Па) знаходимо молярну масу газу за рівнянням:
де R = 8,314 Дж/(моль×К) - універсальна газова постійна. (тиск в 1 мм.рт.ст. відповідає 33,3 Па) Для кожного зі способів розрахувати відносну помилку визначення d по рівнянню:
де Мтеор–теоретична молекулярна маса вуглекислого газу, а.о.м. Мексп – експериментально знайдена молекулярна маса, а.о.м. В висновках вкажіть, якими методами визначали молекулярну масу газу та фактори, що впливають на помилку експерименту.
Лабораторна робота № 2
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 334; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.10.246 (0.007 с.) |




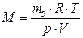 ,
,



