
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основні поняття і закони хіміїСтр 1 из 10Следующая ⇒
ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ Теоретична частина Відносною молекулярною Мr (або атомною Аr) масою речовини називають відношення маси молекули (або атома) m0 даної речовини до 1/12 маси атома Карбону – 12 mc:
Символ Мг, запропонований ІЮПАК, свідчить про відносний характер молекулярної маси (r-relative – відносний). Нині відносні атомні маси всіх хімічних елементів визначено досить точно. Додавши відносні атомні маси елементів, які входять до складу молекули чи формульної одиниці, можна обчислити відносну чи формульну молекулярну масу тієї чи іншої хімічної речовини. Чим більше атомів або молекул міститься в речовині, тим більша її маса. Число молекул у макроскопічних тілах надзвичайно велике, тому прийнято позначати не абсолютне число атомів і молекул, а відносне. Число молекул або атомів у даній речовині порівнюють з числом атомів, що містяться в 0,012 кг Карбону. Відносне число атомів і молекул у речовині характеризують фізичною величиною, яку називають кількістю речовини. Кількість речовини ν – це відношення числа молекул N, що містяться в даній речовині, до числа NA атомів у 0,012 кг Карбону:
Якщо речовина складається з окремих атомів, які не сполучені в молекули, то під числом молекул розуміють число атомів. Кількість речовини виражають у молях. Моль – це кількість речовини, яка містить стільки молекул, атомів, іонів або інших структурних одиниць, скільки атомів міститься у 0,012 кг нукліда Карбону 12С. Якщо, наприклад, кількість речовини дорівнює 2 моль, то це означає, що число структурних одиниць у речовині вдвічі більше, ніж число атомів у 0,012 кг нукліда Карбону 12С. Застосовуючи поняття «моль», потрібно в кожному конкретному випадку зазначати, про які саме структурні одиниці йдеться. Наприклад, слід розрізняти поняття моль атомів Н, моль молекул Н2, моль іонів Н+. Число структурних одиниць, що міститься в одному молі будь-якої речовини, називають числом Авогадро (на честь італійського вченого-фізика). Це число визначено з великою точністю різними методами, воно дорівнює 6,02*1023 моль-1. Якщо кількість речовини v = 2 моль, то число молекул у ній дорівнюватиме:
Число молекул в одному кіломолі речовини становить 6,02*1023 моль-1. Крім відносної молекулярної маси Мг у хімії і фізиці широко застосовують поняття молярної маси М.
Молярною масою називають масу речовини, взятої в кількості один моль. Згідно з цим визначенням, молярна маса дорівнює добутку маси молекули на число Авогадро:
Масу m будь-якої кількості речовини v можна обчислити за формулою:
Знаючи молекулярну чи формульну масу речовини та атомні маси елементів, що входять до складу її молекули, можна встановити хімічну формулу речовини, розрахувавши, в яких кількостях речовини взаємодіють між собою. Молекулярну масу газуватих речовин визначають експериментально, встановлюючи їх масу, об'єм, тиск, температуру, і обчислюють за відповідними газовими законами. Найпершими було визначено молекулярні маси газуватих речовин. Для визначення відносної молекулярної маси речовини слід знайти молярну масу, що чисельно дорівнює їй. Найпростіший метод визначення молекулярної маси речовини ґрунтується на законі Авогадро: Лабораторна робота № 1 Визначення молекулярної маси газу Правила техніки безпеки: дотримуватися загальних правил безпеки при роботі в хімічних лабораторіях. Необхідні прилади і реактиви: прилад для одержання вуглекислого газу (апарат Кіппа), технічні ваги, плоскодонна колба, мірний циліндр.
Виконання досліду 1. Суху плоскодонну колбу закрийте пробкою до мітки і зважте на технохімічних вагах з точністю ±0,01 г – маса колби з повітрям (m1). Результат внесіть до таблиці 1.1. 2. Зважену колбу заповніть вуглекислим газом з апарату Кіпа на протязі 4 – 5 хвилин. По закінченню зазначеного часу газовідвідну трубку повільно вийміть з колби і припиніть подачу газу. Наявність достатньої кількості газу перевірте за допомогою палаючої лучини, яку піднесіть до вихідного отвору колби. Якщо лучина гасне (колба заповнена), то пропускайте вуглекислий газ ще близько хвилини, повільно вийміть газовідвідну трубку і лише тоді припиніть подачу газу. 3. Колбу з вуглекислим газом закрийте пробкою до мітки і знову зважте – маса колби з вуглекислим газом (m2). Результат внесіть до таблиці 1.1.
4. Визначте об'єм колби: для цього заповніть колбу до мітки водою і перелийте її в мірний циліндр – об'єм колби (V). 5. За допомогою об'єднаного газового закону приведіть об'єм колби до нормальних умов – об'єм колби за н.у. (V 0). 6. Прийнявши молярну масу повітря Мпов = 29,0 г/моль, обчисліть масу повітря в об'ємі V 0 – маса повітря (m3):
7. Розрахуйте масу порожньої колби (m4 = m1 – m3) – маса порожньої колби (m4). 8. Розрахуйте масу вуглекислого газу (m5 = m2 – m4) – маса вуглекислого газу (m5). 9. Запишіть тиск і температуру, за яких проводився дослід. 10. Експериментальні і розраховані величини занесіть послідовно у таблицю 1.1. Таблиця 1.1 – Дані визначення молекулярної маси газу
11. Розрахуйте молекулярну масу вуглекислого газу трьома способами з точністю до третьої значущої цифри. Обробка результатів досліду 1) За молярним об'ємом. Використовуючи величини: масу газу (m5, г) та його об'єм за нормальних умов (V0, л), маємо:
Звідси знайдіть молярну масу газу М, що чисельно дорівнює відносній молекулярній масі (а.о.м.):
2) За відносною густиною. Використовуючи величини: маси однакових об'ємів вуглекислого газу (m5) та повітря (m3), обчисліть відносну густину вуглекислого газу за повітрям Dпов: Dпов = m5 /m3 Молярну масу повітря прийміть рівною 29,0 г/моль. Тоді відповідно наведеного виразу знаходимо молярну масу вуглекислого газу, що чисельно дорівнює його відносній молекулярній масі: Мексп = 29Dпов (а.о.м.) 3) За рівнянням Менделєєва-Клапейрона. Використовуючи величини: маса газу (m5, г), його об'єм (V, л), температура (T, К) і тиск (Р, Па) знаходимо молярну масу газу за рівнянням:
де R = 8,314 Дж/(моль×К) - універсальна газова постійна. (тиск в 1 мм.рт.ст. відповідає 33,3 Па) Для кожного зі способів розрахувати відносну помилку визначення d по рівнянню:
де Мтеор–теоретична молекулярна маса вуглекислого газу, а.о.м. Мексп – експериментально знайдена молекулярна маса, а.о.м. В висновках вкажіть, якими методами визначали молекулярну масу газу та фактори, що впливають на помилку експерименту.
Лабораторна робота № 2 Виконання досліду 1. Перевірте прилад на герметичність. Для цього щільно закрийте пробки, після чого лійку разом з кільцем вийміть з держателя і опустіть вниз на 15-20 см. Рівень води в бюретці трохи знизиться і далі залишатиметься без змін, якщо прилад герметичний. В разі негерметичності - знайдіть причину і усуньте її. 2. Налийте в пробірку через лійку розведеної хлоридної (соляної) кислоти (приблизно 1/3 об¢єму) і вийміть лійку з пробірки так, щоб вона не торкнулася її стінок.
3. Змочіть водою край папірця, в який загорнена наважка, і за допомогою скляної палички закріпіть на внутрішній стінці пробірки трохи вище рівня кислоти.
4. Обережно, але щільно закрийте пробірку пробкою. Запишіть рівень води V1 у бюретці. 5. Стряхніть наважку металу в кислоту. Спостерігайте, як виділяється водень, що витискує воду з бюретки. Майте на увазі, що водень насичений водяною парою. 6. Для розрахунків необхідні значення температури і тиску газу у бюретці. Визначення температури. Дайте пробірці охолонути до кімнатної температури. Запишіть показання термометру. Визначення тиску.Газова суміш у бюретці знаходиться під тиском атмосфери і стовпчика води за рахунок різних рівней води у бюретці і лійці. Щоб виключити останній, установіть воду у лійці та бюретці на однаковому рівні, після чого запишіть рівень води в бюретці V2. Парціальний тиск водню в бюретці розраховується за формулою: р(Н2)= Р - h, де Р – атмосферний тиск, h – тиск насиченої пари води при кімнатній температурі. 7. Визначте об¢єм водню за формулою: V = (V2 – V1),мл. 8. Експериментальні і розраховані величини занесіть послідовно у таблицю 1.2. Таблиця 1.2 – Дані для визначення молекулярної маси еквівалента металу
Обробка результатів досліду 1.Приведіть об¢єм виділеного водню до нормальних умов:
2. Розрахуйте експериментальну молярну масу еквівалентів металу за формулою:
3. Визначте молярну масу металу за умовою його двовалентності
Визначте назву металу і розрахуйте теоретичну молярну масу еквівалентів металу Меквтеор. 4. Розрахуйте відносну помилку в процентах за формулою:
У висновках вкажіть, яким методом визначалась молярна маса еквівалентів металу; який закон лежить в основі цього методу; фактори, що впливають на помилку методу.
Контрольнізапитанная 1. Дати визначення основним поняттям хімії: атом, молекула, хімічний елемент, відносна атомна маса, відносна молекулярна маса, кількість речовини, одиниця кількості речовини, молекулярна маса, молярний об'єм газу, еквівалент, еквівалентна маса, еквівалентний об'єм. 2. Основні закони хімії та їх зміст: Закон збереження маси та енергії, закон постійного складу, закон еквівалентів, закон Авогадро.
3. 2,6 г гідроксиду металу обробили сірчаною кислотою і одержали 5,7 г сульфату. Визначте молярну масу еквівалентів металу. 4. Мідь утворює два оксиди, в одному з яких масова доля міді 88,9%, а в другому – 80%. Визначте молярні маси еквівалентів міді в обох оксидах 5. 0,35 г двовалентного металу витиснули з кислоти 209 мл водню, який збирали при 20 0С і тиску 102,3 кПа. Визначте молярну масу еквівалентів металу і молярну масу металу. Який це метал? 6. Розрахувати фактори еквівалентності і еквіваленти Na2CO3 в реакціях з соляною кислотою з утворенням кислої солі та вуглекислоти. 7. Метал масою 98,1 г при взаємодії з кислотою витискує 33,6 л водню, виміряного за нормальних умов. Визначте молярну масу еквівалентів металу. 8. Розрахуйте можливі значення молярних мас еквівалентів наступних речовин за їх формулами: H2SeO4, Ni(OH)2, NaHSiO3, CoOHCI, К2SO3. ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ Теоретична частина Для термодинамічного опису хімічних систем використовують функції стану – параметри, значення яких залежать тільки від стану системи в даний момент часу. Функція стану – це така властивість системи, величина якої однозначно визначається для кожного стану системи незалежно від способу його досягнення. До найважливіших термодинамічних функцій стану відносять: внутрішню енергію U, ентальпію Н, ентропію S, енергію Гіббса G. Величини внутрішньої енергії, ентальпії, енергій Гіббса завжди вимірюють відносно деякого умовно вибраного стану. Саме тому в позначенні цих величин стоїть знак відносної зміни D (DU = U2–U1, тощо). Термодинамічні функції DU, DН, D G, відносять до одного моля речовини і виражають в кДж/моль. Внутрішня енергія U – це усі види енергії руху та взаємодії частинок системи, крім кінетичної та потенціальної енергії системи в цілому. Більшість хімічних реакцій, що звичайно зустрічаються, відбувається або при сталому тиску (у негерметичній або відкритій апаратурі), або при сталому об¢ємі (в автоклаві). Вони є відповідно ізобарними (Р = const) або ізохорними (V = const). Кількісною мірою теплового ефекту в ізохорних умовах Q v при однакових температурах реагентів та продуктів реакції є величина зміни внутрішньої енергії реакційної системи:
Під час ізобарного процесу крім зміни внутрішньої енергії, в системі виконується також деяка робота А = Р×DV розширення проти сил зовнішнього тиску за рахунок зміни об¢єму DV. Отже, тепловий ефект реакції при сталому тиску:
Звідси: Qр = U2-U1+ РV2 – РV1= (U2 + РV2) – (U1+ РV1). Визначимо нову функцію:
Тоді:Qр= DH, де DH- зміна ентальпій реакційної системи. Ентальпія – термодинамічна функція стану, зміна якої відповідає тепловому ефекту реакції при постійному тиску. Перехід енергії в деякому процесі можна розглядати з боку зовнішнього середовища та з боку системи. У термодинаміці теплоту, що виділяється, вважають від¢ємною, а теплоту, що поглинається – додатньою. У термохімії – протилежна система знаків. Тому:
для екзотермічної реакції Qр т.х.> 0, DH < 0, для ендотермічної Qр т.х. < 0, DH > 0. Термохімічнимназивають хімічне рівняння, в якому наведено також тепловий ефект реакції. Суттєво, що в таких рівняннях слід зазначати агрегатний стан речовин: (т)- - твердий, (р) – рідкий, (г) – газоподібний. Наприклад: 4FeO(т) + O2(г) = 2Fe2O3(т); D H о = -584 кДж або 4FeO(т) + O2(г) = 2Fe2O3(т) + 584 кДж. Наведена реакція є екзотермічною (DH < 0, Qр> 0). Верхнім індексом “о” біля символу ентальпії позначається стандартний стан речовини, нижнім індексом надається значення температури: DHоТ. Стандартним є стан чистої речовини у вказаному агрегатному стані і модифікації при тиску 1,01×105 Па (1 атм) і температурі Т. Стандартною є температура298,15 К (25оС). Внутрішня енергія, ентальпія й енергія Гіббса простих речовин у їх стійких модифікаціях (наприклад, газоподібного кисню О2, вуглецю у виді графіту) у стандартному стані і при стандартній температурі умовно приймаються рівними нулю. У довідниках звичайно приводять значення термодинамічних функцій різних речовин при Р = 1 атм і Т = =298 К, які називають відповідно стандартними Стандартна ентальпія утворення DHо298складної речовини – зміна ентальпії в процесі утворення одного моля її з простих речовин у найбільш стійкому стані за стандартних умов. Термодинаміка хімічних реакцій характеризується змінами термодинамічних функцій DU, DH, DS, DG при їхньому перебігу. Стандартною ентальпією DHоТ (ентропією DSоТ, енергією Гіббса DG оТ) реакції називають зміни цих функцій при такому протіканні даної реакції, коли кожна з вихідних речовин і кожен із продуктів реакції знаходяться у стандартному термодинамічному стані. Тому що величини U, H, S, G є функціями стану, їхні зміни залежать тільки від кінцевого (2) і початкового (1) станів системи, але не від шляху (проміжних стадій) процесу. Історично це положення було вперше сформульоване для DUх.р. і DHх.р. як закон Г.І. Гесса (1840 р.). Стосовно до хімічної реакції аА + bВ = сС + dD (тут А, В, С, D – формули речовин, а а, b, с, d – стехіометричні коефіцієнти), сказане означає, що:
Тобто зміна будь-якої термодинамічної функції в хімічній реакції DФх.р. (де Ф = U, або H, або S, або G) дорівнює сумі значень цієї функції для продуктів реакції (2) за відрахуванням суми значень для вихідних речовин (1). Закон Гесса лежить в основі термохімії– науки, що вивчає теплові ефекти реакцій. Закон Гесса дозволяє відноситися до термохімічних рівнянь як до алгебраїчних: їх можна додавати, віднімати, помножувати на постійне число, тощо. Беручи до уваги, що теплові ефекти слабко залежать від температури, можна вважати:
Ентропія S - функція стану, що відбиває ступінь невпорядкованості у взаємному розташуванні і русі частинок системи. На відміну від інших термодинамічних функцій, для величини ентропії речовини можна визначити абсолютні S (а не відносні DS ) значення при різних температурах. Це пояснюється тим, що при температурі, що наближається до абсолютного нуля (Т®0), ентропія всіх речовин у стані ідеальних кристалів наближається до нуля. Ентропія має розмірність енергії, віднесеної до температури і виражається в Дж/(моль× К). Ентропія зростає при нагріванні речовини, при переході із кристалічного в рідкий і із рідкого в газоподібний стан, при розчиненні кристалів, розширенні газів, при реакціях, що приводять до збільшення числа частинок і особливо частинок у газоподібному стані (поясніть причини). Розрахунок зміни ентропії хімічної реакції, як функції стану, роблять по рівнянню (1). Але можна робити висновок про зміну ентропії по рівнянню реакції і без кількісних розрахунків. Напрямок процесів у природі і техніці, що перебігають самодовільно, визначається конкуренцією двох чинників: тенденцією до зниження енергії (DU < 0 або DН < 0) і прагненням до підвищення хаотичності розподілу і руху частинок (DS > 0). Дляізобарно-ізотермічних умов (Р і Т – const), що найчастіше зустрічаються, критерієм можливості самодовільного перебігу процесу є знак зміни термодинамічної функції G, що називається енергією Гіббса
При DG < 0 пряма реакція термодинамічно можлива; при DG > 0 – пряма реакція неможлива, але може протікати зворотна реакція; рівність D G = 0 є умовою термодинамічної рівноваги. Роль ентропійного фактора Т×DS (прагнення до хаотичності) зростає з ростом температури. При низьких температурах переважає ентальпійний фактор, і більш ймовірним стає протікання екзотермічних (D Н < 0) реакцій. У загальному випадку температурний інтервал, у якому реакція термодинамічно можлива, залежить від співвідношення знаків і величин D Н і D S (табл. 2.1.). Для ізольованих систем, що не обмінюються з навколишнім середовищем ні речовиною, ні енергією, умовою самодовільного протікання процесів є збільшення ентропії: D S > 0. Таблиця 2.1 - Спрямованість протікання реакцій при різних знаках D Н і D S
При температурах, відмінних від стандартної, DG
Лабораторна робота 3 Виконання досліду Теоретична частина Швидкість хімічної реакції Хімічна кінетика – це розділ хімії, що вивчає швидкість перебігу різних хімічних реакцій. Швидкість реакції відповідає числу елементарних актів взаємодії, що відбуваються за одиницю часу: для гомогенних реакцій – в одиниці об’єму, для гетерогенних – на одиниці площі поверхні поділу фаз. Швидкість реакцій характеризується зміною концентрації будь-якої з вихідних речовин або кінцевих продуктів реакції за одиницю часу і залежить від природи речовин, що реагують і умов за яких відбувається реакція. Найважливішими з цих умов є: а) концентрація реагентів; б) температура; в) наявність каталізатора; г) зовнішні умови (випромінювання, пластична деформація, природа речовини). Залежність швидкості реакції від концентрації описує закон дії мас: Кінетика оборотних реакцій Хімічні реакції можуть бути необоротними і оборотними. Оборотна реакція може відбуватися як у прямому, так і в зворотному напрямку. Тому при розрахуванні швидкості процесу необхідно враховувати швидкість як прямої, так і зворотної реакції. Наприклад, для оборотної реакції яка відбувається в гомогенної системі Аа + Bв Û Сав
де [А];[В];[АВ] – рівноважні концентрації. В оборотних реакціях швидкість прямої реакції спочатку має максимальне значення, а потім зменшується із-за спадання концентрації вихідних речовин, які витрачаються на утворення продуктів реакції. І навпаки, зворотна реакція в початкову мить має мінімальну швидкість, котра зростає по мірі зростання концентрації продуктів реакції. Отже, швидкість прямої реакції зменшується, а зворотної – збільшується. Наприкінці наступає такий момент, коли швидкість прямої і зворотної реакцій зрівнюються, тобто
Стан хімічної системи, коли швидкість прямої і зворотної реакції однакові, називається хімічною рівновагою. В рівноважному стані концентрації усіх речовин в реакційній системі не змінюються. Ці концентрації називаються рівноважними. При рівновазі Відношення констант швидкостей k1 і k2 за сталої температури також є сталою величиною і називається константою рівноваги (Крів.)
Для оборотної реакції в рівноважному стані закон дії мас виражається константою рівноваги Аа + Вв Û Сав
Якщо константа рівноваги виражена через рівноважні концентрації, то її позначають КС. У випадку хімічної рівноваги між газоподібними речовинами константу рівноваги процесу можна виразити за допомогою парціальних тисків газоподібних речовин, що беруть участь у реакції, позначають КР. Таким чином, константа рівноваги показує, що в момент рівноваги відношення добутку рівноважних концентрацій продуктів реакції до добутку рівноважних концентрацій реагуючих речовин є величиною сталою. Константа рівноваги, як і зміна енергії Гіббса, свідчить про повноту хімічного процесу. Чим від`ємніше значення DGТ0, тим більше значення константи, оскільки ці величини зв’язані між собою співвідношенням:
Лабораторна робота 4 Виконання дослідів. РОЗЧИНИ Гідроліз розчинів солей Теоретична частина Для води як слабкого електроліту константу рівноваги дисоціації можна записати так: H2О «Н+ + ОН
звідки вважаючи на практично сталу концентрацію води
Величина КН2O називається іонним добутком води. При 250С КН2O = 10-14. Значить, у воді і водних розчинах концентрації іонів [ Н+] та [ОН -] пов’язані одна з одною: [ Н+] = Замість концентрацій іонів Н+ і ОН- зручніше користуватися їхніми десятковими логарифмами, взятими зі зворотним знаком; ці величини позначаються символами pH і pOH і називаються відповідно: pH = -lg [ Н+] - водневий показник; pOH = -lg [OН-] - гідроксильний показник; pH + pOH = 14. Водневий і гідроксильний показники можуть служити мірою кислотності або лужності водних розчинів: в кислих розчинахpH < 7, а pOH > 7; в нейтральних - pH = pOH = 7; в лужних - pH > 7, pOH < 7. Реакцію розчину (кислий або лужний характер середовища) на практиці можна визначити за допомогою індикаторів – слабких органічних кислот або основ, що мають різне забарвлення в дисоційованій і молекулярній формах. Забарвлення деяких з них у різних середовищах приведені у таблиці 4.1.1.
Таблиця 4.1.1 - Забарвлення індикаторів в різних середовищах
Реакції нейтралізації, у яких беруть участь слабкі кислоти або основи, оборотні, тобто можуть протікати не тільки в прямому, але і в зворотному напрямку. Тому гідроліз солі є оборотним процесом стосовно реакції нейтралізації. Отже, при розчиненні у воді солі, до складу якої входить аніон слабкої кислоти або катіон слабкої основи, протікає процес гідролізу – обмінної взаємодії солі з водою, у результаті якого утворюється слабка кислота або слабка основа. Оскільки нейтралізація супроводжується виділенням теплоти, то гідроліз є ендотермічним процесом (∆H > 0). Крім того, гідроліз – оборотний процес. При складанні іонних рівнянь гідролізу солей виходьте з того, що з водою взаємодіють ті катіони або аніони, що з іонами води (Н+ або ОН-) можуть утворити слабкі електроліти. Наприклад, якщо розчинити у воді хлорид міді CuCl2 або сульфід натрію Na2S, то в першому випадку з водою будуть взаємодіяти іони Cu2+, а в другому – іони S2- по таких схемах: а) I стадія: CuCl2+ Н2О «Cu(ОН)Сl + НСl Cu2+ + Н2О «(CuОН)+ + Н+ П стадія: Cu(ОН)Сl+Н2О«Cu(ОН)2+НСl (CuОН)+ +Н2О«Cu(ОН)2+Н+ б) I стадія: Na2S +Н2О «NaНS +NaОН S2- +Н2О«НS- +ОН- П стадія: NaНS +Н2О «Н2S +NaОН. НS-+Н2О «Н2S + ОН- Отже, у реакції гідролізу можуть фактично брати участь або катіон основного залишку, якщо сіль утворена слабкою основою і сильною кислотою (як CuCl2), або аніон кислотного залишку, якщо сіль утворена слабкою кислотою і сильною основою (як Na2S), або одночасно і катіон, і аніон, якщо сіль утворена слабкою основою і слабкою кислотою (як CH3COONН4): CH3COONН4 + Н2О «NН4ОН + CH3COOН. CH3COONН4 ® NН4+ + CH3COO- NН4++ CH3COO- + Н2О «NН4ОН + CH3COOН Якщо катіон або аніон, що беруть участь у гідролізі, багатозарядні, то гідроліз протікає по стадіях, при чому число стадій дорівнює абсолютній величині заряду відповідного іона. Тому гідроліз СuCl2 і Na2S протікає в дві стадії, а гідроліз Al(NO3)3 - в три, оскільки катіон алюмінію має заряд +3. Переважно гідроліз перебігає по першій стадії. Деякі солі (найчастіше утворені слабкою нерозчинною основою і дуже слабкою летючою кислотою) піддаються повному гідролізу. Такі солі не можуть існувати у водних розчинах, тому що цілком розкладаються водою на відповідні основу і кислоту, як, наприклад, сульфід або карбонат алюмінію (Al2S3, Al2(CO3)3 та ін.). У таблицях розчинності проти таких солей стоїть прочерк "-". Про це не можна забувати при складанні рівнянь реакцій обміну між розчинами електролітів. Характер середовища розчину солі визначається більш сильним з утворюючих її компонентів. Так, розчин солі Na2CO3 має лужне середовище (рН>7), тому що ця сіль утворена сильною основою NaOH і слабкою кислотою H2CO3, а розчин солі ZnCl2 – кисле (рН<7), тому що вона утворена сильною кислотою HCl і слабкою основою Zn(OH)2. Якщо ж сіль утворена слабкою кислотою і слабкою основою, то середовище розчину такої солі може бути або слабо кислим, або слабо лужним. Останнє залежить від співвідношення констант дисоціації утворюючих сіль слабкої основи і слабкої кислоти. Оскільки гідроліз – процес оборотний, то зміщуючи його рівновагу (додаванням до розчину солі різних речовин – кислот, основ, води) можна гідроліз зменшити або підсилити. Так, наприклад, гідроліз солі ZnCl2 зменшується при додаванні до розчину кислоти:
Zn2+ + H2O «Zn OH+ + H+ НСl ® H+ + Сl- Підсилити гідроліз можна також шляхом розведення солі або нагріванням. Кількісними характеристиками процесу є ступінь (aг) і константа (Кг) гідролізу. Перша показує частку розчинених молекул солі, що піддалися гідролізу і виражається в % або в частках одиниці:
де Nг – число молекул солі, що піддалися гідролізу; Nзаг – загальна кількість молекул солі. Лабораторна робота 5 Гідроліз солей Правила техніки безпеки: дотримуватися загальних правил безпеки при роботі в хімічних лабораторіях. Необхідні прилади і реактиви: пробірки, розчини хлориду натрію, сульфату алюмінію, карбонату натрію, ацетату натрію, хлориду алюмінію, сульфату амонію, дистильована вода, кристалічні сульфіт й карбонат натрію, фенолфталеїн. Виконання досліду Концентрація розчинів Теоретична частина В різноманітних наукових і технічних розрахунках застосовують різні способи вираження концентрації розчинів. Розчинами називають однорідні суміші двох або кількох речовин. За агрегатним станом розчини поділяють на газуваті, рідкі і тверді. За властивістю розчинятися в тому чи іншому розчиннику речовини поділяють на необмежено й обмежено розчинні. Розчини обмежено розчинних речовин бувають ненасиченими, насиченими та пересиченими. До ненасичених розчинівналежать такі, в яких речовина за даних умов ще може розчинятися. Насиченим розчином називають такий, що перебуває у стані рівноваги з речовиною, яка розчиняється. Кількість речовини, яка припадає за даних умов на певну кількість розчину або розчинника, називають розчинністю речовини. Розчин, в якому розчинної речовини міститься більше, ніж її може розчинитися за даних умов, називають пересиченим. Основним параметром стану розчину, крім температури і тиску, є його склад. Склад розчину кількісно може бути виражений кількома способами. Згідно з рекомендацією ІЮПАК концентрацією розчиненої речовини називають відношення кількості або маси розчиненої речовини до об'єму розчину. Концентрацію виражають у молях на літр або у грамах на літр. Концентрація — це відношення не однотипних величин. Відношення однотипних величин, наприклад відношення маси розчиненої речовини до маси розчину, називають часткою. Отже, склад розчину можна виразити як концентрацією, так і часткою розчиненої речовини. Масова частка — це відношення маси розчиненої речовини до маси розчину. Масову частку виражають у частках одиниці або у відсотках (наприклад, 0,4 або 40 %) і позначають літерою ω (омега). Молярна концентрація — це відношення кількості розчиненої речовини до об'єму розчину. Молярністьвиражають у молях на літр і позначають літерою М. Молярна концентрація еквівалента — це відношення еквівалентної кількості розчиненої речовини до об'єму розчину, її виражають у молях на літр і позначають літерою «н», а у формулах для обчислення — Сек. Кількісний склад розчину можна виражати також через моляльність — число молів розчиненої речовини в 1000 г розчинника. Іноді (на виробництві) склад розчину виражають через його густину. Густину розчину наближено визначають спеціальним приладом — ареометром. За відомою густиною розчину за спеціальними таблицями можна встановити масову частку розчиненої речовини у відсотках. Склад розчину також виражають титром. Титром називають кількість грамів розчиненої речовини, що міститься в І мл розчину. Розчинність речовини часто виражають її масою, що міститься в 100 масових частках розчинника. Наприклад, розчинність хлориду натрію за температури 18 °С дорівнює 35,86 г у 100 г води. Якщо реакції відбуваються між розчинами речовин, їх концентрації зручно виражати через молярну концентрацію еквівалента. У цьому разі легко обчислити, в яких об'ємних відношеннях слід змішати розчини, щоб розчинені речовини прореагували без залишку. Основна перевага таких розчинів полягає в тому, що ро
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 302; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.141.202 (0.181 с.) |




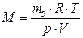 ,
,






 температурах
температурах
 приблизно розраховують по рівнянню:
приблизно розраховують по рівнянню: - Т× DS
- Т× DS 
 ,
,

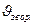



 , а [ОН -] =
, а [ОН -] =  .
.



