Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электрод для измерения концентрации сероводорода и ионов сульфида⇐ ПредыдущаяСтр 11 из 11
1. Общие сведения, основные технические характеристики. 1.1. Электрод изготовлен с применением чувствительного элемента из серебряной проволоки, покрытой сульфидом серебра, или мембраны, изготовленной из сульфида серебра, и предназначен для определения активности (концентрации) ионов сульфида и концентрации сероводорода в интервале концентрации иона S2- 10-7 - 1моль/л. 1.2. Температура анализируемой среды: 0 - 175ºС. 1.3. Давление анализируемой среды: 1 – 1000 атм. 1.4. Крутизна характеристики электрода при 25ºС не менее 27мВ/лог. ед. S2-. 1.5. Электрическое сопротивление электрода при 25ºС не более: проволочного - 10кОм, мембранного - 1МОм. 1.6. Погрешность определения S2- не более ± 0, 1рS2-. 1.7. Ресурс электрода - 1год. 2. Конструкция электрода. 2.1. Электрод состоит из чувствительного элемента, электроввода и резиновой трубки, заполненной силиконовым маслом. 2.2. В качестве чувствительного элемента используется серебряная проволока 1 (рисунок 24), покрытая сульфидом серебра 2 или мембрана 1, спрессованная из сульфида серебра (рисунок 25). 3. Хранение и подготовка к работе. 3.1. Электрод следует хранить в сухом виде.Перед работой электрод следует вымочить в дистиллированной воде. 3.2. При образовании на поверхности электрода пленки органических веществ, ее следует снять, осторожно промывая спиртом или ацетоном. При необходимости свойства прессованного сульфидсеребряного электрода можно восстановить шлифовкой рабочей поверхности мембраны мелкой наждачной шкуркой.
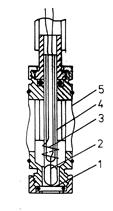
Рис. 24 - Конструкция проволочного сульфидсеребряного электрода
Рис. 15 - Конструкция мембранного сульфидсеребряного электрода
4. Калибровка сульфидного электрода по сероводороду. 4.1. Калибровка сульфидного электрода производится в буферных растворах, насыщаемых сероводородом с одновременным измерением температуры, рН, атмосферного давления и ЭДС сульфидного электрода относительно электрода сравнения при той же температуре. На электроде происходит реакция Ag2S + 2Н+ + 2е- = Ag + H2S ЭДС этой реакции равна E=E0+(RT/2F)*ln([H+]2/[H2S])=E0-ln10*RT*pH/F-(RT/2F)*ln[H2S] где [H2S] - парциальное давление сероводорода, равное атмосферному давлению, за вычетом давления паров воды при этой температуре. На практике применяется величина концентрации сероводорода, равная табличной растворимости сероводорода (при 1атм H2S), умноженной на парциальное давление сероводорода и деленной на измеренное атмосферное давление.
Для каждой температуры строится график зависимости величины E+(RT/2F)*ln[H2S] от pН для области pН < pК диссоциации сероводорода. Эти линии должны пересекаться в одной точке. Для каждой температуры рассчитывается тангенс угла наклона калибровочного графика. Для области pH > pК при каждой температуре строится прямая через пересечение калибровочного графика с величиной pН = pК при этой температуре, но с тангенсом угла наклона вдвое меньшим, чем рассчитанный ранее. При измерениях вместе с величиной ЭДС системы необходимо измерять температуру и pН. Далее по калибровочному графику находится величина E0-lnl0*RT*pH/F. Концентрация сероводорода рассчитывается из уравнения (RT/2F)*ln[H2S] = -Е + (Е0 – lnl0*RT*pH/F) 4.2. Калибровку следует производить в буферных растворах с pН 1,68, 4,01, 6,86, 9,18 при не менее чем трех температурах. 4.3. Буферные растворы насыщаются сероводородом барботированием при температуре калибровки не менее 20 минут. 4.4. Одновременно измеряются температура раствора, атмосферное давление, pН и ЭДС сульфидного электрода относительно электрода сравнения. 4.5. Раствор следует перемешивать магнитной мешалкой. 4.б. Обработка результатов калибровки производится по следующей схеме: для каждой температуры рассчитывается концентрация сероводорода по формуле CH2S=CTH2S*(Pобщ-РН2О)/Р где CTH2S - табличная растворимость сероводорода при данной температуре, Робщ - атмосферное давление, PН2О - табличное значение давления паров воды при этой температуре, Р - нормальное атмосферное давление. 4.7. Для каждой точки рассчитывается величина E*=E+(RT/2F)*lnСH2S 4.8. Для каждой температуры строится график зависимости величины Е* от pН, для pН < pК диссоциации сероводорода при данной температуре. 4.9. Ищется точка пересечения калибровочного графика при каждой температуре с величиной pН = pК диссоциации сероводорода при данной температуре. Через эту точку производится прямая в область pН > pК С тангенсом угла наклона вдвое меньшим, чем тангенс угла наклона построенной части калибровочного графика. Если есть точка калибровки с pН > pК, прямая должна пройти через нее.
5.Проведение измерений концентрации сероводорода. 5.1. При проведении измерений необходимо измерять ЭДС сульфидного электрода относительно электрода сравнения, температуру и pН. 5.2. Находится точка пересечения калибровочного графика при данной температуре с измеренной величиной рН и определяется соответствующая величина Е*. 5.3. Концентрация сероводорода рассчитывается из уравнения (RT/2F)*lnCH2S = Е* - Е 6. Калибровка по активности сульфид-иона. 6.1. Калибровку следует производить, по крайней мере, по двум растворам, охватывающим начало и коней измеряемого диапазона pS. 6.2. В качестве калибровочных при определении активности S2- используются буферные растворы. 6.3. Перед погружением электрода в раствор он ополаскивается дистиллированной водой. Оставшиеся капли воды осторожно снимаются с мембраны фильтровальной бумагой. 6.4. При калибровке желательно перемешивание растворов с помощью магнитной мешалки (особенно важно при низких концентрациях S2-) 6.5. Калибровку можно производить по отношению либо к погружному электроду сравнения, либо к обычному стандартному электроду сравнения ЭВЛ-1М. В последнем случае при измерениях зондом надо вводить поправку на разницу потенциала электродов сравнения (в пределах 6-10 мВ). 6.6. Для перехода от активности к концентрации необходимо учесть коэффициент активности S2-, зависящий от ионной силы исследуемого раствора. 6.7. Результаты калибровки наносятся на диаграмму в координатах pS - Е. Для каждой температуры строится калибровочный график (он должен представлять прямую линию). Определяется тангенс угла наклона калибровочных графиков (в идеальном случае он равен bТ = lnl0*R/2F, или при 25°С около 29 мВ/рН) И величина b (при 25ºС b ≈ 0,099 мВ/рН*Т>. Определяются координаты точки пересечения калибровочных графиков (изопотенциальной точки, т.е. точки, где эдс системы при фиксированном pS не зависит от температуры) Еisp и pSisp. 6.8. При измерениях PS рассчитывается по уравнению:
Таблица 7 - Растворимость сероводорода в воде (в моль на кг Н2О) и значения отрицательного логарифма первой константы диссоциации сероводородной кислоты.
Таблица 8 - Значения pS контрольных растворов
Таблица 9 - Значения pS контрольных растворов
6 Электрод мембранный для определения NO3-
1. Общие сведения, основные технические характеристики. 1.1. Электрод изготовлен с использованием мембраны электрода 203 (кооп. Потенциал, г. Ленинград) и предназначен для определения активности (концентрации) иона NО3- прямым потенциометрическим методом в пределах 0,35-4,0 pNО3-, при рН растворов от 2 до 9. Контролируемая среда не должна содержать ионов I-, Вr-. 1.2. Температура анализируемой среды: от 1 до 50ºС. 1.3. Давление анализируемой среды: 1 - 500 атм. 1.4. Крутизна характеристики электрода при 25ºС не менее 50 мВ/лог.ед. NО3-. 1.5. Электрическое сопротивление электрода при 25ºС порядка 1М Ом. 1.6. Электрод селективен в присутствии ионов Cl-, F-, НСО3-, СН3СООН-, SO42- при превышении их концентраций над концентрацией NО3- соответственно в 100, 1000, 500, 500 и 1000 раз. 1.7. 90%-ныи ресурс - 500 час. 1.8. Погрешность определения активности иона NО3-, ±0,05 ед. pNO3- 2. Конструкция электрода. 2.1. Электрод состоит из электроввода 1, рабочей части электрода 2 и соединительной трубки 3, изготовленной из маслостойкой резины, заполненной силиконовым маслом. 2.2. Рабочая часть электрода представляет собой пластмассовую трубку с приклеенной мембраной, с которой снимается потенциал. 3. Подготовка к работе и хранение. 3.1. Электрод предварительно следует вымочить в течение 24 часов в растворе 0,001М KNO3, при комнатной температуре. 3.2. Электрод хранить, в сухом виде или (при непродолжительных перерывах) в растворе 0.001М KNO3. Сухой электрод перед работой необходимо вымочить в этом растворе.
Рисунок 26 - Конструкция NО3 - электрода
4. Калибровка электрода. 4.1. Калибровку производить, по крайней мере, по двум растворам, охватывающим начало и конец измеряемого диапазона pNO3. 4. 2. В качестве калибровочных при определении активности NО3- используются растворы KNО3:
4.3. Перед погружением электрода в раствор он ополаскивается дистиллированной водой. Оставшиеся капли воды осторожно снимаются с мембраны фильтровальной бумагой.
4.4. При калибровке желательно перемешивание растворов с помощью магнитной мешалки (особенно важно при низких концентрациях NО3-). 4.5. Калибровку можно производить по отношению либо к погружному электроду сравнения, либо к обычному стандартному электроду сравнения ЭВЛ-1М. В последнем случае при измерениях зондом надо вводить поправку на разницу потенциала электродов сравнения (в пределах 6-10 мВ). 4.6. Для перехода от активности к концентрации необходимо учесть коэффициент активности N03- зависящий от ионной силы исследуемого раствора. 4.7. Результаты калибровки наносятся на диаграмму в координатах pN03- - Е. Для каждой температуры строится калибровочный график (он должен представлять прямую линию). Определяется тангенс угла наклона калибровочных графиков (в идеальном случае он равен bТ = ln10*R/F, или при 25ºС около 59мВ/рН) и величина b (при 25ºС b ≈ 0,198мВ/рН*Т). Определяются координаты точки пересечения калибровочных графиков (изопотенциальной точки, т.е. точки, где эдс системы при фиксированном рNO3 не зависит от температуры) Еisp и pNO3isp. 4.8. При измерениях pNO3 рассчитывается по уравнению:
7 Электрод для измерения Na+
1. Общие сведения, основные технические характеристики. 1.1. Электрод изготовлен с использованием чувствительного элемента (стеклянного шарика) от электрода 110 (кооператив "Потенциал", г.Ленинград) и предназначен для измерения рNa+ в пределах -0,5 - 4,0 (при 25 С). 1.2. Температура анализируемой среды: от 1 до 60ºС. 1.3. Давление анализируемой среды: 1 - 500 атм. 1.4. Крутизна характеристики электрода при 25ºС не менее 0,98 от теоретического значения. 1.5. Электрическое сопротивление электрода при 25ºС не более 500 МОм. 1.6. Электрическое сопротивление изоляции электроввода не менее 1011 0м 1.7. Ресурс - 1 год. 1.8. Погрешность определения рNa+ не более ±0,05. 2. Конструкция электрода. 2.1. Электрод состоит из электроввода 3, рабочей части электрода и соединительной трубки 6, изготовленной из маслостойкой резины и заполненной силиконовым маслом. 2.2. Рабочая часть электрода представляет собой стеклянную трубку из стекла С—090 с чувствительным шариком 5, внутри которой находится хлорсеребряный электрод. в качестве внутреннего электролита используется 0,05 М Раствор NaCl. От силиконового масла раствор отделен пробкой из фторкаучуковой резины. 3. Подготовка к работе и хранение. 3.1. Электрод предварительно следует вымочить в течение 24 часов в 0,01 н растворе NaCl.
Рисунок 27- Конструкция Na-— электрода.
3.2. При непродолжительных перерывах электрод хранить в 0,01н NaCl. нe следует допускать, высыхания электрода. 3.3. В случае больших перерывов - хранить в сухом виде, а перед началом эксплуатации снова вымочить в NaCl. 3.4. При образовании на поверхности электрода пленки органических веществ, ее следует снять, осторожно протирая спиртом или ацетоном.
4. Калибровка электрода. 4.1. Калибровка электрода проводится по стандартным растворам NaCl концентраций 10-14 – 1 Н (см. таблицу 6.3.9). Калибровка производится, по крайней мере, по двум растворам, охватывающим начало и конец измеряемого диапазона pNa. 4.2. Перед погружением электрода в раствор он ополаскивается дистиллированной водой и осторожно высушивается фильтровальной бумагой. 4.3. При калибровке желательно перемешивание растворов с помощью магнитной мешалки. 4.4. Калибровку можно производить по отношению либо к погружному электроду сравнения, либо к обычному стандартному электроду сравнения ЭВЛ-1М. В последнем случае при измерениях зондом надо вводить поправку на разницу потенциала электродов сравнения (в пределах 6-10 мВ). 4.5. Для перехода от активности к концентрации необходимо учесть коэффициент активности Na, зависящий от ионной силы исследуемого раствора. 4.6. Результаты калибровки наносятся на диаграмму в координатах pNa - Е. Для каждой температуры строится калибровочный график (он должен представлять прямую линию). Определяется тангенс угла наклона калибровочных графиков (в идеальном случае он равен bТ = lnl0*R/F, или при 25°С около -59мВ/рН) И величина b (при 25ºС b ≈ -0,198мВ/рН*Т). Определяются координаты точки пересечения калибровочных графиков (изопотенциальной точки, т.е. точки, где эдс системы при фиксированном pNa не зависит от температуры) Еisp. и PNaisp 4.7. При измерениях pNa рассчитывается по уравнению:
Таблица 10 - Состав растворов и значения pNa
Датчик кислорода 1. Общие сведения, основные технические характеристики. 1.1. В качестве датчика кислорода используется амперометрический датчик Кларка. 1.2. Температура анализируемой среды: 0-40ºС. 1.3. Давление анализируемой среды: 1-600 атм. 1.4. Минимально определяемая концентрация кислорода 0,3мг/л. 1.5. Максимально определяемая концентрация кислорода 20мг/л. 1.6. Электрическое сопротивление изоляции электроввода не менее 1011 Ом при 25ºС. 2. Конструкция датчика 2.1. Датчик кислорода состоит из электроввода, рабочей части датчика и соединительной трубки, изготовленной из маслостойкой резины, заполненной силиконовым маслом. 2.2. Рабочая часть датчика представляет собой цилиндр из оргстекла с кольцевой выемкой по боковой поверхности, закрытой тонкой резиновой диафрагмой 5, посредством которой датчик разгружен по давлению. В цилиндре расположен чувствительный элемент 4 с платиновым рабочим электродом 2 на торце и хлорсеребряным вспомогательным электродом 3. Платиновый электрод прижат к мембране 1 из фторопластовой пленки толщиной 20 – 30 мкм. Фторопластовая мембрана с одной стороны и чувствительный элемент с другой стороны уплотнены резиновыми кольцами и прижаты титановыми гайками. Датчик заполнен 0,7М раствором KCl. 2.3. На рабочий платиновый электрод подается постоянное напряжение -0,7 В относительно вспомогательного хлорсеребряного электрода.
Рисунок 28 - Конструкция датчика кислорода
3. Подготовка к работе и хранение. 3.1. Для подготовки электрода к работе следует отвернуть титановые гайки и снять старую мембрану и вытащить чувствительный элемент. 3.2. Наложить на торец корпуса датчика с надетым на него резиновым кольцом новую мембрану (квадрат ≈ 20х20мм), прижать ее кольцом из оргстекла и обрезать ножницами по краю кольца. 3.3. Навинтить титановую гайку. 3.4. Заполнить корпус датчика 0,7М КCl, избегая образования пузырей. 3.5. Вставить чувствительный элемент и завинтить титановую гайку. При этом торец чувствительного элемента должен натянуть фторопластовую мембрану. 3.6. При кратковременных перерывах в работе электрод следует хранить, погруженным в воду. При длительных перерывах электрод следует хранить в сухом виде, вылив из него раствор и промыв дистиллированной водой. 3.7. При образовании на поверхности мембраны пленки органических веществ - сменить мембрану. 4. Калибровка электрода 4.1. Калибровка электрода производится по воде, насыщенной воздухом и 2% свежеприготовленному раствору Na2SO3. 4.2. Перед погружением электрода в раствор он ополаскивается дистиллированной водой. 4.3. При калибровке желательно перемешивание растворов с помощью магнитной мешалки. 4.4. Содержание кислорода в 2% свежеприготовленном растворе Na2SO3, принимается равным 0. 4.5. Для приготовления раствора следует отвесить 4г безводного сульфита натрия и растворить в 200г дистиллированной воды, осторожно перемешивая стеклянной палочкой. 4.6. Для определения нулевого тока датчика Iº следует погрузить датчик в раствор Na2SO3, следя за тем, чтобы на мембране не было воздушных пузырьков. Примерно через 5мин снять показания (после установления значения). Нулевой ток обычно не превышает 1 нА. 4.7. Для определения рабочего тока датчика Ip0 следует погрузить датчик в воду, в течение З мин насыщавшуюся воздухом путем барботажа, и после установления показаний датчика снять их значение. 5. Расчет концентрации кислорода.- 5.1. Расчет концентрации кислорода при температуре, соответствующей температуре калибровки, ведется по формуле
где I - показания датчика; С0О2 – табличная концентрация кислорода в воде, насыщенной воздухом при данной температуре. 5.2. Расчет концентрации кислорода при температуре, отличной от температуры калибровки, ведется по формуле:
где К0 и Кt - коэффициенты чувствительности датчика при температуре калибровки и температуре измерения соответственно (см. таблицу 11). Таблица 11- Значения растворяемых концентраций кислорода при насыщении воды атмосферным воздухом
Условия насыщения: атмосферное давление 1015,25 ГПа. Относительная влажность 100%, содержание кислорода в воздухе 20,4% объемных.
Таблица 12- Зависимость чувствительности датчика кислорода от температуры
ток/концентрация = 1 + 0,10165Т – 0,0021578Т2 + 0,000073777Т3
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 358; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.106.232 (0.089 с.) |