
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В качестве индикаторного электрода могут использоваться ртутный, платиновый, графитовый и другие электроды.
В качестве электродов сравнения можно использовать донную ртуть, насыщенный каломельный или хлорсеребряный электрод. Преимущество отдается насыщенному каломельному электроду (НКЭ). При изучении процессов восстановления определяемого вещества на РКЭ, подаваемое напряжение Е должно расходоваться на поляризацию анода ЕА, поляризацию катода ЕК и на преодоление внутреннего сопротивления электролита iR:
Е = ЕА – ЕК + iR В полярографии электролиз проводят в специальных условиях: 1) индикаторный РКЭ (катод) по площади должен быть намного меньше электрода сравнения (анод) и анод не должен поляризоваться; 2) в электрохимической ячейке должен присутствовать довольно концентрированный (0,1 – 1,0 М) раствор индифферентного фонового электролита, катионы которого не восстанавливаются в изучаемой области потенциалов. Присутствие фонового электролита значительно уменьшает внутреннее сопротивление раствора; 3) концентрация определяемого вещества 10-3_10-5 М.
При соблюдении этих условий на РКЭ создается достаточно большая плотность тока и все напряжение, подаваемое на ячейку, расходуется только на поляризацию РКЭ и тогда Е = – ЕК. Вещества, восстанавливающиеся на катоде, называются деполяризаторами.
Рис. 14 Схема полярографической установки (а): 1 – источник постоянного тока; 2 – резервуар с ртутью; 3 – капающий ртутный электрод (катод); 4 – насыщенный каломельный электрод (анод); 5 – солевой мостик; 6 – ячейка; 7 – микроамперметр; 8 – вольтметр. Типичная полярограмма (б) деполяризатора (I) и фона (II).
В начале процесса (рис. 14б) при увеличении напряжения ток практически не меняется (остаточный ток), при достижении определенного значения потенциала (Е разложения) ток резко возрастает за счет диффузии деполяризатора из объема раствора к катоду (диффузионный ток) и катодной реакции:
Скорость диффузии пропорциональна разности концентраций в приэлектродном слое и в остальной массе раствора. Когда скорость диффузии станет равной скорости разряда ионов, т.е. количество диффундирующих ионов будет равно количеству ионов, разряжающихся на электроде, ток перестанет меняться (предельный ток). Благодаря такому ходу электролиза вольтамперная кривая имеет S -образную форму и называется полярографической волной (полярограммой). Основным уравнением в полярографии является уравнение Ильковича:
Iпр = 607nD1/2Cm2/3t1/6
где n – число электронов принимающих участие в реакции; D – коэффициент диффузии, см2/с; m – скорость вытекания ртути из капилляра, мг/с; t – время капания, с; C – концентрация электроактивных ионов, ммоль/л.
При постоянстве условий эксперимента: Iпр = К . С. Если скорость процесса ограничена скоростью диффузии вещества к электроду, то предельный ток равен диффузионному
Iпр = Iдиф
Для проведения количественного анализа готовят серию стандартных растворов с различной концентрацией деполяризатора. Записывают полярограммы этих растворов, определяют значение предельных токов и строят градуировочный график I = f(C), который и используют для количественного определения деполяризатора в исследуемом интервале концентраций. Уравнение для потенциала в любой точке полярографической волны (уравнение Ильковича – Гейровского)
Если известно число электронов, то графическое решение этого уравнения позволяет оценить обратимость электродного процесса. В координатах Уравнение полярографической волны записывается следующим образом:
где I – ток (мкА) в любой точке восходящего участка полярограммы; IПР - предельный диффузионный ток (мкА); Е1/2 – потенциал, отвечающий поло-вине диффузионного тока, В.
Величина Е1/2 характеризует природу деполяризатора, так как связана с
При наличии в растворе нескольких полярографически активных ионов получается вольтамперная кривая, состоящая из нескольких ступеней, каждая из которых соответствует определенному значению Е1/2 (полярографический спектр). Перед проведением полярографического анализа необходимо подобрать индифферентный фоновый электролит. Фон не должен разряжаться в исследуемой области потенциалов (рис. 14б), его концентрация примерно в 50 раз выше концентрации деполяризатора. Переменнотоковая полярография отличается от классической постояннотоковой тем, что на электроды наряду с постоянным напряжением, медленно изменяющимся во времени, накладывается переменное напряжение небольшой амплитуды (до 50 мВ). Переменнотоковая вольтамперная кривая имеет форму кривой с максимумом. Пик масимума равен потенциалу полуволны в классическом режиме, а высота пика пропорциональна концентрации определяемого вещества. Метод отличается большей чувствительностью. Минимально определяемая концентрация 10-7 М, разрешающаяся способность при совместном определении смеси ионов намного выше, чем в классической полярографии. Предел обнаружения определяется отношением электролитического тока (определяемого электродным процессом изучаемого вещества) к остаточному току (сумма электролитических токов примесей, емкостного тока, обусловленного заряжением электрического двойного слоя и "шума" измерительной установки). Обычно величина остаточного тока составляет -10-9 А. Поэтому измеряемый электролитический ток должен быть достаточно большим для того, чтобы его можно было отличить от остаточного. В настоящее время используются нестандартные методы измерения (переменнотоковая полярография, квадратноволновая), при этом предел обнаружения снижается до 10-7—10-8 моль/л. Современная вольтамперометрия — высокочувствительный и экспрессный метод анализа неорганических, органических, геохимических, биохимических, медицинских, фармацевтических и других объектов. Это один из наиболее универсальных методов определения следовых количеств веществ. Для ряда элементов метод конкурентоспособен с атомно-абсорбционной спектроскопией. К другим несомненным достоинствам следует отнести возможность одновременного определения нескольких компонентов (в оптимальных условиях эксперимента до четырех-пяти), а также то, что современный полярограф позволяет получить линейную зависимость тока от концентрации в диапазоне 10-8—10-2 М. В вольтамперометрических инверсионных методах определяемое вещество концентрируется электрохимически на рабочем электроде (образуя амальгаму или пленку на поверхности ртутного или твердого электрода), а затем при обратном (электролитическом) процессе переводится вновь в раствор. Так как на границе электрод-раствор исследуемое вещество теперь находится в существенно большей концентрации, чем первоначальная концентрация раствора, то чувствительность определения возрастает во много раз. Раствор во время электролиза перемешивается, чтобы осуществлялся постоянный перенос деполяризатора из раствора. При скорости вращения электрода выше 400 об/мин в приэлектродном слое возникают условия для стационарной диффузии, поэтому вольтамперограмма имеет ту же форму, что и в случае капающего ртутного электрода. Невозобновляющаяся поверхность электрода легко загрязняется продуктами электродной реакции, поэтому для получения правильных и воспроизводимых результатов необходимо проводить перед регистрацией каждой вольтамперограммы механическую, электрохимическую или химическую очистку. После стадии успокоения проводится растворение выделенного вещества.
При исследовании зависимости тока от электродного потенциала, меняющегося линейно со временем, результирующая поляризационная кривая имеет вид пика, положение которого (потенциал полупика (φ /2) характеризует данное вещество (по аналогии с φ/ 2 - характеристической величиной в классической полярографии), а его высота (или площадь) пропорциональна концентрации вещества в растворе (Рис. 15)
Рис.15 Поляризационная кривая: I - cтадия накопления; 2 - стадия растворения; Iеl - электролитический ток; IL - предельный ток; IJ - ток электролитичecкого растворения
В настоящее время в большинстве определений методом инверсионной вольтамперометрии применяются процессы, сопровождаемые образованием амальгам металлов и пленок на вращающихся дисковых электродах. Для определения веществ различных классов существуют определенные типы реакций и в соответствии с природой образующегося осадка подбираются остальные условия и, прежде всего рабочий электрод. Применение твердых электродов, особенно графитовых, с последующим образованием на них пленочных ртутных электродов весьма перспективно. Эти электроды дают правильные и воспроизводимые результаты и позволяют использовать преимущества как ртутных (ртутный электрод является почти идеально поляризуемым в очень широком интервала потенциалов), так и твердых электродов. Электрохимические инверсионные методы являются очень подходящими для определения некоторых тяжелых металлов (In, Си, Тl, Рb, Сd, Sn, Zn) на пленочных ртутных электродах и некоторых благородных металлов (Аg и Нg) на твердых электродах, воспроизводимость полярограмм практически абсолютная. При правильном выборе фонового электролита на инверсионной вольтамперограмме можно наблюдать раздельные пики компонентов смеси. Для примера на рис. приведена анодная инверсионная вольтамперограмма образца речной воды, содержащей следовые количества меди, свинца и цинка.
С помощью таких методов можно успешно определять указанные элементы в сплавах, чистых реактивах, водах, некоторых биологических объектах (в сыворотке крови, моче) и в некоторых продуктах питания. Эти методы находят широкое применение при контроле загрязнений воды и воздуха, для определения различных металлов в пресной и морской воде. Положение волны (пика) на оси потенциалов определяется природой вещества, участвующего в электродной реакции, а величина тока линейно зависит от его концентрации. В оптимальных условиях волны (пики) четко разделяются и возможно одновременное определение четырех-пяти элементов.
Рис.16 Анодная инверсионная вольтамперограмма образца речной воды, содержащей 0,5 мкг/л кадмия, 5 мкг/л меди и по 15 мкг/л цинка и свинца
Адсорбционное концентрирование появилось значительно позднее. Его суть заключается в том, что определяемый элемент накапливают в виде комплекса с адсорбированным на поверхности электрода лигандом. Концентрирование проводят при потенциале максимальной адсорбции лиганда, который устанавливают в предварительных экспериментах, в течение строго контролируемого времени при энергичном перемешивании раствора магнитной мешалкой. После выключения мешалки и успокоения раствора регистрируют катодную вольтамперограмму, изменяя потенциал электрода к более отрицательным значениям. На вольтамперограмме наблюдается пик восстановления иона металла из комплекса, сконцентрированного на поверхности электрода, или реже пик восстановления лиганда из этого комплекса. При контролируемых условиях (состав фона, рН, потенциал и время адсорбции, площадь поверхности электрода, скорость перемешивания) высота пика линейно зависит от концентрации иона металла в растворе. Этот метод анализа получил название "адсорбционная катодная инверсионная вольтамперометрия" или просто " адсорбционная вольтамперометрия". В последнее двадцатилетие это один из самых надежных и чувствительных методов определения следовых количеств элементов в разнообразных объектах, особенно в объектах окружающей среды. К числу наиболее часто применяемых лигандов для адсорбционного концентрирования относятся 8-оксихинолин, пирокатехин, диметилглиоксим (табл. 3)
Таблица 3. Примеры определения микроэлементов методом адсорбционной вольтамперометрии
По сравнению с анодной инверсионной вольтаперометрией адсорбционная вольтамперометрия обладает рядом преимуществ. Главное из них заключается в том, что определяемый элемент можно концентрировать не только в нулевой степени окисления, то есть в виде металла, но и в любой другой степени окисления, при которой может образоваться устойчивый комплекс с адсорбированным лигандом. Это значительно расширяет круг определяемых элементов и позволяет оределять следы таких элементов, как молибден, железо, никель, кобальт и др. Важно также то, что определяемый элемент концентрируется в виде моно-молекулярного слоя на поверхности электрода (диффузия в объем электрода отсутствует) и поэтому весь концентрат легко принимает участие в электродной реакции при катодной развертке потенциала. В результате аналитический сигнал заметно возрастает, что и обеспечивает достижение пределов обнаружения на уровне
10−10—10−11 моль/л (см. табл. 2). Основные источники погрешностей в методе адсорбционной вольтамперометрии: конкурирующая адсорбция ионов других металлов, образующих комплекс с используемым лигандом.
Экспериментальная часть
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 206; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.36.141 (0.023 с.) |



 – E обратимая полярографическая волна выражается котангенсом угла наклона, равным 59/n мВ (25°С).
– E обратимая полярографическая волна выражается котангенсом угла наклона, равным 59/n мВ (25°С).

 - стандартный потенциал полуреакции;
- стандартный потенциал полуреакции; и
и  – коэффициенты диффузии атома металла в ртути и иона металла в растворе;
– коэффициенты диффузии атома металла в ртути и иона металла в растворе;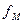 и
и  – коэффициенты активности атома металла в ртути и иона металла в растворе.
– коэффициенты активности атома металла в ртути и иона металла в растворе. исследуемой окислительно-восстановительной системы и зависит от концентрации и состава фонового раствора. Е1/2 является постоянной величиной для данного деполяризатора, восстанавливающегося на определенном фоне. Потенциалы полуволн различных элементов на различных фонах сведены в таблицы. Сравнивая полученное значение Е1/2 со справочными, можно проводить качественный анализ.
исследуемой окислительно-восстановительной системы и зависит от концентрации и состава фонового раствора. Е1/2 является постоянной величиной для данного деполяризатора, восстанавливающегося на определенном фоне. Потенциалы полуволн различных элементов на различных фонах сведены в таблицы. Сравнивая полученное значение Е1/2 со справочными, можно проводить качественный анализ.




