
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Виды ионоселективных электродов
Современные ионоселективные электроды можно разделить на несколько классов в соответствии с материалом чувствительной мембраны: стеклянные, с кристаллической и ПВХ-мембранами, сенсибилизированные (активированные), к которым относят газочувствительные и ферментные электроды.
Электроды с кристаллической мембраной изготавливаются в пластиковых корпусах. При потере чувствительности электроды этого типа (все кроме фторидного) могут быть восстановлены зачисткой рабочей поверхности на мелкой шкурке. Наиболее совершенным электродом с твердой кристаллической мембраной является фторид-селективный электрод. Eдинственным мешающим ионом является ион ОН-, поэтому измерения рекомендуется проводить при рН 5,5 — 6,5. Материал чувствительной мембраны - монокристалл LaF3 обладает высокой химической стойкостью и долговечностью, что обеспечивает значительный ресурс работы электрода. Зачистка рабочей поверхности электрода абразивными материалами не допускается. В электродных системах с твердыми мембранами в качестве чувствительного элемента используют соединения, обладающие ионной, электронной или смешанной электронно-ионной проводимостью при комнатной температуре. Обычно в таких соединениях (LaF3, AgCl-Ag2S), число которых крайне невелико, в процессе переноса заряда участвует только один из ионов кристаллической решетки, имеющий, как правило, наименьший ионный радиус и наименьший заряд. В этом случае у них полярная проводимость обеспечивает высокую избирательность электрода. Перенос заряда в таких соединениях происходит за счет дефектов кристаллической решетки в соответствии с механизмом, при котором вакансии занимаются свободными соседним и ионами. Категорически запрещается касаться поверхности электродов острыми предметами, это выводит из строя мембрану. Появившиеся на поверхности твердых электродов царапины удаляют тонкой наждачной бумагой, после чего поверхность мембраны полируют полиритом или пастой ГОИ.
Рис 4. Ионоселективный электрод с твердой мембраной: 1 – мембрана; 2 – корпус электрода; 3 – внутренний раствор (0,1 М растворы определяемого иона и хлорида калия); 4 – внутренний Ag/AgCl полуэлемент; 5 – место припоя; 6 – экранированный провод.
Сенсибилизированные (активированные) — это датчики, объединяющие индикаторный электрод и электрод сравнения и имеющие газопроницаемую мембрану или воздушный зазор для отдeления анализируемого раствора от тонкой пленки промежуточного раствора электролита. Он взаимодействует с определяемым газом, при этом изменяется какой-то параметр промежуточного раствора, например рН, что и фиксирует ионоселективный электрод. Отклик ионоселективного электрода пропорционален парциальному давлению определяемого компонента (SO2, H2S, NH3, HF, CO2) в анализируемом газе.
Ферментные электроды – это датчики, в которых ионоселективный электрод покрыт пленкой, содержащей фермент, способный вызвать реакцию органического или неорганического вещества с образованием веществ (ионов, молекул), на которые реагирует электрод. В основе работы электрода лежит ферментативная реакция:
В результате образуется частица, обусловливающая отклик электрода. Поэтому за изменением ее концентрации можно проследить с помощью ионоселективного электрода. Селективность ферментных электродов очень высока, поскольку каждый фермент катализирует только какую-то определенную реакцию.
Стеклянные ионоселективные электроды из всех обладают наилучшими эксплуатационными характеристиками. Наиболее часто применяемыми электродами из этой группы являются Na — селективные. Основным мешающим ионом являются ион водорода (Н+), поэтому при измерении должно соблюдаться соотношение pH-pNa > 3,5. Первым ионоселективным электродом был стеклянный электрод для измерения рН. Главной частью электрода является тонкая стеклянная рН-чувствительная мембрана. Внутренним раствором служит 0,1 М раствор соляной кислоты, насыщенный хлоридом серебра. Чувствительностью к ионам водорода обладает только хорошо вымоченная мембрана, т.е. электрод обладает водородной функцией:
Е = соnst + 0,059 lg а H+
В слагаемое соnst входят величины потенциалов внешнего и внутреннего электродов сравнения и потенциал асимметрии, определяемый состоянием стеклянной мембраны. Для градуирования стеклянного электрода используются буферные смеси, потенциал лучших современных стеклянных электродов линейно зависит от pH приблизительно от - 1 до 14. Изменяя состав стекла, можно получать мембраны, обладающие пониженной селективностью к ионам Н+ и высокой селективностью к ионам М+., созданы и применяются в аналитической практике электроды для определения ионов натрия, калия и др.
Стеклянный электрод– это условное название системы, включающей небольшой сосуд из изолирующего стекла, к нижней части которого припаян шарик из специального электродного стекла, обладающего электропроводностью (рис.5). Внутрь сосуда заливают стандартный раствор. В качестве внутреннего стандартного раствора в стеклянном электроде используют 0,1 М раствор хлороводородной кислоты обычно с добавкой хлорида натрия или калия. Можно использовать также какой-либо буферный раствор с добавкой хлоридов или бромидов. Токоотводом служит хлоридсеребряный электрод, представляющий собой серебряную проволоку, покрытую хлоридом серебра. К токоотводу припаивают изолированный, экранированный провод.
Рис 5. Стеклянный электрод: 1 – тонкостенный стеклянный шарик; 2 – раствор НСl или буферный раствор; 3 – хлоридсеребряный электрод; 4 – защитная трубка.
Стеклянный электрод обычно используют в паре с хлоридсеребряным электродом сравнения. Применяемую при этом электрохимическую цепь можно записать следующим образом:
Перед работой стеклянный электрод вымачивают в 0,1 М НСl. При этом ионы водорода из раствора обмениваются на ионы натрия из стеклянной мембраны, и в системе устанавливается равновесие. Электродная реакция на стеклянном электроде сводится к обмену ионов водорода между раствором и стеклом Н+ (раствор) — Н+ (стекло) и не связана с переходом электронов. Выпускаемые серийно стеклянные электроды для измерения рН (ЭСЛ-11Г-05, ЭСЛ-41Г-04,ЭСЛ-63-07, ЭСЛ-43-07) пригодны для работы в интервале рН от 0 до 14. При работе со стеклянным электродом ни в коем случае нельзя вытирать стеклянный шарик, так как это может разрушить гелевую поверхность электрода! Категорически запрещается царапать поверхность стеклянного электрода острыми предметами, так как толщина стеклянного шарика составляет десятые доли миллиметра и это выведет из строя чувствительный элемент!
Электроды сравнения Основная задача электрода сравнения — создание стабильного опорного потенциала. Он представляет собой ионоселективный электрод (например, на ионы Cl-) погруженный в электролит постоянного состава, контакт с анализируемым раствором осуществляется через специальный барьер (волокно, пористая керамика, шлиф и т.д.), препятствующий смешиванию этих двух жидкостей. Для заполнения электродов сравнения должны применяться строго определенные электролиты. Например, для описанной выше конструкции одноключевого электрода сравнения электролит должен содержать, во-первых, ионы необходимые для работы потенциалопределяющего полуэлемента (для хлорсеребряных электродов это ионы Cl-), а во-вторых, он должен быть «равнопереносящим». Это означает, что ионы, входящие в состав электролита, должны иметь равные (близкие) подвижности. К равнопереносящим электролитам относятся следующие: растворы KCl, KNO3, NH4NO3, NH4Cl и некоторые другие. Чаще всего для заполнения электродов сравнения используют растворы KCl различной концентрации.
Наиболее распространен хлоридсеребряный э лектрод сравнения (Ag,AgCl/KCl). Его изготавливают путем электролитического нанесения хлорида серебра на серебряную проволочку, которую погружают в раствор хлорида калия. Так как в концентрированных хлоридных растворах хлорид серебра растворяется с образованием хлорсеребряных комплексов, растворы хлорида калия перед погружением в них электродов обычно насыщают хлоридом серебра. В соответствии с уравнением Нернста для полуреакции AgClТВ + e- ® Ag + Cl- зависимость потенциала электрода от активности хлорид-ионов описывается уравнением:
Постоянство потенциала элекрода сравнения достигается под держанием в контактирующем внутреннем растворе постоянной концентрации веществ, на которые реагирует электрод. При 25оС потенциал насыщенного хлорид серебряного электрода равен +0,22В. При работе с электродом необходимо следить за тем, чтобы внутренний сосуд был заполнен насыщенным раствором КСl. Хлорид серебряные электроды выпускает отечественная промышленность (ЭВЛ-1МЗ, ЭВЛ -1М1). Кроме хлоридсеребряного электрода в качестве электродов сравнения применяют каломельный и таламидный электроды.
Рис 6. Электроды сравнения хлоридсеребрян ый (а) и каломельный (б): 1 – асбестовое волокно, обеспечивающее контакт с анализируемым раствором, 2- внутренний раствор KCl (насыщ.), 3 – AgCl (тв.), 4 – отверстия для ввода раствора KCl, 5 – паста из смеси Hg2Cl2, Hg, KCl (насыщ.)
Контакт с исследуемым раствором осуществляется посредством солевого ключа (СК). Для элиминирования диффузионного потенциала, возникающего на контакте двух различных по составу и (или) концентрации растворов создается медленное истечение внутреннего электролита, имеющего близкие подвижности аниона и катиона (KCl, KNO3). Постоянное медленное истечение внутреннего раствора является главным условием долговременной и стабильной работоспособности ЭС. В лабораторных условиях при атмосферном давлении истечение обеспечивается разностью уровней растворов в электрохимической ячейке и ЭС (Рис. 7). По мере расходования, внутренний раствор доливается через специальное отверстие.
Рис. 7. Электрохимическая ячейка. 1- стандартный электрод сравнения; 2- Ag/AgCl полуэлемент; 3- солевой ключ; 4- отверстие для заливки внутреннего раствора;
5- ионселективный электрод.
Нарушения режима истечения может быть вызвано 2 причинами: 1. Падением температуры анализируемой воды. Результатом понижения температуры является кристаллизация соли (KCl) в солевом ключе, что снижает скорость истечения. Иногда это приводит к тому, что электролит совсем не течет. В связи с этим очевидна необходимость насыщения раствора солью KCl при той температуре, при которой может эксплуатироваться электрод. 2 Ионами серебра из электрода сравнения, которые могут восстанавливаться, соприкасаясь с анализируемой средой, что будет приводить к нарушению истечения раствора электролита. (Эта неисправность проявляется только в том случае, если раствор электрода сравнения специально насыщается хлоридом серебра для продления срока службы электрода.)
3.6. ИОНОМЕТРИЯ Раздел прямой потенциометрии, где индикаторным электродом cлужит ионоселективный электрод называют ионометрией. Это удобный, простой и экспрессный современный метод: продолжительность анализа определяется в основном временем подготовки пробы, поскольку на само измерение тратится не более 1 — 2 мин. От других физико-химических методов ионометрия отличается, прежде всего, простотой методик и дешевизной измерительных приборов. Современные портативные иономеры с комплектом датчиков или зондов позволяют проводить определение разнообразных ионов и растворенных газов не только в лаборатории, но и в полевых условиях, а также дистанционно и без оператора. Существуют три практических приема в ионометрии: метод градуировки электрода, метод градуировочного графика и метод добавок. Оптимальным, особенно в случае анализа растворов сложного состава, является метод добавок, основанный на измерении потенциала электрода в анализируемом растворе и после введения известного объёма стандартного раствора.
3.6.1. МЕТОД ГРАДУИРОВОЧНОГО ГРАФИКА Метод градуировочного графика состоит в измерении потенциала ИСЭ относительно вспомогательного электрода в анализируемом растворе, с последующим нахождением определяемого компонента по градуировочному графику. Процедура анализа включает в себя градуировку ионоселективного электрода (ИСЭ) и измерение в анализируемой пробе. Градуировка состоит в измерении потенциала ИСЭ в стандартных растворах с известным содержанием определяемого иона. По результатам измерений строится график. В ионометрии принято выражать концентрацию ионов через величину рХ, которая равна pX = - lg a. Поэтому из уравнения Нернста следует, что закономерность изменения потенциала имеет следующий вид: E = B - S pX, где E - разность потенциалов между ИСЭ и электродом сравнения; S - наклон электродной функции; В - константа.
Эта закономерность называется электродной функцией. В координатах Е от рХ градуировка электродов имеет вид прямой, наклон которой приближается к величине 59 мВ для однозарядных ионов. Для двухзарядных ионов наклон равен 29 мВ. Если полученная из градуировки величина наклона существенно отличается от ожидаемой, то это говорит о неблагополучном ходе измерений.
Анализ состоит в измерении потенциала ИСЭ в пробе и вычисления содержания определяемого компонента по градуировочному графику. Важной особенностью метода градуировочного графика является необходимость постоянства условий проведения калибровки и измерений. При проведении измерений следует, прежде всего, уделять внимание уравниванию температуры и ионной силы, как стандартных растворах, так и в анализируемых пробах. Несоблюдение этого условия ведет к увеличению погрешности измерений. На практике калибровка линейна только в определенном диапазоне концентраций. Вне этого диапазона калибровка нелинейна. При проведении анализа нельзя считать достоверными результаты, полученные в результате измерения за границами градуировки, так как градуировочные функции электродов часто бывают нелинейными, и экстраполяция ведет к большим погрешностям. Если в результате измерений в пробе содержание определяемого компонента находится вне границ градуировки, следует провести градуировку заново таким образом, чтобы предполагаемый результат анализа находился между крайними значениями стандартов.
3.6.2. МЕТОД ДОБАВОК Ионометрический метод добавок дает два больших преимущества. Во-первых, если колебание ионной силы в анализируемых пробах непредсказуемо, то применение распространенного метода градуировочного графика дает большие ошибки определения. Применение метода добавок помогает свести к минимуму ошибку определения. Во-вторых, есть категория электродов, использование которых проблематично из-за дрейфа потенциала. При умеренном дрейфе потенциала метод добавок существенно снижает ошибку определения. Известны следующие модификации метода добавок: метод стандартной добавки, метод Грана.
Расчет для метода стандартной добавки выглядит следующим образом:
Cx = D C (10 DE/S - 1)-1, где Cx - искомая концентрация; S - наклон электродной функции.
Расчет методом Грана выглядит несколько сложнее. Он состоит в построении графика в координатах (W+V) 10 E/S от V, где V - объем вводимых добавок; E - значения потенциала, соответствующее вводимым добавкам V; W - начальный объем пробы.
График представляет собой прямую, пересекающуюся с осью абсцисс. Точка пересечения соответствует объему вводимой добавки (DV), которая эквивалентна искомой концентрации иона (см. рис. 3). Из закона эквивалентов следует, что Cx = Cст DV / W, где Cст -концентрация ионов в растворе, который используется для введения добавок. Добавок может быть несколько, что улучшает точность определения по сравнению с методом стандартной добавки.
В обоих случаях фигурирует наклон электродной функции S. Из этого следует, что первым этапом метода добавок является калибровка электродов для последующего определения величины наклона. Абсолютное значение потенциала в расчетах не участвует, так как для получения достоверных результатов важно только постоянство наклона калибровочной функции от пробы к пробе. В качестве добавляемого можно применять не только раствор, содержащий потенциалопределяющий ион, но и раствор вещества, связывающего определяемый ион пробы в недиссоциирующее соединение. Количество связывающего вещества больше, чем потенциалопределяющего.
Преимущества применения метода Грана: 1. Уменьшение погрешности определения в 2-3 раза за счет увеличения числа измерений в одной пробе. 2. Метод добавок не требует стабилизации ионной силы в анализируемой пробе, так как ее колебания отражаются на величине абсолютного значения потенциала в большей степени, чем на величине наклона электродной функции. В связи с этим погрешность определения по сравнению с методом градуировочного графика уменьшается.
3. Метод позволяет контролировать правильность проведения каждого аналитического определения. Контроль производится во время обработки экспериментальных данных. Таким образом, возможность контроля правильности анализа в каждом определении повышает надежность получения результатов. Рис. 9
Оптимальная величина добавки должна быть такой, чтобы она вызывала отклик потенциала в 10-20 мВ для однозарядного иона. Электрод следует всегда перед использованием тщательно отмывать в проточной воде. Полученные результаты нуждаются в корректировке на содержание калия. Большое содержание калия в пробах делают невозможным коррекцию результатов.
|
||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 674; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.172.115 (0.068 с.) |
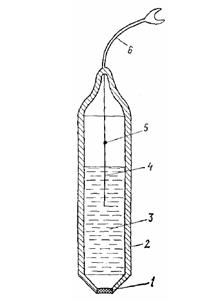






 Рис. 8
Рис. 8



