
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способы производства серной кислоты
Еще в 13 веке серную кислоту получали из железного купороса FeSO 4, откуда и название одного из сортов серной кислоты – купоросное масло. С 18 века серную кислоту получали нитрозным методом, который лишь в середине ХХ века был вытеснен контактным способом. Первая стадия сернокислотного производства – получение сернистого газа из серосодержащего сырья. В качестве сырья могут быть использованы элементарная сера, серный колчедан (пирит), сероводород Н 2 S и т. д. После очистки диоксид серы окисляют до трехоксида в присутствии катализатора. В нитрозном методе катализатором служили оксиды азота. Диоксид серы окисляют в основном в жидкой фазе в башнях (колоннах) с насадкой. Поэтому этот метод называют иначе башенным. Нитрозный метод обладает рядом недостатков, главным из которых является загрязнение атмосферы такими вредными газами, как NO 2, SO 2 и SO 3. Кроме того, получаемая серная кислота имеет низкую концентрацию и загрязнена побочными продуктами. В контактном же способе применяют твердые катализаторы и получают более концентрированную кислоту и без примесей побочных продуктов. Сырье процесса. Кроме упомянутых выше серного колчедана, элементарной серы, сероводорода, источниками сырья для производства серной кислоты могут служить сульфиды металлов: медный колчедан CuFeS2, медный блеск CuS2, сульфаты: гипс CaSO4 На территории России залежей самородной серы нет. Получение газовой серы из сероводорода, извлекаемого при очистке горючих и технологических газов, основано на процессе неполного окисления на твердом катализаторе. При этом протекают реакции:
H2S + 1,5 O2 = SO2 + H2O; H2S + SO2 = 2H2O + 1,5 S2. Значительные количества серы могут быть получены из продуктов производства цветных металлов, например меди:
2FeS2 = FeS +S2; SO2 + C = S + CO2; CS2 + SO2 = 1,5S2 + CO2; 2COS + SO2 = 1,5S2 + 2CO2.
Обжиг серного колчедана. Это гетерогенный высокотемпературный (до 1000о С), необратимый каталитический процесс, включающий ряд стадий. Основная реакция протекает по схеме
4FeS2 +11O2 = 2Fe2O3 + 8SO2 + 3420 кДж/ моль.
При недостатке кислорода протекает иная реакция
3FeS2 + 8O2 = Fe3O4 + 6SO2 + 2440 кДж/ моль.
При окислении сульфида железа на поверхности зерна минерала получается слой оксидов, толщина которого растет по мере выгорания серы из минерала. Общая скорость процесса при этом определяется скоростью диффузии газов в порах этого слоя оксидов. Следовательно, процесс обжига колчедана протекает во внутридиффузионной области. Скорость процесса в целом описывается уравнением
Из уравнения следует, что скорость процесса можно увеличить путем повышения коэффициента массопередачи k, для чего эффективнее всего поднимать температуру. Но при 850–1000 о С материал в печи спекается и резко снижается реакционная поверхность F. Поэтому температура процесса определяется химическим составом и природой колчедана, а также конструкцией печи. Для увеличения движущей силы процесса Для повышения поверхности соприкосновения фаз флотационный колчедан измельчают до размеров частиц 0,3–0,03 мм. Совершенствование технологии обжига колчедана шло от применения механических полочных печей к печам пылевидного обжига и далее к современным печам с кипящим слоем колчедана, которые практически вытеснили все остальные типы печей.
По технологическому оформлению производство серной кислоты из железного колчедана является очень сложным и включает ряд блоков, где последовательно проводят необходимые стадии процесса.
Структурная схема такого производства приведена ниже (рис. 9.4).
I II III
пар хвостовые воздух Н2SO4 газы огарок
Рис. 9.4. Структурная схема производства серной кислоты из колчедана: I – блок получения
Контактный способ производства серной кислоты. Этот способ после получения диоксида серы включает еще 3 стадии: 1) очистку газа от вредных для катализатора примесей; 2) контактное окисление SO 2 в SO 3; 3) абсорбцию SO 3 серной кислотой. Очистка газа. От огарковой пыли газ очищают сначала в циклонах, а затем, после использования теплоты газа, - в сухих электрофильтрах. После печей кипящего слоя доля пыли в газах составляет 200 г/см3, после циклона – 20 г/см3, после фильтров – 0,1 г/см3. Для полного освобождения газа от остатков пыли и более полного отделения от оксидов мышьяка и селена, являющихся каталитическими ядами, необратимо отравляющих катализатор, очистку ведут в промывных башнях серной кислотой концентрацией 93 – 95 %, а затем турбокомпрессором подают в контактное отделение для окисления диоксида серы. Контактное окисление диоксида серы. Это основная стадия процесса производства серной кислоты. Является типичным примером гетерогенного экзотермического каталитического процесса. 2SO2 +O2 = 2SO2 + 189 кДж / моль (при 500 0С). Согласно принципу Ле-Шателье, равновесие в этой реакции должно сдвигаться вправо при повышении давления и снижении температуры. На практике давление не повышают из-за небольших концентраций диоксида серы и кислорода в обжиговом газе (80 % азота). Рост энергетических затрат при повышении давления превышает выгоду от этого приема. Константа равновесия в этой реакции равна Кр = или
где PSO Равновесная степень превращения SO 2 в SO 3 X р = или после преобразований X P = или через концентрации ХР = Зависимость равновесной степени превращения от состава газов при давлении 0,1 МПа и
Таблица 9.2 Влияние параметров процесса на степень превращения SO2 в SO3
Как следует из табл. 9.2, степень превращения SO 2 в SO 3 находится в обратной зависимости от его концентрации. Но при низких концентрациях диоксида серы мала производительность процесса. Поэтому оптимальным считается газ, доля SO 2 в котором составляет 7–9 %, О 2 – Зависимость выхода SO3 от температуры процесса при С SO
400 500 600 700 800 900 1000 Температура, оС
Рис. 9.5. Зависимость выхода SO3 от температуры процесса
Как видно из графика, наибольший выход SO 3 (99,2 %) достигается при 400 о С. Однако при низких температурах мала скорость процесса и, следовательно, производительность процесса. Поэтому при работе на современных ванадиевых катализаторах окисление проводят в несколько стадий с постепенным снижением температуры от 580-600 о С - на первой стадии и до 400–450 о С - на последней.
Скорость процесса окисления SO 2 определяется в первую очередь активностью катализатора, а также параметрами процесса. История развития процесса каталитического окисления SO 2 в SO 3 знает применение трех катализаторов: металлической платины, оксида железа (3) и оксида ванадия (5). Наиболее активна платина, но она дорога и подвержена необратимым отравлениям даже следами мышьяка и селена. Fe2O 3, не подвержен отравлению мышьяком и селеном, но активен при высоких температурах (выше 625 оС), т.е. тогда, когда равновесная степень превращения равна менее 70 % и поэтому применяется лишь для предварительного контактирования до Х = 50–60 %. Ванадиевые катализаторы с содержанием V2O 5 до 7 % - наиболее оптимальные. Они включают в качестве промоторов оксиды щелочных металлов, чаще всего К2О. Катализатор наносят на высокопористые носители – алюмосиликаты. Гранулы катализатора имеют размер не более 1,5 мм и хорошо противостоят диффузионному торможению внутри пор катализатора. Однако мелкие гранулы создают большое гидравлическое сопротивление и поэтому применяют зерна размером 5 мм. На любом катализаторе степень превращения SO 2 возрастает во времени, приближаясь к равновесной по затухающей кривой. Чем выше температура, тем быстрее достигается состояние равновесия и тем ниже равновесный выход. Кинетическое уравнение процесса окисления SO 2 в SO 3 выведено Г.К. Боресковым и описывается следующим образом:
Как видно из данного уравнения, наибольшее влияние на изменение концентрации оказывает концентрация кислорода. На рис. 9.6 представлена зависимость степени окисления SO 2 от времени контакта на ванадиевом катализаторе при различных температурах и давлении 0,1 МПа.
0 0,5 1,0 1,5 2,0 2,5 3, 0 Время, с
Рис. 9.6. Влияние температуры и времени контакта на степень окисления SO2 в SO3 (СSO
Как показано в выше приведенных исследованиях, лимитирующей стадией катализа является сорбция О 2. Повышение концентрации кислорода увеличивает скорость процесса и возможную степень окисления. Но повышая концентрацию кислорода, мы неизбежно снижаем концентрацию SO 2, что приводит к снижению производительности процесса. Кроме того, в силу того, что данная реакция экзотермична, повышение температуры сдвигает равновесие в сторону меньшего значения
На основании изложенного можно заключить, что для достижения максимальной скорости процесса следует начинать его при более высоких температурах (600 о С), а затем снижать по кривой до 400 о С. В реальных процессах подобная технология осуществляется в многополочных контактных аппаратах (см. рис. 9.7).
SO3 в абсорбер SO2 1
Рис. 9.7. Устройство многополочного контактного аппарата 1 - контактный аппарат; 2 – теплообменник
Полочные контактные аппараты хорошо себя зарекомендовали при длительной работе, но громоздки и металлоемки. Обычно это цилиндры диаметром 12 м и высотой 25 м. Производительность – 1000 т серной кислоты в сутки. Катализатор служит в среднем 4 года. Оптимальные условия процесса создаются в контактных аппаратах кипящего слоя. В таких аппаратах применяют износостойкий шариковый ванадиевый катализатор с диаметром частиц 0,75–1,5 мм вместо 4–5 мм в аппаратах с фильтрующим слоем. В отличие от процесса со стационарным слоем катализатора, процесс с кипящим слоем катализатора протекает в кинетической области и обладает большей производительностью. Абсорбция оксида серы (6). Процесс описывается следующей реакцией: SO3 + H2O = H2SO4 + 92 кДж / моль При этом наличие в газовой фазе даже незначительных количеств воды приводит к образованию мельчайших капель серной кислоты, которые образуют стойкий туман, плохо поглощаемый водой, кислотой и даже щелочью. Поэтому в газовой фазе, поступающей на абсорбцию, должны отсутствовать пары воды. Кроме того, парциальное давление паров воды над поглощающей жидкостью должно быть минимальным. Такому требованию наилучшим образом соответствует серная кислота, содержащая 98,3 % H 2 SO 4, как следует из диаграммы кипения системы Н 2 О – SО 3 при атмосферном давлении. Такая кислота отличается ничтожным парциальным давлением как Н2О, так и SO 3. Такая кислота практически полностью поглощает SO 3. При этом кислоту подают в таком избытке, чтобы ее концентрация за один цикл повышалась на 0,2 %. С кислотой отводится и теплота абсорбции. После охлаждения лишь небольшая часть кислоты отбирается в виде готовой продукции, а основная часть после добавки воды или разбавленной кислоты возвращается на абсорбцию. На рис. 9.8. представлена зависимость скорости абсорбции от концентрации кислоты.
Vабс
0 98,3 % Н2SO4
Рис. 9.8. Зависимость скорости абсорбции
Схема двухстадийного процесса абсорбции представлена на рис. 9.9.
газы
H2O Н2О 3 4 1 5
Н2О 6 7 кислота олеум на склад на склад
Рис. 9.9. Схема двухстадийного процесса абсорбции SO3: 1 – холодильник газа; 2 – олеумный абсорбер; 3 - моногидратный аппарат; 4 – сушильный барабан; 5 – холодильники жидкого
На представленной схеме на первой стадии абсорбции SO 3 и абсорбент (20 % олеум) охлаждают до 80 о С перед абсорбцией. На второй стадии в качестве сорбента используют моногидрат. Полная технологическая схема производства серной кислоты контактным способом называют ДК – ДА (двойное контактирование – двойная абсорбция) является гораздо более сложной и включает следующие отделения: 1) печное с сухой очисткой газа; 2) промывное, в котором газ подвергают мокрой очистке от остатков пыли, сернокислотного тумана, контактных ядов и водяных паров; 3) компрессорное; 4) контактное; 5) абсорбционное. Производительность такой установки составляет до 1500 т / сутки по моногидрату. Расходные коэффициенты на 1 т моногидрата таковы: колчедан – 0, 82 т, вода – 50 м 3, электроэнергия – 82 кВт
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 830; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.121.214 (0.08 с.) |
 2H2O, ангидрит CaSO4, мирабилит Na2SO4
2H2O, ангидрит CaSO4, мирабилит Na2SO4  = kF
= kF  . (9.1)
. (9.1) С повышают концентрацию пирита в колчедане и кислорода в зоне обжига. Концентрацию пирита повышают путем флотации руды, а кислорода – применением избытка воздуха, в 1,5–2 раза превышающего стехиометрическое.
С повышают концентрацию пирита в колчедане и кислорода в зоне обжига. Концентрацию пирита повышают путем флотации руды, а кислорода – применением избытка воздуха, в 1,5–2 раза превышающего стехиометрическое. Печь представляет собой цилиндрическо- коническую камеру, в нижней части которой установлен газораспределительная решетка, на которую непрерывно поступает обжиговый материал. Под решетку подается воздух со скоростью, обеспечивающей переход частиц во взвешенное состояние, но недостаточную для выноса частиц материала из печи. Производительность таких печей в 10 раз выше, чем любых других и составляет 1800 кг/м3 реакционного объема в сутки. При этом получают газ, содержащий до 14 % SO 2. Теплоту реакции используют для выработки пара путем помещения в зону реакции теплообменных элементов, в которые подают воду, а получают пар. Производительность по пару составляет 1,3 т/т колчедана.
Печь представляет собой цилиндрическо- коническую камеру, в нижней части которой установлен газораспределительная решетка, на которую непрерывно поступает обжиговый материал. Под решетку подается воздух со скоростью, обеспечивающей переход частиц во взвешенное состояние, но недостаточную для выноса частиц материала из печи. Производительность таких печей в 10 раз выше, чем любых других и составляет 1800 кг/м3 реакционного объема в сутки. При этом получают газ, содержащий до 14 % SO 2. Теплоту реакции используют для выработки пара путем помещения в зону реакции теплообменных элементов, в которые подают воду, а получают пар. Производительность по пару составляет 1,3 т/т колчедана. пирит вода абсорбент 1 2 3 4 5 6 7
пирит вода абсорбент 1 2 3 4 5 6 7 (9.2)
(9.2)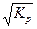 =
=  , (9.3)
, (9.3) ,
,  PSO
PSO  , PO
, PO  (9.4)
(9.4) (9.5)
(9.5) . (9.6)
. (9.6)









 SO2 SO2
SO2 SO2


 2
2








 2
2










 2
2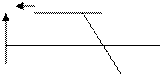






 SO3 5 выходящие моногидрат
SO3 5 выходящие моногидрат


