
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация химических реакторов
В основу классификации химических реакторов положены три принципа: организационно-техническая структура операций, осуществляемых в реакторе, характер теплового режима и режима движения компонентов. По организационно-технической структуре операций химические реакторы делятся на реакторы периодического и реакторы непрерывного действия. Для реакторов периодического действия характерно падение движущей силы процесса во времени вследствие уменьшения концентрации реагентов в ходе процесса. Это приводит к тому, что режим работы реакторов периодического действия нестационарен во времени и требует изменения параметров процесса (температуры, давления и т.д.) для компенсации этого падения и поддержания скорости процесса на заданном уровне (рис. 8.2).
Т, Р
Рис. 8.2. Режим работы реактора периодического действия: С0, С
Для реакторов непрерывного действия характерно постоянство движущей силы процесса во времени вследствие постоянства концентраций реагентов в ходе процесса. Поэтому режим работы таких реакторов стационарен во времени и не требует корректировки параметров процесса (рис. 8.3). С, Т, Р
Р
Рис. 8.3. Режим работы реактора непрерывного действия
В общем виде производительность реакторов рассчитывают по уравнению П = где т – масса продукта, полученного за время цикла работы реактора;
Т.к. в непрерывном процессе Реакторы классифицируют также по температурному режиму и степени перемешивания. По температуре процесса реакторы делят на высокотемпературные и низкотемпературные, по давлению – на реакторы, работающие при высоком, повышенном, нормальном и низком (под вакуумом) давлении. Реакторы также классифицируют по типу процесса на гомогенные и гетерогенные. По температурному режиму реакторы и проводимые в них процессы разделяют на адиабатические, изотермические и политермические.
Адиабатические реакторы при спокойном (без перемешивания) течении потока реагентов не имеют теплообмена с окружающей средой, т.е. имеют хорошую теплоизоляцию. При этом все тепло экзотермической реакции аккумулируется потоком реагирующих веществ. Температурный режим в любой точке по фронту реактора описывается уравнением T k = T н где T k, T н – конечная и начальная температуры системы; Qp / - тепловой эффект процесса при полном переходе основного компонента из одного состояния в другое; G – масса реакционной смеси; с – средняя теплоемкость смеси в интервале температур Т н – Т к; х – степень превращения. Если обозначить Q p/ / G Т к = Т н Знак «+» соответствует экзотермической реакции, знак «-» - эндотермической реакции.
Т Т
Тк Тк
xp xp Тн Тн x x а) б) Рис. 8.4. Изменение температурного режима по фронту адиабатического реактора: а) - экзотермическая реакция; б) - эндотермическая реакция На этих графиках значение По времени контакта Изотермические реакторы имеют постоянную температуру во всех точках реакционного объема, т.е. Тк = Тср во времени и пространстве в соответствии с графиком 1 на рис. 8.6. Изотермический режим более выгоден для производства и облегчает автоматизацию технологического процесса в реакторе по сравнению с адиабатическим. Изотермический режим может быть достигнут в реакторах с мешалкой или в кипящем (псевдоожиженном) слое. В таких реакторах гидродинамический режим обеспечивает приближение к полному перемешиванию с продуктами реакции и инертными компонентами. При этом температура в экзотермических реакторах повышается, а в эндотермических понижается до конечной сразу после поступления исходных веществ в реакционное пространство. Можно приблизиться к изотермическому режиму путем подвода тепла для компенсации эндотермического эффекта или отвода тепла в экзотермическом процессе.
Х,Т Т Хр 1
Тн 2
0 Н(L) 0 H,
Политермические реакторы характеризуются частичной компенсацией тепла реакции путем отвода (подвода) теплоты. К политермическим относят реакторы с малой степенью смешения реагирующих веществ и теплообменниками, помещенными внутрь реакционного объема, например, трубчатые контактные аппараты. Температура по высоте (длине) реактора изменяется по характерной кривой (см. рис. 8.6). По гидродинамическому движению реакционной массы (по степени перемешивания реагентов) различают два предельных типа реакторов непрерывного действия (проточных): идеального вытеснения и полного (идеального) смешения. Реактор идеального вытеснения (РИВ) характеризуется ламинарным потоком движения реакционной массы по всему фронту реактора. В таких реакторах основные показатели процесса изменяются по длине (высоте) реактора (рис. 8.7 а). На рис. 8.8 представлен характер изменения движущей силы процесса в реакторах идеального вытеснения и идеального смешения. Из него следует, что наибольшая величина движущей силы достигается в реакторах идеального вытеснения, а наименьшая – в реакторах идеального смешения.
Сн Сн Ск Ск L (v) L (v)
Хк Хк
Х0 L (v) Х0 L (v)
Uн U0
L (v) L (v)
а) б) Рис. 8.7. Изменение характеристик в реакторах идеального вытеснения (а)
Тs Тs Тк Тн Тк
Тн
Рис. 8.8. Изменение движущей силы процесса в реакторах РИВ и РИС: Тs - предельная температура, достигаемая в процессе; Тн - начальная температура в процессе; Тк - конечная температура в реакторе;
Типичный пример конструкции реактора идеального вытеснения с политермическим режимом для эндотермических процессов приведен на рис. 8.9. Примером применения такого типа реактора является производство синтез-газа конверсией метана с водяным паром: СН4 + Н2О = СО + 3Н2 – 206 Принцип действия реактора идеального вытеснения шахтного типа показан на рис. 8.10. Он представляет собой емкость (шахту), в которой на решетке помещен твердый зернистый материал. Высота слоя зернистого материала обычно больше диаметра реактора. Через слой материала проходит газ, который вступает во взаимодействие с твердым материалом. Концентрация реагирующих веществ в таком реакторе понижается по высоте слоя по логарифмической зависимости. По такому принципу работают многие каталитические реакторы, например, в процессе обжига железного колчедана или в процессе парокислородной конверсии метана по реакциям:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2 + 3420 2CH4 + O2 = 2CO + 4H2 + 35 В экзотермических процессах температурный режим реактора близок к адиабатическому. Похожим образом работают насадочные колонны абсорбции газов жидкостями и десорбции газов из жидкостей. Конверсия протекает на катализаторе, помещенном в трубках, а в межтрубном пространстве сжигается топливный газ для компенсации эндотермического эффекта реакции. Реактор полного смешения характеризуется тем, что любой элементарный объем газа или жидкости, поступивший в реактор, мгновенно смешивается со всем содержимым реактора, т.к. турбулентности потока скорость циркуляционных движений по высоте и сечению реактора во много раз больше, чем скорость линейного движения по оси реактора. Концентрация всех веществ и степень превращения во всем объеме такого реактора одинакова и равна конечной. На рисунке 8.11. дана конструкция каталитического реактора кипящего слоя с мешалкой.
Топочные газы
Отходящие газы
Газ (продукт)
Газ (продукт)
Достаточное приближение к полному смешению достигается в реакторах с перемешивающими устройствами в жидкой фазе, а также в суспензиях твердых веществ в жидкостях. Такого типа реакторы широко применяются в нефтехимической, химической, пищевой промышленности, а также в производстве цветных металлов, строительных материалов и т. д.
Контрольные вопросы 1. Дайте определение понятию “химический реактор”. Приведите основные требования 2. Приведите классификацию химических реакторов. Какие принципы положены в основу классификации химических реакторов? 3. Сравните графики изменений во времени основных параметров химических процессов для реакторов периодического и непрерывного действия.
4. Назовите особенности адиабатических реакторов. Изобразите графики температурных режимов адиабатических реакторов для эндотермических и экзотермических процессов. 5. Приведите особенности изотермических и политермических реакторов. 6. Сравните графики изменений по фронту реактора основных характеристик для реакторов типа РИС и РИВ. 7. Как изменяется движущая сила процесса в реакторах типа РИС и РИВ? Приведите примеры процессов в реакторах типа РИС и РИВ.
ТЕМА 9 ПРОИЗВОДСТВО СЕРНОЙ КИСЛОТЫ Этот процесс – один из самых многотоннажных среди неорганических производств и занимает одно из ведущих мест в химической технологии. В настоящее время в мире имеется более 1,5 тыс. установок по производству серной кислоты. Они производят свыше 160 млн. т серной кислоты в год. Общий объем ее выпуска превышает производство соляной, азотной, уксусной и других кислот вместе взятых. Серная кислота находит применение в производстве минеральных удобрений (около 50 %), взрывчатых веществ, минеральных солей и кислот, для очистки нефтепродуктов, и их синтезе (например, алкилирование изобутана), при обработке металлов, производстве продуктов органического синтеза, лекарственных препаратов и т.д. Многообразие областей применения серной кислоты представлено на нижеприведенной диаграмме (рис. 9.1).
Производство хроматов Производство сульфатов Минеральные Сульфат удобрения аммония
Взрывчатые вещества Травление металлов
Производство спиртов, Цветная эфиров, кислот и др. СЕРНАЯ КИСЛОТА металлургия органических веществ
Производство красителей Минеральные кислоты
Производство глюкозы Химические Очистка Катализатор В сернокис- и патоки волокна, нефте- алкилирования лотных текстиль продуктов и др. процессов аккумуляторах Рис. 9.1. Области применения серной кислоты
Динамика производства серной кислоты во второй половине 20 в. в СССР, а затем в России приведена в табл. 9.1.
Таблица 9.1 Динамика производства серной кислоты в СССР и России
Наибольшее количество серной килоты производится в США – 30 млн. т. Другими круп-ными ее производителями являются Германия и Япония. Феномен высокого объема производства серной кислоты обусловлен комплексом ее физико-химических свойств. Она – самая дешевая из всех сильных кислот, не дымит и не имеет запаха, удобна в транспортировке, т. к. в концентрированном виде не разрушает черные металлы. В технике под серной кислотой подразумевают любые смеси SO3 c H2O (mSO3 Разделение серной кислоты по сортам во многом связано с ее концентрацией и в значительной мере определяется температурой замерзания растворов ее с водой. Диаграмма кристаллизации системы SO3–H2O представлена на рис. 9.2.
0 20 40 60 80 100 20 40 60 80 100 % Н2SО4 % SO3 (своб.) Концентрация, % масс.
Рис. 9.2. Диаграмма кристаллизации системы Н2О – SO3
Из диаграммы следует, что в пределах концентраций от 0 до 64, 35 % SO 3 образуется 6 химических соединений-гидратов SO 3, которые растворимы друг в друге в жидком состоянии, а при кристаллизации образуют эвтектические смеси. В области концентраций от 64,5 % до 100 % SO 3 при замерзании образуются твердые растворы. Для того, чтобы кислота не замерзала в зимнее время, все товарные сорта ее имеют концентрации, близкие к эвтектическим составам. Ниже приведена еще одна диаграмма – кипения системы Н 2 О – SО 3 при атмосферном давлении (рис. 9.3). Кислота, содержащая 98,3 % Н 2 SO 4, является азеотропом и кипит при температуре 336,6 о С. Эту диаграмму применяют при концентрировании кислоты выпариванием воды. Из диаграммы следует, что при нагревании кислоты, содержащей менее 90 % Н 2 SО 4 в пар переходит почти исключительно вода. При концентрации выше 93 % Н 2 SО 4 состав паров быстро приближается к составу жидкой фазы. Поэтому практически серную кислоту концентрируют упариванием только до купоросного масла, т. е. до 92 % Н 2 SО 4. При повышении температуры пары Н 2 SО 4 диссоциируют на SО 3 и Н 2 О, а затем SО 3 распадается на SО2 и О2. При 700 о С в парах преобладает SО2, а выше 900 оС SО3 диссоциирует полностью.
Н2SО4 SO3 (cвоб.) Концентрация, % масс.
Рис. 9.3. Диаграмма кипения системы Н2О–SО3 при атмосферном давлении
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 1381; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.14.63 (0.074 с.) |
 С, Т, Р
С, Т, Р
 С0
С0
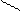
 С
С
 С
С 

 соответственно; Т, Р – температура и давление в реакторе
соответственно; Т, Р – температура и давление в реакторе
 С0 С
С0 С  Т
Т
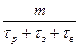 ,
,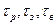 - время химического процесса, загрузки компонентов и выгрузки продуктов, соответственно.
- время химического процесса, загрузки компонентов и выгрузки продуктов, соответственно. , то, поэтому, производительность реакторов непрерывного действия выше, чем реакторов периодического действия при прочих равных условиях.
, то, поэтому, производительность реакторов непрерывного действия выше, чем реакторов периодического действия при прочих равных условиях.
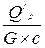 х, (8.4)
х, (8.4) c =
c =  , то вышеприведенное уравнение является линейным и его можно записать следующим образом
, то вышеприведенное уравнение является линейным и его можно записать следующим образом (8.5)
(8.5)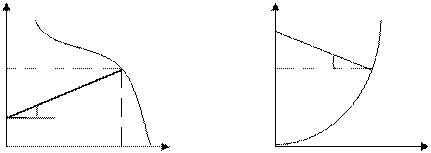
 tg
tg 



 С С
С С
 Х Х
Х Х U U
U U






 Uk Uk
Uk Uk Т Т
Т Т Тср
Тср  .
. Газ (исходн.) Исходный газ
Газ (исходн.) Исходный газ







 пар
пар



























