
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослiд 3. Вплив каталiзатору на швидкiсть хiмiчної реакцiї.
В якостi каталiзатору розкладу тiосiрчаної кислоти використовується 0,5 н розчин мiдного купоросу. З ранiше пророблених дослiдiв уже вiдомий час, необхiдний для розкладу тiосiрчаної кислоти при кiмнатнiй температурi. Проведiть аналогiчнi дослiди, коли до 3 мл розчину тiосульфату натрiю доливається 3 мл розчину сірчаної кислоти, але пiсля вiдмiрювання 3 мл кислоти в неї добавляють необхiдну кiлькiсть крапель розчину мiдного купоросу. Вiдмiчайте час, який проходить вiд моменту зливання розчинiв до зникнення забарвленої смужки паперу. Проведiть три дослiди: з 1, 2 i 3 краплями мiдного купоросу. Результати вимiрювань занесiть в таблицю. Таблиця 3. Залежнiсть швидкостi реакції вiд каталiзатору
Зробіть висновки про залежнiсть швидкостi хімічної реакції вiд концентрації каталізатору – іону Cu2+.
Дослiд 4. Вплив величини поверхнi реагентiв на швидкiсть хімічної реакції. В конiчнi пробiрки помiстiть рiвнi по масi (0,2–0,3 г): в одну – порошок, в другу – шматочок крейди. В кожну долийте 10–15 крапель соляної кислоти i з допомогою секундомiра визначте час проходження реакцiї в першiй i в другiй пробiрках. Зробiть висновки з спостереження.
Дослiд 5. Змiщення хімічної рiвноваги при змiнi концентрації реагуючих речовин. В пробiрцi приготуйте сумiш дуже розбавлених розчинiв з 4 крапель FeCl3 i 4 крапель NH4CNS. При цьому утворюється Fe(CNS)3 згiдно рiвняння FeCl3+3NH4CNS = Fe(CNS)3+3NH4Cl i розчин з майже безбарвного стає червоним. Утворений розчин перемiшайте скляною паличкою, а потiм 4 краплi цього розчину помiстiть на крапельну пластинку на вiдстанi 7-10 мм одна вiд другої. Поряд з краплями помiстiть краплi концентрованих розчинiв: бiля першої – FeCl3, бiля другої – NH4CNS, бiля третьої – краплю вихiдного розчину, бiля четвертої – насиченого розчину NH4Cl. Потiм скляною паличкою змiшайте поруч розташованi краплi (кожного разу змичайте дистильованою водою i протирайте фiльтрувальним папером скляну паличку). Вiдмiтьте змiни в iнтенсивностi забарвлення. Дайте їм пояснення, використовуючи вираз константи хімічної рiвноваги i принцип Ле-Шательє: k = РОЗЧИНИ
Програмні вимоги до теми: Поняття про розчини. Класифікація розчинів по агрегатному стану. Класифікація розчинів по подрібненості розчиненої речовини. Місце розчинів серед складних речовин. Розчинник. Гідрати, сольвати, кристалогідрати. Теплота розчинення. Розчинність речовин. Коефіцієнт розчинності. Залежність розчинності газоподібних речовин від температури і від тиску. Розчини насичені, ненасичені, пересичені. Концентрація розчинів. Способи вираження концентрації розчинів: а) масова частка; б) об’ємна частка; в) молярна частка; г) молярна концентрація; д) нормальна концентрація; ж) моляльна концентрація. Титр розчину. Густина розчину і її зв’язок з масою та об’ємом розчину. Перехід від одного способу вираження концентрації до іншого. Пониження тиску пари розчинника над розчином. Закони Рауля. Пониження температури замерзання розчину. Кріоскопічна константа. Підвищення температури кипіння розчину. Ебуліоскопічна константа. Явище осмосу. Осмотичний тиск. Методи визначення молекулярних мас розчинених речовин. Класифікація речовин на електроліти і неелектроліти. Поняття про електролітичну дисоціацію. Фактори, що впливають на електролітичну дисоціацію. Теорія електролітичної дисоціації С.Ареніуса. Приклади рівнянь електролітичної дисоціації різних електролітів. Ступінчата дисоціація. Властивості основ, кислот та солей з точки зору електролітичної дисоціації. Іонні рівняння реакцій. Ступінь електролітичної дисоціації. Уявний ступінь дисоціації. Константа електролітичної дисоціації. Закон розбавлення Оствальда. Іонний добуток води. Визначення іонного добутку води. рН розчинів. Кисле, лужне і нейтральне середовище. Буферні розчини. Добуток розчинності. Гідроліз. Склад солей та гідроліз солей. Ступінь гідролізу. Фактори, що впливають на ступінь гідролізу. Поняття про колоїдні розчини. Короткий виклад теоретичних питань:
Система, в якій одна речовина у вигляді дуже дрібних часточок розподілена в об’ємі іншої, називається дисперсною. При цьому розрізняють два поняття: дисперсна фаза та дисперсійне середовище. Дисперсна фаза – це диспергована речовина, тобто та частина дисперсної системи, яка рівномірно розподілена в об’ємі іншої. Середовище, в якому рівномірно розподілена дисперсна фаза, називається дисперсійним середовищем. Наприклад, розчин цукру воді – це дисперсна система, в якій цукор є дисперсною фазою, а вода – дисперсійним середовищем.
За ступінню дисперсності, тобто залежно від розмірів часточок дисперсної фази дисперсні системи поділяються на грубодисперсні (мікрогетерогенні, в яких частинки мають розмір більший, ніж 1 мкм (1 мкм = 1·10–4 см) і тонкодисперсні (ультрамікрогетерогенні), в яких величина часток дисперсної фази 0,1–1 мкм. До грубодисперсних систем належать суспензії і емульсії. Суспензія – це система, в якій дисперсною фазою є тверда речовина, а дисперсійним середовищем – рідина. Наприклад, суспензією буде система, що утворюється при збовтуванні глини, крейди у воді. Емульсія – це дисперсна система, що складається з двох практично взаємно нерозчинних фаз, в яких і дисперсна фаза, і дисперсне середовище – це рідини. Прикладом емульсії є молоко, в якому дисперсною фазою є краплини жиру. Тонкодисперсні (ультрамікрогетерогенні) системи називаються колоїдними розчинами.
В разі, коли речовина (дисперсна фаза) диспергована до розмірів молекул або іонів (менше 0,01 мкм), утворюється гомогенна система – істинний розчин або просто розчин. У розчинах між диспергованою речовиною і дисперсійним середовищем (розчинником) немає поверхні розділу, тому розчин є гомогенною системою. Отже, розчин – гомогенна термодинамічна система змінного складу, яка складається із двох і більше компонентів. Залежно від агрегатного стану розчиненої речовини і розчинника (дисперсійного середовища) розчини бувають газоподібні, тверді і рідкі. Газоподібний розчин уявляє собою суміш газів. Гомогенні тверді розчини можуть утворювати солі, метали, оксиди. Відомі тверді розчини двох типів: заміщення і вкорінення. Тверді розчини заміщення утворюються при кристалізації двох розплавів, якщо компоненти мають однотипну кристалічну решітку, а частинки компонентів – близькі розміри. Наприклад, KCl i KBr, Ag i Au, Si i Ge, K2SO4 i K2SeO4. Тверді розчини вкорінення утворюються шляхом вкорінення атомів, іонів або молекул однієї речовини у пустоти кристалічної решітки іншої речовини. Рідкі розчини утворюються при розчиненні газоподібних, рідких або твердих речовин у рідкому дисперсійному середовищі. Найчастіше розчинником є рідина, зокрема вода. Незалежно від розчиненої речовини, розчинником вважають той компонент розчину, який має такий агрегатний стан, як і одержаний розчин. Якщо мова йде про розчинення газу у газі, рідини у рідині або про тверді розчини, то розчинником прийнято вважати той компонент, якого більше.
Фізична теорія розчинів, основоположником якої були Я.Вант-Гофф і С.Ареніус, розглядає процес розчинення як простий розподіл (диспергування) однієї речовини у всьому об’ємі іншої, а, отже, властивості розчинів мають залежати лише від концентрації речовини. Згідно з фізичною теорією розчинник – це індиферентне середовище, в якому хаотично розподілені частинки розчиненої речовини. Згідно з хімічною теорією розчинів Д.І.Менделєєва між компонентами розчину відбувається хімічна взаємодія. У своїх працях Д.І.Менделєєв показав, що в розчині є сполуки, які утворюються при взаємодії молекул розчиненої речовини і розчинника. Такі сполуки навиваються сольватами (гідратами), а процес їх утворення – сольватацією (гідратацією). Термін “гідрати”, “гідратація”, використовують, коли розчинником є вода. Утворення сольватів (гідратів) підтверджується виділенням сполук у вигляді кристалосольватів (кристалогідратів). Наприклад: CuSO4·5H2O, Na2CO3·10H2O. На утворення сольватів (гідратів) вказують також зміна забарвлення розчину, наприклад при розчиненні білого CuSO4 утворюється синій розчин, голубого CoCl2 – рожевий.
Внаслідок процесу сольватації (гідратації) розчинення речовин супроводиться тепловим ефектом. Кількість теплоти, яка виділяється при розчиненні 1 моля речовини, називають теплотою розчинення. Тепловий ефект розчинення (екзо- чи ендотермічний) залежить від двох величин: енергії кристалічної решітки речовини і енергії взаємодії молекул розчиненої речовини з молекулами розчинника (енергія сольватації). В процесі розчинення молекули розчинника спочатку руйнують кристалічну решітку розчинюваної речовини (при цьому затрачується енергія, рівна по величині енергії кристалічної решітки, але протилежна за знаком), а потім проходить сольватація іонів (при цьому енергія виділяється). Позначимо енергію кристалічної решітки Н 1, а енергію сольватації Н 2. Тоді теплота розчинення DH0 = H 2– H 1, при цьому якщо H 2 > H 1, то розчинення супроводжується виділенням тепла, і, навпаки, у випадку коли H 2 < H 1, розчинення проходить з поглинанням тепла. Сучасна теорія розчинення є поєднанням фізичної і хімічної теорій розчинів, її основи були закладені І.О.Каблуковим і В.О.Кістяківським.
Властивість речовин розчинятися у деякому розчиннику називається розчинністю. Кількісно розчинність визначається вмістом речовини у насиченому розчині при певних умовах. Найчастіше розчинність визначають кількістю грамів речовини, розчиненої в 100 г розчинника. Насичені розчини характеризуються динамічною рівновагою (при сталій температурі) між кристалічною речовиною і речовиною у розчині: нерозчинена речовина Û розчинена речовина у розчині (Т = const). Отже, насичений розчин – це розчин, у якому досягнута межа розчинності при даних зовнішніх умовах (температура, тиск). Якщо розчин містить менше речовини, ніж потрібно для насичення, то такий розчин називають ненасиченим. Деякі речовини можуть утворювати пересичені розчини, тобто такі, які при певній температурі містять більше розчиненої речовини, ніж її потрібно для насичення.
Розчинність газів у рідині залежить від тиску і температури. Крім того, треба враховувати природу і газу і можливість утворення сполук при взаємодії газу з розчинником. Наприклад, за однакових умов (тиск, температура) розчинність аміаку (NH3) і азоту (N2) неоднакова. Аміак енергійно взаємодіє з водою (NH3+Н2О = NH4ОН), тоді як молекулярний азот (N2) з водою не взаємодіє, тому при кімнатній температурі в одному об’ємі води розчиняється близько 700 об’ємів аміаку і лише 0,02 об’єму азоту. Залежність розчинності газу від його тиску виражається законом Генрі-Дальтона: розчинність газу при сталій температурі в рідині прямо пропорційна його парціальному тиску: m = kp, де m – маса газу, що розчиняється в 1 л розчинника, p – тиск газу (або його парціальний тиск у випадку суміші газів), k – коефіцієнт, який залежить від природи компонентів розчину. Розчинність газів при сталому тиску зменшується з підвищенням температури у відповідності з рівнянням lg m = a –
Змішування двох рідин може відбуватися по-різному. Так, деякі рідини розчиняються одна в одній в будь-яких масових або об’ємних співвідношеннях, наприклад, етиловий спирт і вода, гліцерин і вода, бензол і гексан. Але найчастіше зустрічаються випадки обмеженої взаємної розчинності рідин при даній температурі. З підвищенням температури взаємна розчинність рідин збільшується. Температура, при якій обмежена розчинність переходить у необмежену, називається критичною температурою. Іноді необмежена взаємна розчинність настає не при підвищенні температури двофазної системи, а, навпаки, при її зниженні. Цікавим є випадок одночасного розчинення речовини (третього компоненту) в двох розчинниках, які перебувають у контакті, але не змішуються між собою. При сталій температурі незалежно від кількості внесеної речовини, відношення концентрації цієї речовини між двома розчинниками, що не змішується, є величиною сталою (закон розподілу ):
Розчинність твердих речовин у тому самому розчиннику зі зміною температури може змінюватися у широких межах. При підвищенні температури розчинність більшості твердих речовин збільшується. Проте для деяких речовин вона може зменшуватися або не змінюватися. На основі кривих розчинності (тобто графічного виразу залежності розчинності речовини від температури) можна робити висновок про доцільність їх очистки від домішок так званим методом перекристалізації. Цей метод використовують у випадку, коли розчинність солі різко зростає з підвищенням температури (наприклад, KNO3).
Найчастіше використовують наступні способи вираження вмісту розчиненої речовини в розчині:
1) Процентна концентрація: 2) В частках розчиненої речовини в розчині: масова частка w = 3) Молярна концентрація СМ = 4) Нормальна концентрація СN = 5) Моляльна концентрація (m) – кількість моль розчиненої речовини в 1 кг розчинника. 6) Титр (Т) визначається кількістю грамів розчиненої речовини в 1 мл розчину.
Внаслідок того, що в розведених розчинах відсутні сили взаємодії між молекулами розчиненої речовини, такі розчини наближено розглядають як “ідеальні” системи. Властивості розчинів, які залежать лише від їх концентрації, і не залежать від природи розчиненої речовини називаються колігативними.
Рис.7. Схема приладу для визначення осмотичного тиску |
Якщо розчин і розчинник розділити напівпроникною перегородкою (мембраною 1 на рис.7), через яку проходять молекули розчинника і не проходять молекули розчиненої речовини, то настає одностороння дифузія молекул розчинника через мембрану. Процес односторонньої дифузії молекул через напівпроникну перегородку називається осмосом, а тиск, який потрібно прикласти до перегородки, що припинити осмос, називається осмотичним тиском. Динамічна рівновага (стан, при якому кількість молекул розчинника, що проходять через мембрану в обох напрямках за одиницю часу стає однаковою), встановлюється лише тоді, коли осмотичний тиск розчину врівноважений висотою стовпа рідини у трубці (висота h на рис.7)
У 1886 році Вант-Гофф показав, що осмотичний тиск розчину чисельно дорівнює тиску, який чинила би розчинена речовина, якби вона при даній температурі перебувала в газоподібному стані і займала об’єм, що дорівнює об’єму розчину. Це і є закон осмотичного тиску: р осм. =  RT, де n – число моль розчиненої речовини; V – об’єм розчину; R – універсальна газова стала; T – температура. Оскільки молярна концентрація СМ =
RT, де n – число моль розчиненої речовини; V – об’єм розчину; R – універсальна газова стала; T – температура. Оскільки молярна концентрація СМ =  , то р осм. = СМRT, тобто осмотичний тиск розбавленого розчину прямо пропорційний його молярній концентрації і температурі. За рівнянням осмотичного тиску можна обчислити молекулярні маси М розчинених речовин. Оскільки CМ =
, то р осм. = СМRT, тобто осмотичний тиск розбавленого розчину прямо пропорційний його молярній концентрації і температурі. За рівнянням осмотичного тиску можна обчислити молекулярні маси М розчинених речовин. Оскільки CМ =  (m – маса розчиненої речовини в грамах, що міститься в 1 л розчину), то р осм. =
(m – маса розчиненої речовини в грамах, що міститься в 1 л розчину), то р осм. =  RT, звідки
RT, звідки  .
.
Розчини з однаковим осмотичним тиском називають ізотонічними.
| Тиск пари розчинів |
Розчинена речовина утруднює випаровування молекул розчинника внаслідок взаємодії молекул розчиненої речовини і розчинника, тому при сталій температурі тиск пари над розчином нелеткої речовини менший, ніж над розчинником. Отже, крива тиску пари над розчином буде лежати нижче від кривої тиску пари чистого розчинника (рис.8).
 Рис.8. Криві тиску пари чистої води і розчину
Рис.8. Криві тиску пари чистої води і розчину
|
Залежність зниження тиску пари розчинів від їхньої концентрації виражається першим законом Рауля (1887 р.): відносне пониження тиску насиченої пари над розчином прямо пропорційне мольній частці розчиненої речовини:  =
= 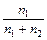 , де р 0 – тиск пари чистого розчинника; р – тиск пари розчину; n 1 – кількість моль розчиненої речовини, n 2 – кількість моль розчинника. Позначивши р 0– р = D р, одержуємо: D р = р 0
, де р 0 – тиск пари чистого розчинника; р – тиск пари розчину; n 1 – кількість моль розчиненої речовини, n 2 – кількість моль розчинника. Позначивши р 0– р = D р, одержуємо: D р = р 0 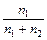 . Якщо у рівняння замість n 1 поставити величину
. Якщо у рівняння замість n 1 поставити величину 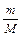 (m – маса розчиненої речовини в 1 л розчину, М – молярна маса розчиненої речовини), то для дуже розведених розчинів (n 1 набагато менше від n 2) маємо: D р = р 0 і М =
(m – маса розчиненої речовини в 1 л розчину, М – молярна маса розчиненої речовини), то для дуже розведених розчинів (n 1 набагато менше від n 2) маємо: D р = р 0 і М =  .
.
| Температура кипіння і температура замерзання розчинів |
Температура кипіння і температура замерзання розчинів залежить від тиску пари розчинів. Пониження тиску пари розчину спричиняє підвищення температури кипіння або пониження температури замерзання розчину порівняно з відповідними температурами для чистого розчинника. Рауль показав, що підвищення температури кипіння (D t кип.) або зниження температури замерзання (D t зам.) розчину прямо пропорційне моляльній концентрації розчиненої речовини (другий закон Рауля):D t кип = . E·m; D t зам. = K·m, де m – моляльна концентрація розчину (число моль розчиненої речовини в 1000 г розчинника; E і K – коефіцієнти пропорційності, які називаються ебуліоскопічною константою (Е) та кріоскопічною константою (К). При m = 1 D t кип = . E; D t зам. = K. Отже, ебуліоскопічна і кріоскопічна константи показують відповідно підвищення температури кипіння або пониження температури замерзання одномоляльного розчину порівняно з температурами кипіння і замерзання чистого розчинника. Якщо відомі експериментальні значення D t кип і D t зам., то на основі другого закону Рауля можна визначити молярну масу розчиненої речовини: так як m =  (g – маса розчиненої речовини в г; G – маса розчинника; M – молярна маса розчиненої речовини), то D t кип = . E
(g – маса розчиненої речовини в г; G – маса розчинника; M – молярна маса розчиненої речовини), то D t кип = . E  .
.
| Розчини електролітів |
Серед речовин розрізняють електроліти та неелектроліти. Електролітами називають речовини, розчини або розплави яких проводять електричний струм. Розчини і розплави неелектролітів електричний струм не проводять. Носіями електричного струму в розчинах (розплавах) електролітів є іони. Тому електролітами є речовини, молекули яких в розчині або розплаві дисоціюють (розпадаються) на іони. Якщо замість розчинів неелектролітів візьмемо розчини електролітів тієї ж концентрації, то для останніх спостерігаються істотні відхилення від законів Рауля та Вант-Гоффа. Експериментальні значення величин D р, р осм., D t кип, D t зам. для розчинів електролітів більші за теоретично обчислені за відповідними законами Рауля і Вант-Гоффа. Тому для оцінки міри відхилення розчинів електролітів від розбавлених розчинів неелектролітів Вант-Гофф запропонував ввести так званий поправочний, або ізотонічний коефіцієнт (і), який є відношенням відповідних експериментальних значень величин до теоретично обчислених: і =  =
=  =
=  =
= 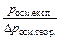 . Ізотонічний коефіцієнт і > 1. Відхилення властивостей розчинів електролітів від законів, що описують властивості розчинів неелектролітів, є наслідком дисоціації електролітів на їх складові частинки.
. Ізотонічний коефіцієнт і > 1. Відхилення властивостей розчинів електролітів від законів, що описують властивості розчинів неелектролітів, є наслідком дисоціації електролітів на їх складові частинки.
| Теорія електролітичної дисоціації |
Основні положення теорії електролітичної дисоціації, сформульовані Сванте Арреніусом, наступні:
1. Електроліти при розчиненні або в розплаві дисоціюють на іони.
2. При проходженні електричного струму через розчин або розплав електроліту спостерігається напрямлений рух іонів: позитивно заряджені іони (катіони) рухаються до катоду; негативно заряджені іони (аніони) рухаються до аноду.
3. Процес дисоціації є оборотнім.
Згідно з Каблуковим, іони з водою утворюють гідратовані іони. Сила взаємодії між протилежно зарядженими іонами в розчині послаблюється також і тому, що у розчинах з великими значеннями діелектричної проникності (e) енергія електростатичної взаємодії в e раз менша, ніж у вакуумі, де e =1: F =  , де F – сила взаємодії між іонами; z – заряд іона; N A– число Авогадро; e – діелектрична проникність середовища; r – віддаль між центрами іонів. У розчинниках, які мають велике значення e, наприклад, у воді (e=81), мурашиній кислоті (e=56), рідкому HCN (e=95,) електроліти дисоціюють значно краще, ніж у розчинниках з малим значенням (e).
, де F – сила взаємодії між іонами; z – заряд іона; N A– число Авогадро; e – діелектрична проникність середовища; r – віддаль між центрами іонів. У розчинниках, які мають велике значення e, наприклад, у воді (e=81), мурашиній кислоті (e=56), рідкому HCN (e=95,) електроліти дисоціюють значно краще, ніж у розчинниках з малим значенням (e).
| Ступінь електролітичної дисоціації |
Здатність електроліту дисоціювати на іони кількісно оцінюється за допомогою ступеня дисоціації a. a показує, яка частка від загального числа молекул розчиненої речовини розпалася на іони (продисоціювала): a =  , де С – молярна концентрація розчину (моль/л). a часто виражають і в процентах:
, де С – молярна концентрація розчину (моль/л). a часто виражають і в процентах:  ·100%. За величиною ступеня дисоціації розчинів усі електроліти поділяють на сильні і слабкі. До сильних електролітів належать речовини, які у розчині практично повністю дисоціюють на іони. Слабкі електроліти у розчинах дисоціюють частково. Характерною особливістю слабких електролітів є встановлення динамічної рівноваги між іонами і молекулами розчиненої речовини.
·100%. За величиною ступеня дисоціації розчинів усі електроліти поділяють на сильні і слабкі. До сильних електролітів належать речовини, які у розчині практично повністю дисоціюють на іони. Слабкі електроліти у розчинах дисоціюють частково. Характерною особливістю слабких електролітів є встановлення динамічної рівноваги між іонами і молекулами розчиненої речовини.
| Ізотонічний коефіцієнт |
Ступінь електролітичної дисоціації визначають експериментально за величиною ізотонічного коефіцієнту або шляхом вимірювання електропровідності розчинів різної концентрації. Позначимо: С – загальна концентрація електроліту (моль/л), a – ступінь електролітичної дисоціації, n – число іонів, на які дисоціює одна молекула. Тоді C a – число молекул, що продисоціювали; C a n – число іонів, які при цьому утворилися, тоді число молекул, які не продисоціювали, складатиме С – C a = C (1–a). Ізотонічний коефіцієнт і є відношенням числа реально існуючих в розчині часток (число непродисоційованих молекул + число іонів) до числа часток розчиненої речовини: і = 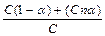 ; звідки iC = C (1–a)+ C a n; i = 1–a+a n; i = 1+a(1+ n); i –1 = a(n –1); a =
; звідки iC = C (1–a)+ C a n; i = 1–a+a n; i = 1+a(1+ n); i –1 = a(n –1); a =  .
.
і визначають за експериментальними і розрахованими значеннями D р, р осм., D t кип, D t зам,.а також за величиною електропровідності розчину: a =  (l – еквівалентна електропровідність розчину; l∞ – еквівалентна електропровідність того самого електроліту при безмежному розбавленні). Еквівалентна електропровідність – це електропровідність стовпчика розчину, що містить 1 еквівалент електроліту, і який знаходиться між електродами, відстань між якими дорівнює 1 см. Еквівалентну електропровідність визначають за питомою електропровідністю c, тобто електропровідністю 1 см3 розчину: l = c V, де V – розбавлення розчину або об’єм (см3), в якому міститься 1 екв. електроліту. Оскільки V =
(l – еквівалентна електропровідність розчину; l∞ – еквівалентна електропровідність того самого електроліту при безмежному розбавленні). Еквівалентна електропровідність – це електропровідність стовпчика розчину, що містить 1 еквівалент електроліту, і який знаходиться між електродами, відстань між якими дорівнює 1 см. Еквівалентну електропровідність визначають за питомою електропровідністю c, тобто електропровідністю 1 см3 розчину: l = c V, де V – розбавлення розчину або об’єм (см3), в якому міститься 1 екв. електроліту. Оскільки V =  (С – нормальність розчину), то l =
(С – нормальність розчину), то l =  .
.
| Константа електролітичної дисоціації |
Оскільки електролітична дисоціація слабких електролітів є оборотнім процесом, то вона підлягає закону діючих мас. Тому для процесу дисоціації слабких електролітів можна записати константу рівноваги. Наприклад, якщо дисоціація речовини КА відбувається згідно рівняння КА Û К++А–, то константа рівноваги К =  , де [К+], [А–] – концентрації відповідних іонів у розчині, [КА] – концентрація в розчині молекул, що не продисоціювали.
, де [К+], [А–] – концентрації відповідних іонів у розчині, [КА] – концентрація в розчині молекул, що не продисоціювали.
Константа рівноваги слабкого електроліту К називається константою дисоціації К дис.. Чим менше значення К дис.., тим слабкішим є електроліт. К дис. залежить від температури і не залежить від концентрації розчину. З рівноваги дисоціації слабкого електроліту КА Û К++А– випливає, що збільшення концентрації в розчині одного з іонів, К+ чи А–, шляхом введення у розчин електроліту, що містить однойменний іон, змістить рівновагу вліво, тобто послабить дисоціацію. Наприклад, якщо в розчин СН3СООН додати СН3СООNa, то концентрація молекул СН3СООН у розчині внаслідок зміщення рівноваги збільшиться, а це означає послаблення дисоціації СН3СООН. Розбавлення розчину слабкого електроліту сприяє його дисоціації.
Слабкі електроліти, що складаються з більше, ніж двох іонів, дисоціюють ступінчасто. Кожен ступінь характеризується певним значенням константи дисоціації: К 1, К 2,..., К n. Наприклад:
Н3РО4 Û Н++Н2РО4–; К 1 =  = 7,6·10–3;
= 7,6·10–3;
Н2РО4– Û Н++НРО42–; К 2 =  = 6,2·10–8;
= 6,2·10–8;
НРО42– Û Н++РО43–; К 3 =  = 4,2·10–13;
= 4,2·10–13;
Ступінчасто дисоціюють також багатокислотні основи, наприклад:
Pb(OH)2 Û PbOH++OH– К 1 = 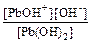 = 9,55·10–4.
= 9,55·10–4.
PbOH+ Û Pb2++OH– К 2 =  = 3·10–8.
= 3·10–8.
Для вираження константи електролітичної дисоціації часто користуються її десятковим логарифмом, взятим з протилежним знаком: –lg К дис. = p К дис..
| Закон розведення |
Між константою і ступенем електролітичної дисоціації існує зв’язок, відомий під назвою закону розведення Оствальда. Запишемо рівняння дисоціації слабкого електроліту: КА Û К++А–. Нехай його концентрація – С (моль/л), ступінь дисоціації a; тоді число продисоційованих молекул рівне С a, а число кожного з іонів [К+] = [А–] =a. Число недисоційованих молекул рівне С – С a = С (1–a) і К дис. =  =
=  =
=  . Якщо електроліт слабкий, то a
. Якщо електроліт слабкий, то a  1, тоді К дис.. = С a2, звідси a =
1, тоді К дис.. = С a2, звідси a =  . З рівняння випливає висновок, що із зменшенням концентрації електроліту ступінь його дисоціації збільшується.
. З рівняння випливає висновок, що із зменшенням концентрації електроліту ступінь його дисоціації збільшується.
| Властивості розчинів сильних електролітів |
Розчини сильних електролітів не підлягають закону розведення, що свідчить про необоротність процесу дисоціації електролітів. Твердження, що сильні електроліти повністю дисоціюють на іони, тобто a = 1, є основним положенням теорії розчинів сильних електролітів. Однак, експериментально встановлено, що для концентрованих розчинів електролітів значення a < 1. Тому експериментальні значення a сильних електролітів називають уявними.
Відхилення значення a сильних електролітів від 1 в бік менших значень пояснюють електростатичною міжіонною взаємодією в розчині. Навколо кожного іона (його називають “центральним”) утворюється “іонна атмосфера”, яка є результатом електростатичної взаємодії центрального іона з іонами протилежного знаку. Утворення іонної атмосфери є однією з причин зменшення рухливості іонів в електричному полі. Явище гальмування центрального іонна такою атмосферою називається релаксацією. Релаксація впливає на величину електропровідності розчину, а, отже, і на величину ступеня електролітичної дисоціації, який формально стає меншим за 1.
Для кількісної оцінки властивостей розчинів сильних електролітів треба враховувати не тільки електростатичну взаємодію між іонами, але й можливість утворення асоціатів. Оскільки ефективна концентрація іонів внаслідок утворення асоціатів не відповідає їх реальній концентрації, а є меншою, то для характеристики властивостей стану іонів у розчині користуються величиною, яка називається активністю а: а = g С, де С – концентрація (моль/л); g – коефіцієнт активності: коли С = 10–3–10–4 моль/л, то С @ a, g = 1. Коефіцієнти активності залежать не тільки від концентрації розчину, але і від природи електроліту, температури та іонної сили розчину. Іонна сила розчину m є півсумою добутку концентрацій всіх іонів у розчині на квадрат їхнього заряду: m =  (С 1 z 12+ С 2 z 22+...+ С n z n2).
(С 1 z 12+ С 2 z 22+...+ С n z n2).
Прямих методів визначення коефіцієнтів активності іонів немає. Для водних розчинів електролітів при С ≤ 0,01 моль/л коефіцієнт активності іонів обчислюють за формулою lgg± = –0,5zKzA 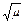 , де g± – коефіцієнт активності катіона або аніона; zK і zA – заряди катіона і аніона; m – іонна сила розчину.
, де g± – коефіцієнт активності катіона або аніона; zK і zA – заряди катіона і аніона; m – іонна сила розчину.
| Добуток розчинності |
Якщо кристали малорозчинного електроліту побудовані з іонів, то в розчин переходять іони, причому між іонами і твердою кристалічною фазою встановлюється динамічна рівновага, наприклад,  . Для такої рівноваги К дис. =
. Для такої рівноваги К дис. = 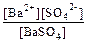 , де [Ba2+], [SO42–] – концентрації іонів в розчині; [BaSO4] – концентрація твердої фази, яку можна прийняти за сталу величину, оскільки BaSO4 малорозчинний у воді. Тоді К дис.·[BaSO4] = [Ba2+]·[SO42–]. З рівняння випливає, що у насиченому розчині при певній температурі добуток концентрації іонів малорозчинного електроліту є сталою величиною. Його називають добутком розчинності (ДР). ДРBaSO4 = [Ba2+]·[SO42–] = 1·10–10. Введення однойменних іонів в розчин малорозчинного електроліту знижує його розчинність.
, де [Ba2+], [SO42–] – концентрації іонів в розчині; [BaSO4] – концентрація твердої фази, яку можна прийняти за сталу величину, оскільки BaSO4 малорозчинний у воді. Тоді К дис.·[BaSO4] = [Ba2+]·[SO42–]. З рівняння випливає, що у насиченому розчині при певній температурі добуток концентрації іонів малорозчинного електроліту є сталою величиною. Його називають добутком розчинності (ДР). ДРBaSO4 = [Ba2+]·[SO42–] = 1·10–10. Введення однойменних іонів в розчин малорозчинного електроліту знижує його розчинність.
| Іонний добуток води |
Чиста вода є слабким електролітом: при 22 оС ступінь її дисоціації складає 1,8·10–9. Рівняння дисоціації води: Н2О Û Н++ОН– і К дис. =  , тоді К дис·[Н2O] = [H+]·[OH–]. Практично [Н2O] = const, звідси К дис·[Н2O] = [H+]·[OH–] = K
, тоді К дис·[Н2O] = [H+]·[OH–]. Практично [Н2O] = const, звідси К дис·[Н2O] = [H+]·[OH–] = K  . K
. K  називається іонним добутком води:
називається іонним добутком води:
В 1 л Н2О, що має масу 1 кг (1000 г), число моль Н2О складає  = 55,56 моль/л. К дис(Н2O) = 1,8·10–9, тоді [H+] = [OH–] = 55,56·1,8·10–9 = 10–7, а [H+]·[OH–] = 10–14. При даній температурі K
= 55,56 моль/л. К дис(Н2O) = 1,8·10–9, тоді [H+] = [OH–] = 55,56·1,8·10–9 = 10–7, а [H+]·[OH–] = 10–14. При даній температурі K  є сталою величиною. При 22 оС нейтральні розчини мають однакову концентрацію [H+] = [OH–] = 10–7 моль/л і K
є сталою величиною. При 22 оС нейтральні розчини мають однакову концентрацію [H+] = [OH–] = 10–7 моль/л і K  = 10–14. Це дає змогу обчислювати концентрацію [H+] або [OH–]: [H+] =
= 10–14. Це дає змогу обчислювати концентрацію [H+] або [OH–]: [H+] =  і [OH–] =
і [OH–] =  .
.
| Водневий показник |
У 1909 р. С.Саренсен запропонував характеризувати середовище розчину величиною водневого показника рН: рН = –lg[H+]. Тоді для нейтрального середовища рН = 7, для кислого рН < 7, для лужного pH > 7. Розчини, рН яких < 3 відносять до сильнокислих; якщо 4 < рН < 6, то середовище слабокисле, 8 < рН < 10 – слаболужне, 11 < рН < 14 – сильнолужне.

 , де Т – температура, a i b – сталі величини.
, де Т – температура, a i b – сталі величини. = К розподілу, де С 1 і С 2 – концентрація речовини в першому і другому розчинниках, що не змішуються; К розподілу – коефіцієнт розподілу. Закон розподілу лежить в основі концентрування і очищення речовин методом екстракції.
= К розподілу, де С 1 і С 2 – концентрація речовини в першому і другому розчинниках, що не змішуються; К розподілу – коефіцієнт розподілу. Закон розподілу лежить в основі концентрування і очищення речовин методом екстракції. ·100%. Показує число г речовини в 100 г розчину.
·100%. Показує число г речовини в 100 г розчину. ; мольна частка N =
; мольна частка N =  (моль/л). Показує число моль розчиненої речовини в 1 л розчину. Часто для позначення молярної концентрації розчину використовують літеру М. Наприклад, 0,1 М розчин H2SO4 означає, що в 1 л розчину є 0,1 моль H2SO4, що відповідає 9,8 г H2SO4.
(моль/л). Показує число моль розчиненої речовини в 1 л розчину. Часто для позначення молярної концентрації розчину використовують літеру М. Наприклад, 0,1 М розчин H2SO4 означає, що в 1 л розчину є 0,1 моль H2SO4, що відповідає 9,8 г H2SO4.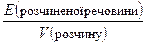 (екв/л). Показує число еквівалентів розчиненої речовини в 1 л розчину. Часто для позначення нормальної концентрації розчину використовують літеру н. Наприклад, 0,1 н розчин H2SO4 означає, що в 1 л розчину міститься 0,1 еквівалента H2SO4, що відповідає 4,9 г H2SO4. Розчинені речовини взаємодіють між собою в об’ємних співвідношеннях, обернено пропорційних їх нормальній концентрації:
(екв/л). Показує число еквівалентів розчиненої речовини в 1 л розчину. Часто для позначення нормальної концентрації розчину використовують літеру н. Наприклад, 0,1 н розчин H2SO4 означає, що в 1 л розчину міститься 0,1 еквівалента H2SO4, що відповідає 4,9 г H2SO4. Розчинені речовини взаємодіють між собою в об’ємних співвідношеннях, обернено пропорційних їх нормальній концентрації:  або V 1 СN 1= V 2 СN 2 (наслідок із закону еквівалентів, згідно з яким речовини взаємодіють між собою в кількостях, пропорційних їх еквівалентам). Особливістю еквінормальних розчинів є те, що їх рівні об’єми взаємодіють без залишку.
або V 1 СN 1= V 2 СN 2 (наслідок із закону еквівалентів, згідно з яким речовини взаємодіють між собою в кількостях, пропорційних їх еквівалентам). Особливістю еквінормальних розчинів є те, що їх рівні об’єми взаємодіють без залишку.




