
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Стехіометричні закони та основні хімічні поняттяСтр 1 из 8Следующая ⇒
Програмні вимоги до теми: Поняття матерії. Форми існування матерії. Визначення речовини і поля. Закон збереження матерії. Закон збереження енергії. Рівняння, що виражає взаємозв’язок маси і енергії. Поняття про атом і молекулу. Визначення поняття “хімічний елемент.” Основні положення атомно-молекулярного вчення. Класифікація речовин: прості, складні. Класифікація хімічних сполук. Відмінність понять “проста речовина” і “елемент”. Відносна атомна і молекулярна маса. Хімічна формула речовини. Види хімічних формул. Емпірична і молекулярна формула речовини. Розрахунки за хімічними формулами: визначення масової частки елементу в речовині і встановлення найпростішої формули речовини за масовими частками елементів. Хімічні та фізичні явища. Хімічні реакції. Ознаки хімічних реакцій. Хімічні рівняння реакцій. Розрахунки за хімічними рівняннями реакцій. Кількість речовини. Моль. Молярна маса. Зв’язок між кількістю речовини і її масою. Закон кратних відношень. Закон сталості складу. Дальтоніди і бертоліди. Закон збереження маси. Закон об’ємних відношень газів. Число Авогадро. Молярний об’єм. Закон Авогадро. Наслідки з закону Авогадро. Приведення об’єму газу до нормальних умов. Відносна густина одного газу за іншим. Встановлення відносної густини газу. Рівняння Менделєєва-Клапейрона і його значення. Поняття про еквівалент. Еквівалентний об’єм водню і кисню. Залежність між молярною масою, валентністю і еквівалентною масою елемента. Еквівалентні маси оксидів, основ, кислот і солей. Закон еквівалентів. Емпірична і молекулярна формула речовини.
Короткий виклад теоретичних питань:
Сучасна хімія є одною з природничих наук і являє собою систему окремих наукових дисциплін: загальної і неорганічної хімії, аналітичної хімії, органічної хімії, фізичної та колоїдної хімії, геохімії, космохімії і т.д. Хімія – наука, що вивчає процеси перетворення речовин, які супроводжуються зміною складу і структури, а також взаємні переходи між цими процесами і іншими формами руху матерії. Тобто головним об’єктом хімії як науки є речовини і їх перетворення. Відомі дві форми існування матерії: речовина і поле. Речовина – матеріальне утворення, що складається із елементарних часток, які мають власну масу (масу спокою). На відміну від речовини, поле – матеріальне середовище, в якому відбувається взаємодія часток, які не мають маси спокою. Поле не є безпосереднім об’єктом вивчення в хімії і проявляється перш за все енергетичними характеристиками.
У визначенні хімії підкреслюється взаємозв’язок хімічної і інших форм руху матерії. Рух є спосіб існування матерії, її корінна і невід’ємна властивість. Специфіка хімічної форми руху матерії – зміна складу речовини. Хімічні процеси утворення і руйнування речовини завжди супроводжуються зміною їх складу і структури. Різні форми руху матерії взаємопов’язані. Добре відомі приклади тісного зв’язку між різними формами руху матерії, наприклад хімічної, біологічної та фізичної: в останні роки сильного розвитку зазнала молекулярна біологія, спостерігається бурхливий розвиток біохімії, біоорганічної, біонеорганічної, біофізичної хімії. Процес взаємопроникнення різних природничих наук – об’єктивний наслідок існуючого в природі загального взаємозв’язку різних форм руху матерії. Неорганічна хімія займається вивченням елементів періодичної системи та утворених з атомів елементів простих і складних речовин. Загальна хімія займається розробкою теоретичних уявлень і концепцій про склад і будову речовин, про загальні закономірності перебігу хімічних процесів, що є фундаментом всієї системи хімічних знань. Неорганічна хімія на сучасному етапі успішно вирішує завдання по створенню нових неорганічних речовин із заданими властивостями. Основний експериментальний метод хімії – метод проведення хімічних реакцій. Хімічні реакції – це процес перетворення одних речовин (вихідних) в інші (продукти реакції); продукти хімічної реакції мають склад, а відповідно будову і властивості, відмінні від вихідних. Аналітична хімія використовує хімічні реакції для встановлення якісного і кількісного складу речовин. На основі хімічних реакцій здійснюється неорганічний синтез. До числа фундаментальних узагальнень хімії входять атомно-молекулярна теорія, стехіометричні закони, Періодичний закон і теорія хімічної будови.
Творцем атомно-молекулярної теорії є М.В.Ломоносов. Він вперше чітко розділив дві ступені в будові речовини: елементи (в нашому розумінні атоми) і корпускули (молекули). Основні положення атомно-молекулярного вчення: 1. Речовини мають дискретну будову. Вони складаються з часток (структурних елементів речовин) – молекул, атомів або іонів. 2. Частки речовин (молекули, атоми або інші) безперервно безладно рухаються. 3. Між складовими частками речовини є відстані. 4. Між складовими частками речовин діють сили взаємного притягання і відштовхування. 5. Молекули складаються з атомів. 6. Молекули зберігаються під час фізичних явищ і руйнуються під час хімічних явищ (при хімічних реакціях). 7. Під час хімічних реакцій атоми зберігаються – при цьому відбувається їх перегрупування, що приводить до утворення нових речовин. 8.
Основними поняттями атомно-молекулярного вчення є молекула, атом, хімічний елемент, проста та складна речовина. Молекула – це здатна до самостійного існування найменша частка речовини, що зберігає хімічні властивості цієї речовини. Існування молекул підтверджується зміною агрегатного стану, розчиненням речовин, зміною розмірів тіл із зміною температури, броунівським рухом, явищем дифузії. Як реальні частки молекули мають розміри і масу. Сукупності молекул (речовині) притаманні певні фізичні властивості: агрегатний стан, колір, запах, густина, температура плавлення та кипіння, електропровідність і т.д. Молекула складається з атомів, які з’єднані між собою хімічними зв’язками в певній послідовності і певним чином орієнтовані в просторі. Атом – це реально існуюча хімічно неподільна електрично нейтральна частка речовини, що складається з позитивно зарядженого ядра та негативно заряджених електронів. Атом – це система, що складається з елементарних часток – протонів, нейтронів та електронів. Протони та нейтрони знаходяться в ядрі (центральна частина атома), радіус якого складає 10-14-10-15 м, а електрони утворюють електронну оболонку, розміри якої визначають розміри атома. Атоми – хімічно неподільні частки, тобто під час хімічних реакцій атоми певного виду залишаються незмінними, вони не зникають і не перетворюються в інші. Атоми руйнуються в процесі ядерних реакцій. Кількісною характеристикою атому є заряд його ядра та його відносна атомна маса. В залежності від кількості протонів (відповідно, і електронів, бо атом електронейтральний), які входять до складу атому, існують атоми різних видів. Хімічний елемент – це умовне поняття, яке введене з метою позначення окремих різновидів атомів з певним зарядом ядра. Кожен хімічний елемент має свою назву (наприклад, Гідроген – елемент, до складу атому якого входить 1 протон, Оксиген – елемент, до складу атому якого входить 8 протонів, Купрум – елемент, до складу атому якого входить 29 протонів). Атом кожного окремого елементу позначають з допомогою хімічного знаку (символу): наприклад, Гідроген – Н, Оксиген – О, Купрум – Cu. Всі відомі елементи вказані в Періодичній системі елементів. Порядковий номер елементу в таблиці вказує на кількість протонів в його атомі, цифра під знаком елементу вказує на відносну масу атому цього елементу. Носієм властивостей хімічного елементу є атом. За будовою електронних оболонок атомів хімічні елементи поділяють на s-, p-, d-, f -елементи. За хімічними властивостями розрізняють елементи з металічними та неметалічними властивостями. За походженням виділяють природні та штучні елементи. Природні – це елементи, що існують в природі в складі простих або складних речовин. Природними є елементи з порядковим номером від 1 до 94. Штучні – це елементи, одержані під час перебігу ядерних реакцій. Штучними є елементи, порядковий номер яких >94. До них належать елементи, усі ізотопи яких радіоактивні. Це елементи з порядковими номерами 43, 61, 84–110. За поширенням в природі елементи поділяють на поширені та розсіяні. Найбільш поширеними є Оксиген (47% маси земної кори), Силіцій (29,5%) Алюміній (8,05%), Ферум (4,74%). Розсіяні елементи містяться в мінералах як домішки.
Речовини є сукупностями молекул чи атомів (іонів). Усі речовини за складом поділяють на прості та складні. Простими називають речовини, що складаються з атомів одного елементу, тобто це форма існування хімічного елементу у вільному стані. Складними називають речовини, що складаються з атомів різних елементів, тобто це форма існування хімічних елементів у зв’язаному стані. Алотропія – це явище існування хімічного елементу у вигляді двох або кількох простих речовин, відмінних за властивостями. Відмінності властивостей алотропних модифікацій обумовлені різним числом атомів у молекулі або різною структурою кристалів. Завдяки алотропії число простих речовин (500) більше, ніж хімічних елементів (110).
Для зображення складу речовин та процесу їх перетворень розроблена відповідна хімічна символіка: символи хімічних елементів, хімічні формули та рівняння хімічних реакцій. Символ елементу – це одна або дві перші букви латинських назв хімічних елементів. Хімічний символ елементу відображає один атом хімічного елементу. Знаючи символ елементу, можна, використовуючи періодичну таблицю елементів, назвати його, вказати число протонів в його атомі, а також величину відносної атомної маси. Хімічна формула – це позначення складу сполуки за допомогою символів атомів елементів, з яких вона складається, та індексів – цифр, проставлених справа і трохи нижче від символу певного елементу, які вказують на число атомів цього елементу в сполуці (індекс 1 не ставиться). Використовують різні види хімічних формул:
1) Молекулярна формула відображає якісний склад речовини; кількісний склад речовини; одну молекулу речовини. Знаючи молекулярну формулу, можна встановити співвідношення мас елементів, які входять до складу речовини, а також молекулярну масу речовини. 2) Емпіричні формули базуються на результатах дослідів і відображають якісний склад речовин; стехіометричне співвідношення атомів елементів у речовині; одну умовну частку речовини. 3) Електронні формули схематично зображають механізм утворення хімічних зв’язків у молекулах. Вони записуються за допомогою хімічних символів та крапок, якими позначають електрони зовнішнього енергетичного рівня атомів, що приймають участь в утворенні хімічних зв’язків. 4) Графічні формули схематично зображають порядок сполучення атомів у молекулах. Графічні формули не відображають просторову будову молекули. Для зображення просторової будови користуються моделями молекул – кулестержневими. Хімічні рівняння – це зображення перебігу хімічної реакції за допомогою хімічних символів, формул та коефіцієнтів. Коефіцієнти – це великі цифри, що стоять перед формулами речовин і показують число окремих атомів або молекул. Розрізняють такі види хімічних рівнянь: молекулярні, іонні, електронні та електронно-іонні рівняння напівреакцій, термохімічні: 1) молекулярні рівняння описують всі зміни в реакційній системі в цілому, при цьому речовини зображають молекулярними або емпіричними формулами: 2FeCl3+2KI+3H2SO4 Þ 2FeSO4+I2+6HCl+K2SO4; 2) іонні рівняння відображають реакції між іонами; в них не вказують іонів, що не беруть участь в реакції: H++OH– Þ H2O; 10Cl–+2MnO4–+16H+ Þ 5Cl2+2Mn2++8H2O; 3) електронні рівняння напівреакцій описують процеси окиснення чи відновлення, які відбуваються під час окисно-відновних реакцій, тобто процеси переходу електронів:
в електронно-іонних рівняннях, окрім процесу переходу електронів вказують і іони, що беруть участь в окисно-відновних процесах
4) термохімічні рівняння – це рівняння, в яких вказується тепловий ефект хімічної реакції та агрегатний стан речовин: S(кр.) + O2(газ) ® SO2(газ) + 297 кДж
У хімії використовуються різні фізичні величини, найчастіше такі: маса, об’єм, кількість речовини, густина, відносна атомна маса, відносна молекулярна маса, молярна маса, молярний об’єм, відносна густина газів, тиск, температура, час, концентрація, швидкість хімічної реакції, електричний заряд тощо. Окремі величини представлені нижче в таблиці:
Атомна одиниця маси (а.о.м.) (сучасна позасистемна одиниця вимірювання атомних і молекулярних мас) є
Відносна атомна маса хімічного елементу – це фізична величина, що визначається відношенням маси атому елементу до Відносна молекулярна маса – це фізична величина, що визначається відношенням маси молекули до Кількість речовини – це фізична величина, що визначається числом часток – структурних елементів речовини: молекул, атомів, іонів. Одиницею її вимірювання є моль. Мол ь – це кількість речовини, що містить стільки часток – структурних елементів речовини (молекул, атомів, іонів), скільки атомів є в ізотопі Карбону 12С масою 0,012 кг. Це число дорівнює 6,02·1023. Число Авогадро NA = 6,02·1023 моль–1 вказує число часток, структурних елементів у речовині, кількість якої становить 1 моль. Поняття “моль” застосовують щодо речовин в будь-якому агрегатному стані. Кількість речовини пов’язана з іншими величинами слідуючим чином: n = Молярна маса (М) – це фізична величина, що визначається відношенням маси речовини до кількості речовини, яка їй відповідає: М = Молярний об’єм (Vm)– це фізична величина, що визначається відношенням об’єму речовини до відповідної кількості речовини: Vm =
До основних стехіометричних законів належать: закон збереження маси; закон еквівалентів; закон кратних відношень; закон сталості складу; закони ідеальних газів; закон Авогадро.
Один із фундаментальних і загальних законів природи є закон збереження маси, відкритий у 1748 р. М.В.Ломоносовим: маса речовин, що вступають в реакцію, дорівнює масі речовин, що утворюються внаслідок реакції. На початку ХХ ст. А.Ейнштейн пропонує принцип еквівалентності маси і енергії, згідно з яким зміна маси речовини D m відповідає певній кількості енергії: Е = m·С2, де С – швидкість світла (3·108 м/с). Відносно невеликі енергетичні ефекти хімічних реакцій [(1–5)·102 кДж/моль] не можуть привести до помітної зміни мас речовин, що реагують. Саме тому експериментальні перевірки закону збереження маси речовин завжди підтверджували його правильність.
Вже перші кількісні дослідження хімічних перетворень показали, що речовини реагують між собою тільки в певних масових співвідношеннях. Для характеристики масових кількостей речовин, що сполучаються одна з одною без залишку було введено поняття “еквівалент”. Хімічним еквівалентом елементу є така його масова кількість, яка сполучається з 1,008 масової частки Гідрогену або з 8 масовими частками Оксигену, або заміщує ті самі кількості Гідрогену чи Оксигену в їх хімічних сполуках. Закон еквівалентів був експериментально встановлений німецьким вченим В.Ріхтером в 1797 р., і остаточно сформульований Дж.Дальтоном у 1801 р.: хімічні елементи і речовини реагують між собою у масових кількостях, пропорційних їхнім еквівалентам: Еквівалентну масу простої речовини обчислюють, виходячи з атомної маси (А) і валентності елементу (b) за формулою При розв’язуванні задач на визначення еквівалентних мас необхідно знати: · еквівалентна маса оксиду рівна сумі еквівалентних мас Оксигену і елементу, що входить до його складу; · еквівалентна маса кислоти рівна сумі еквівалентних мас Гідрогену і кислотного залишку; · еквівалентна маса основи дорівнює сумі еквівалентних мас металу і гідроксогрупи; · еквівалентна маса солі дорівнює сумі еквівалентних мас металу і кислотного залишку. Для визначення еквівалентної маси кислоти необхідно розділити її молярну масу на основність кислоти. Для визначення еквівалентної маси основи необхідно її молярну масу розділити на кислотність основи. Для визначення еквівалентної маси солі необхідно її молярну масу розділити на добуток числа атомів металу у молекулі солі на валентність металу. В загальному випадку еквівалент складної речовини не є постійною величиною, а залежить від хімічної реакції, в якій ця речовина бере участь. Якщо в реакції приймають участь газоподібні речовини, то користуються еквівалентним об’ємом, який займає при даних умовах еквівалент газоподібної речовини. Еквівалентний об’єм водню при н.у. рівний 11,2 л, а кисню – 5,6 л.
Закон сталості складу речовин був відкритий у 1801 році Ж.Прустом: кожна чиста речовина молекулярної будови незалежно від способу і умов її добування має певний сталий (незмінний) склад. Наприклад, сірчистий газ можна добувати різними способами (наприклад, згідно рівнянь реакцій S+O2 Þ SO2; Cu+2H2SO4 Þ CuSO4+SO2+2H2O; 2H2O+3O2 Þ 2SO2+2H2O), проте одержаний SO2 у чистому вигляді завжди містить 50 мас.% Сульфуру і 50 мас.% Оксигену. Ще за часів Ж.Пруста правильність цього закону заперечувалася К.Бертоле, який вважав, що склад речовини є величина змінна і залежно від умов добування може змінюватись в певних межах. Лише в ХХ ст. Завдяки роботам М.С.Курнакова було показано, що в природі можуть бути два типи сполук: із сталим та змінним складом. Сполуки, які мають сталий склад і цілочислове атомне співвідношення компонентів називають дальтонідами. До них належать сполуки з ковалентним зв’язком, що при звичайних умовах перебувають у газоподібному і рідкому станах. Сполуки, що мають змінний склад, а стехіометричне співвідношення компонентів яких не відповідає цілим числам, називаються бертолідами. До бертолідів належать кристалічні сполуки в основному перехідних металів типу оксидів, сульфідів, нітридів, фосфідів, карбідів, гідридів тощо. Наприклад, Цирконій з Нітрогеном утворює сполуки, склад яких може змінюватися в певних межах: ZrN0,59–ZrN0,89, а Титан з Гідрогеном TiH–TiH2.
Закон кратних відношень відкритий Дж.Дальтоном у 1803 році: якщо два елементи утворюють між собою кілька хімічних сполук, то масові кількості одного з елементів, що припадають у цих сполуках на ту саму масову кількість другого елемента відносяться між собою як прості цілі числа. Оксиди Нітрогену
Стан даної маси газу визначається температурою t, тиском р і об’ємом V. Якщо р = 1,01325·105 Па і t = 0оС, то умови, при яких знаходиться газ, називають нормальними (н.у.). Об’єм при н.у. прийнять позначати V 0, а тиск – р 0. Стан газу, що знаходиться при умовах, відмінних від нормальних, описується такими законами: 1. При постійній температурі об’єм даної маси газу обернено пропорційний тиску (закон Бойля-Маріотта) (1660-1677 рр.): 2. При постійному тиску об’єм даної маси газу при підвищенні його температури на 1оС збільшується на 1/273,15 частину об’єму V 0, який газ займав при 0оС: V = V 0(1+ 3. При постійному об’ємі залежність тиску даної маси газу від температури виразиться рівнянням р = р 0(1+
У рівних об’ємах різних газів за однакових умов (тиск, температура) міститься однакове число молекул. Наслідки: 1)так як число молекул в 1 молі будь-якої речовини постійне, то різні речовини кількістю 1 моль в газоподібному стані при однакових умовах займають рівні об’єми. Молярний об’єм ідеального газу (при н.у.) Vm 0 = 22,414·10–3 м3/моль = 22,414 л/моль. Звідси випливає, що густину газу, тобто масу 1 л (при н.у.) можна визначити, якщо відома його молярна маса М: r0= Об’єднуючи закони Бойля-Маріота, Гей-Люсака і Шарля одержимо рівняння стану ідеального газу
Якщо величину Тестові завдання: 1. Виберiть з наведених нижче частинок: А – атоми, Б – iони, В – молекули. 2. Якi з наведених нижче сполук потрiбно вiднести до простих: 3. Якi з наведених нижче сполук слiд вiднести до складних: 4. Зразки мiдi одержанi рiзними способами з таких речовин: червоного Cu2O, чорного CuO, бiлого CuSO4, синього CuSO4 5H2O. Чи вiдрiзняються зразки мiдi один вiд одного за фiзичними i хiмiчними властивостями? 5. Внаслiдок рiзних реакцiй отримано воду: 6. До яких явищ (фiзичних чи хімічних) можна вiднести прожарювання залізної дротини на повiтрi, видiлення кристалiв хлористого натрiю iз його водного розчину. Дайте мотивовану вiдповiдь. Сформулюйте основнi ознаки, якi характеризують фiзичнi i хiмiчнi явища. 7. Які з приведених гідроксидів можуть утворювати основні солі: а) Cu(OH)2; б) Ca(OH)2; в) LiOH; г) Al(OH)3; д) KOH. 8. Які кислоти може утворити Р2О5 при взаємодії з водою: а) фосфористу; б) пірофосфорну; в) ортофосфорну; г) метафосфорну. 9. Назвіть солі: (CuOH)2CO3; Al(OH)2NO3; Ca(HCO3)2; Al(H2PO4)3; CrOHCl2; Fe(OH)2NO2; Ca(H2PO4)2; BaHPO4; AlOHCl2. 10.Напишiть графiчнi формули та знайдiть валентнiсть Мангану у сполуках KMnO4 та MnSO4. 11.Напишiть графiчнi формули та знайдiть валентнiсть Хрому в сполуках K2Cr2O7 та CrCl3. 12. Напишiть графiчнi формули та знайдiть валентнiсть Хлору в сполуках KClO3 та KClO4. 13.Напишiть графiчну формулу та знайдiть валентнiсть Фосфору в сполуках К3РО4 та К2H2Р2О7. 14.Напишiть графiчнi формули та знайдiть валентнiсть Хрому в сполуцi Na2CrO4 та Cr2(SO4)3. 15.Напишiть графiчнi формули та знайдiть валентнiсть Феруму в сполуцi Fe(OH)2NO3 та FeOHCl.
Розрахункові задачі: 1. Визначити: а) число моль Магнію в 0,486 г Mg; б) число моль сульфату алюмінію в 34,2 г Al2(SO4)3; число моль води в 1 л при 4оС і 1,013·105 Па. (Відповідь: а) 0,02 моль; б) 0,1 моль; в) 55,6 моль.) 2. Визначити вiдносну молекулярну масу дигiдрофосфату залiза(II). 3. Знайдiть масу гiдроксосульфату алюмiнiю кiлькiстю речовини 0,3 моль. 4. Виразити в молях і грамах: а) 6,02·1021 молекул ацетилену С2Н2; б) 2,00·1023 молекул фосгену СОCl2. (Відповідь: а) 0,01 моль; 0,26 г; б) 1/3 моль і 33 г.) 5. Чи однакове число молекул: а) в 1 г водню і в 1 г кисню; б) в 1 молі водню і в 1 молі кисню? 6. Скiльки молей мiститься в 1л води? 7. При вiдновленнi воднем 1,34 г оксиду металу до металу утворилося 0,34 г води. Вирахувати еквiвалентну масу металу. 8. Знайдiть масу мiдного купоросу кiлькiстю речовини 0,5 моль. 9. 1з якої кiлькостi оксиду ртутi(ІІ) видiлиться 16 г кисню? 10. Оксид мiстить 78,7% металу i 21,3% Оксигену. Питома теплоємнiсть металу 0,21. Визначити його атомну масу. 11. Пiд час прожарювання СаСО3 масою 1 г отримано СаО масою 0,56 г i СО2 об’ємом 224 мл (н.у.). Чи пiдтверджують цi данi закон збереження маси речовин? 12. Знайдiть масу гiдроксохлориду залiза(II) кiлькiстю речовини 2,5 моль. 13. При взаємодiї з кислотою 0,608 г металу витiсняється 560 мл водню (н.у.). Питома теплоємнiсть металу 1,09. Визначити його атомну масу. 14. Яка маса 1 л кисню при н.у.? 15. Кiлькiсть сірчаної кислоти 0,2 моль. Якiй масi в грамах це вiдповiдає? 16. Сполука мiстить 46,15% Карбону, iнше – Нітроген. Густина за повiтрям 1,79. Знайти iстинну формулу сполуки. 17. Густина газiв за повiтрям рiвна: а) 0,9 б) 2,45. Визначити їх молярнi маси. 18. Для повного вiдновлення 1,59 г оксиду до металу використано 478 мл водню (при 7оС i 100 кПа). Вирахувати еквiвалент металу. 19. Найбiльшу кiлькiсть молекул вмiщує 1 л (н.у.) а) хлороводню; б) сiрководню; в) водню; г) води. 20. Знайдiть масу дигiдрофосфату натрiю кiлькiстю речовини 0,2 моль. 21. Сполука Бору з Гідрогеном мiстить 78,18% Бору, iнше – Гідроген. Густина за воднем 13,7. Знайти iстинну формулу. 22. 0,2 г металу витiснили 197 мл водню, який був зiбраний над водою i вимiряний при 20оС i 102 кПа. Тиск водяних парiв при цiй температурi 2,37 кПа. Знайти еквiвалент металу. 23. Знайти найпростішу і дійсну формулу газу, який має такий склад: 82,76% С; 17,24% Н. Густина газу за повітрям 2,01. 24. При прокалюванні 2,94 г кристалогідрату хлориду кальцію виділилося 1,45 г води. Вивести формулу цього кристалогідрату. 25. Який об’єм при Р = 1,013·105 Па і t = 0оС займе 1 кг суміші газів: а) 20% NO; 40% N2; 40% CO2; б) 20% C2H2; 40% CH4; 40% CO. 26. Визначити молекулярні маси газів, якщо: а) 0,29 л газу при температурі 27оС і тиску 1,064·105 Па мають масу 0,32 г; б) 1,56 л газу при 27оС і тиску 1,037·105 Па має масу 2,86 г. 27. Густина газів за повітрям рівні: а) 0,9; б) 2,45. Визначити масу 1 л кожного газу. 28. Із скількох атомів складаються молекули: а) парів сірки при температурі 950оС, якщо густина їх за повітрям рівна 2,2; б) парів сурми при 2000оС, якщо густина їх за воднем рівна 60,88? 29. При прокалюванні деякої кількості Pb(NO3)2 маса його зменшилася на 2,16 г. Визначити масу в грамах і число молів взятої солі і об’єми одержаних кисню і диоксиду азоту при нормальних умовах. 30. Скільки треба взяти карбонату кальцію, щоб одержаним при його розкладі вуглекислим газом наповнити балон об’ємом 40 л при температурі 15оС і тиску 1,013·106 Па. 31. Який об’єм кисню, взятого при 300оС і тиску 5,06·105 Па витрачений на згоряння 10 кг кам’яного вугілля до утворення СО2, якщо у вугіллі містилося 94% С. Який об’єм при цих умовах займе утворений СО2? 32. Визначити процентний вміст карбонату кальцію у вапняку, якщо при прокалюванні 1 г цього вапняку одержано 0,225 л СО2 при 0оС і Р= 0,904·105 Па. 33. Визначити еквівалентні маси наступних елементів: а) олова, якщо при нагріванні 0,92 г його в струмені кисню утворюється 1,17 г оксиду олова; б) олова, якщо при відновленні 1,17 г оксиду олова воднем одержано 0,16 г води; в) магнію, якщо при нагріванні в струмені кисню його маса збільшилася на 66,7%; г) мангану, якщо при відновленні 2,17 г оксиду мангану алюмінієм утворилося 1,7 г оксиду алюмінію Al2O3. 34. 1 г калію з’єднується з 0,9 г хлору, а також з 2 г брому. Знайти еквівалентні маси калію і брому, якщо еквівалентна маса хлору рівна 35,5. 35. Скільки оксиду одержиться при окисненні 3 г металу, еквівалентна маса якого рівна 9 г. 36. Написати формулу сполуки Стибію: а) з Сульфуром; б) з Оксигеном, якщо відомо, що атомна маса Стибію рівна 121,8 г, еквівалентна її маса 40,6 г, атомна маса Сульфуру 32, еквівалентна її маса 16. 37. Визначити еквівалентні маси кислот і основ в наступних реакціях: 38. Які об’єми займуть при нормальних умовах маси одного еквіваленту кисню і одного еквіваленту водню. 39. Визначити еквівалентну масу металу, якщо 0,046 г його витіснили з кислоти 62,35 мл водню, зібраного над водою при температурі 17оС і тиску 1,017·105 Па. Тиск водяної пари при 17оС рівний 0,193·105 Па. 40. Визначити процентний вміст домішок в технічному сульфіді заліза, якщо при взаємодії 5 г його з кислотою виділилося 0,8 л сірководню при температурі 39оС і тиску 1,617·105 Па. 41. Густина газу за гелієм рівна 19,5. Яка молекулярна маса цього газу? 42. Визначити парціальний тиск кисню і азоту в повітрі, якщо їх об’ємні долі складають 21% О2 і 78% N2 (1% припадає на інші гази). Тиск повітря прийняти рівним 1,013·105 Па.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 417; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.8.110 (0.147 с.) |
 Різноманітність речовин зумовлена різним порядком сполучення атомів.
Різноманітність речовин зумовлена різним порядком сполучення атомів. ;
; + 8H+ ® Mn2+ + 4H2O
+ 8H+ ® Mn2+ + 4H2O
 m
m  )–1
)–1
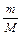

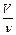


 або
або 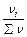 або
або  або
або  маси атома ізотопу Карбону 12С: 1 а.о.м. = 1,66·10–24 г.
маси атома ізотопу Карбону 12С: 1 а.о.м. = 1,66·10–24 г.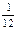 частки маси атома ізотопу Карбону 12С: Ar = mатому· (
частки маси атома ізотопу Карбону 12С: Ar = mатому· ( частки маси атома ізотопу Карбону 12С. Відносна молекулярна маса розраховується за хімічною формулою як сума відносних атомних мас всіх атомів елементів, що входять до складу молекул: Mr (B l C n D m) = l Ar (B) + n Ar (C) + m Ar (D), де B l C n D m – формула речовини; Ar – відносна атомна маса елементів; l, n, m – індекси хімічних елементів у формулі.
частки маси атома ізотопу Карбону 12С. Відносна молекулярна маса розраховується за хімічною формулою як сума відносних атомних мас всіх атомів елементів, що входять до складу молекул: Mr (B l C n D m) = l Ar (B) + n Ar (C) + m Ar (D), де B l C n D m – формула речовини; Ar – відносна атомна маса елементів; l, n, m – індекси хімічних елементів у формулі. ; n =
; n =  , де m – маса речовини; M – молярна маса; N – число часток; NA – стала Авогадро; V – об’єм речовини (н.у.); Vm – молярний об’єм речовини.
, де m – маса речовини; M – молярна маса; N – число часток; NA – стала Авогадро; V – об’єм речовини (н.у.); Vm – молярний об’єм речовини. , де m – маса речовини; n – кількість речовини, що їй відповідає. Одиниця вимірювання кг/моль, г/моль.
, де m – маса речовини; n – кількість речовини, що їй відповідає. Одиниця вимірювання кг/моль, г/моль. , де V – об’єм речовини, n – кількість речовини, що йому відповідає. Одиниця вимірювання м3/моль, л/моль.
, де V – об’єм речовини, n – кількість речовини, що йому відповідає. Одиниця вимірювання м3/моль, л/моль.
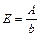 . Еквівалент елементу в складній сполуці А n В m обчислюють за формулою
. Еквівалент елементу в складній сполуці А n В m обчислюють за формулою  , де М – молекулярна маса речовини; n – кількість атомів даного елементу в сполуці, b – валентність елементу.
, де М – молекулярна маса речовини; n – кількість атомів даного елементу в сполуці, b – валентність елементу. або: при Т = const р·V = const
або: при Т = const р·V = const t) або V = V 0
t) або V = V 0  . Якщо ввести позначення абсолютної температури Т = t +273,15 К, то одержимо:
. Якщо ввести позначення абсолютної температури Т = t +273,15 К, то одержимо:  , так як
, так як  є величина постійна, то маємо:
є величина постійна, то маємо:  const при р = const (закон Гей-Люссака, 1802 р.).
const при р = const (закон Гей-Люссака, 1802 р.). = const при V = const (закон Шарля, 1787 р.)
= const при V = const (закон Шарля, 1787 р.) ; 2) співвідношення густин двох газів за однакових умов дорівнює співвідношенню їх відносних молекулярних або молярних мас: r1/r2= М 1/ М 2.
; 2) співвідношення густин двох газів за однакових умов дорівнює співвідношенню їх відносних молекулярних або молярних мас: r1/r2= М 1/ М 2.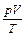 =
=  =
=  =... =
=... = 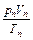 = const
= const віднести до кількості газу, рівній 1 моль, то вона буде мати певне значення, однакове для всіх газів. Ця величина називається універсальною газовою сталою і позначається через R. Відповідно, для будь-якого газу кількістю 1 моль
віднести до кількості газу, рівній 1 моль, то вона буде мати певне значення, однакове для всіх газів. Ця величина називається універсальною газовою сталою і позначається через R. Відповідно, для будь-якого газу кількістю 1 моль 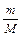 ; РV=
; РV= 


