Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Комбинаторная химия и высокопроизводительный скрининг
Скринингом называется оптимизированная конвейеризованная процедура, в результате которой большое количество химических соединений (> 10000) проверяется на аффинность или активность по отношению к специальной тестовой (имитирующей биологическую) системе. По производительности различают разные виды скрининга:
· Низкопроизводительный (10000 ÷ 50000 образцов); · Среднепроизводительный (50000 ÷ 100000 образцов) и · Высокопроизводительный (100000 ÷ 5000000+ образцов). Для скрининга как для «промышленной» процедуры очень критична эффективность, стоимость и время, потраченное на операцию. Как правило, скрининг производится на роботизированных установках, способных работать в круглосуточном и круглогодичном режиме (см. рис. 4).
Принцип скрининга достаточно прост: в плашки, содержащие тестовую систему (например, иммобилизованная мишень или специальным образом модифицированные целые клетки), робот раскапывает из пипетки исследуемые вещества (или смесь веществ), следуя заданной программе. Причем на одной плашке могут находиться тысячи «лунок» с тестовой системой, и объем такой лунки может быть очень мал, так же как и объем вносимой пробы (микро- или даже нанолитры). Потом происходит считывание данных с плашки, говорящее о том, в какой лунке обнаружена биологическая активность, а в какой — нет. В зависимости от используемой технологии детектор может считывать радиоактивный сигнал, флюоресценцию (если система построена с использованием флуоресцентных белков), биолюминесценцию (если используется люциферин-люциферазная система или ее аналоги), поляризацию излучения и многие другие параметры.
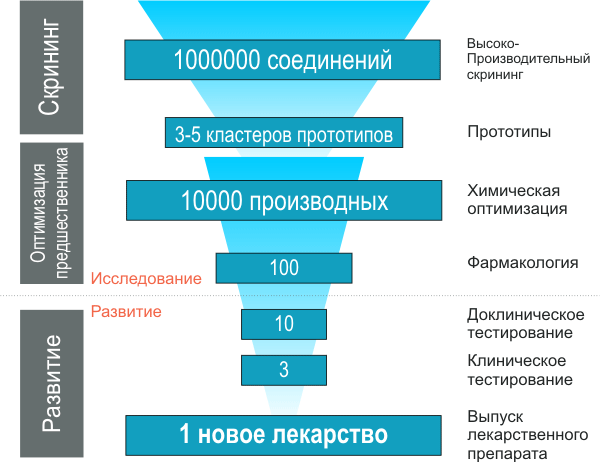
Обычно в результате скрининга количество тестируемых соединений сокращается на 3-4 порядка. Соединения, для которых в процессе скрининга выявлена активность выше заданного значения, называются прототипами. Однако следует понимать, что такие «удачи» еще очень и очень далеки от конечного лекарства. Лишь те из них, которые сохраняют свою активность в модельных системах и удовлетворяют целому ряду критериев, дают предшественников лекарств, которые используются для дальнейших исследований. Как уже было сказано, даже библиотеки, содержащие более миллиона соединений, не в состоянии представить все возможное химическое пространство лигандов. Поэтому при проведении скрининга можно выбрать две различные стратегии: диверсификационный скрининг и сфокусированный скрининг [3]. Различие между ними заключается в составе используемых библиотек соединений: в диверсификационном варианте используют как можно более непохожие друг на друга лиганды с целью охватить как можно большую область химического пространства, при сфокусированном же, наоборот, используют библиотеки родственных соединений, полученных методами комбинаторной химии, что позволяет, зная приблизительную структуру лиганда, выбрать более оптимальный его вариант. Здравый смысл подсказывает, что в масштабном проекте по созданию нового лекарственного препарата следует использовать оба этих подхода последовательно — сначала диверсификационный, с целью определения максимально различных классов удачных соединений, а потом — сфокусированный, с целью оптимизации структуры этих соединений и получения рабочих прототипов. Отдельно надо сказать о библиотеках соединений. Понятно, что такое большое количество различных соединений – миллионы штук – можно синтезировать только с помощью высокопроизводительных методов комбинаторной химии. Комбинаторные библиотеки представляют собой серии большого числа соединений, полученных однотипным методом с использованием аналогичных реагентов. Такой метод при использовании специального оборудования позволяет одновременно проводить десятки и даже сотни параллельных синтезов. Так, например, взаимодействие ряда замещенных бензойных кислот с рядом замещенных анилинов позволяет синтезировать комбинаторную библиотеку замещенных бензанилидов, число членов которой равно произведению числа исходных реагентов (схема 1).
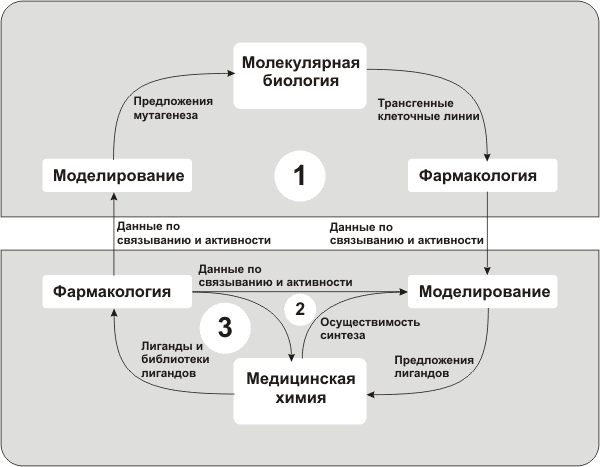
Схема 1 Варьируя субстрат и реагент, исследователи добиваются получения широкой гаммы соединений с различными структурными параметрами. Если для мишени известно так называемое биологическое пространство, то есть какие-либо характеристики лигандов (размер, гидрофобность и т.д.), которые могут с ней связываться, то при составлении библиотеки тестируемых соединений выбирают лиганды, попадающие в «пересечение» биологического и химического пространств, так как это заведомо повышает эффективность процедуры. Структуры прототипов, полученные в результате скрининга, далее подвергаются разнообразным оптимизациям, проводимым в современных исследованиях, как правило, в тесном сотрудничестве между различными группами исследователей: молекулярными биологами, фармакологами, моделистами и медицинскими химиками (см. рис. 5).
С каждым оборотом такого «фармакологического цикла» прототип приближается к предшественнику и затем к кандидату, который уже тестируется непосредственно на животных (доклинические испытания) и на людях — в процессе клинических испытаний. Таким образом, роль скрининга заключается в существенном сокращении (на несколько порядков) выборки прототипов (см. рис. 6).
Клинические исследования Медицина — это область, в которой ни в коем случае не следует спешить. В особенности, если речь идет о разработке новых лекарственных препаратов. Достаточно вспомнить историю с препаратом Талидамидом, разработанным в конце 50-х в Германии, применение которого беременными женщинами приводило к рождению детей с врожденными пороками конечностей, вплоть до их полного отсутствия. Этот побочный эффект не был вовремя выявлен во время клинических исследований в силу недостаточно тщательного и аккуратного тестирования. Поэтому в настоящее время процедура тестирования лекарств достаточно сложна, дорога и требует значительного времени (2-7 лет тестирования в клинике и от 100 миллионов долларов на одно соединение-кандидат, см. рис. 7).
Прежде всего, еще до поступления в клинику, препараты исследуются на токсичность и канцерогенность, причем исследования должны проводиться, кроме систем in vitro, как минимум на двух видах лабораторных животных. Токсичные препараты, само собой, в клинику не попадают, за исключением тех случаев, когда они предназначены для терапии особо тяжелых заболеваний и не имеют пока менее токсичных аналогов.
Кроме того, препараты подвергаются фармакокинетическим исследованиям, то есть тестируются на такие физиологические и биохимические характеристики, как поглощение, распределение, метаболизм и выведение (по-английски обозначается аббревиатурой ADME — Absorption, Distribution, Metabolism and Extraction). Биодоступность, например, является подхарактеристикой введения препарата в организм, характеризующая степень потери им биологических свойств при введении в организм. Так, инсулин, принимаемый перорально (через рот), имеет низкую биодоступность, так как, будучи белком, расщепляется желудочными ферментами. Поэтому инсулин вводят либо подкожно, либо внутримышечно. По этой же причине часто разрабатывают препараты, действующие аналогично своим природным прототипам, но имеющие небелковую природу. Юридически процесс клинических исследований новых препаратов имеет очень много нюансов, так как они требуют огромного количества сопроводительной документации (в сумме несколько тысяч страниц), разрешений, сертификаций и т.д. Кроме того, многие формальные процедуры сильно разнятся в разных странах в силу различного законодательства. Поэтому, для решения этих многочисленных вопросов, существуют специальные компании, принимающие от крупных фармацевтических компаний заказ на проведение клинических испытаний и перенаправляющие их в конкретные клиники, сопровождая весь процесс полной документацией и следя, чтобы никакие формальности не были нарушены.
|
|||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 583; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.53.68 (0.009 с.) |