
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Будова молекул карбонових кислот
Мал. 23 Схема утворення л-зв'язків у карбоксильній групі.
Методичні рекомендації 1.При вивченні першого питання звернути увагу на електронну будову основного і збудженого станів атома Карбону. 2. Після розгляду другого питання заповнити таблицю:
3.Розглядаючи третє питання, звернути увагу на будову функціональних груп та розподіл електронної густини в них. Запитання для самоперевірки: 1. Який тип гібридизації характерний для насичених вуглеводнів? 2. Охарактеризувати механізм sp 2 – гібридизації. Для яких класів сполук він характерний? 3.У чому полягає особливість ароматичного зв’язку? 4.У чому полягає взаємний вплив атомів у гідроксильній та карбонільній групах? Тести для самоконтролю І рівень 1.Яка кількість неспарених електронів на зовнішньому енергетичному рівні атома Карбону у незбудженому стані: а)один; в) три; б)два; г) чотири. 2.У молекулах алканів між атомами Карбону характерний: а) л-зв'язок; в) два л-зв'язки і один б) 3.Для алкадієнів характерна наявність: а)одного подвійного зв’язку; в) одного потрійного зв’язку; б)двох подвійних зв’язків; г) ароматичного зв’язку. ІІ рівень 4. Для одноатомних спиртів характерною є наявність: а) одної гідроксильної групи; в) однієї карбонільної групи; б) двох гідроксильних груп; г) однієї карбоксильної групи. 5. Вказати карбонільну групу: а) – ОН; в) – СОН; б) – С ІІІ рівень 6.Встановити відповідність між типом гібридизації та її характеристикою: 1)sp 3 гібридизація а) лінійна молекула, 120 о, 0,12 нм; 2)sp 2 – гібридизація б) площинна молекула, 120 о, 0,143 нм; 3)sp – гібридизація в) тетраедрична молекула, 109,5 о, 0,154 нм; г) лінійна молекула, 180 о. 0,12 нм; д) тетраедрична молекула, 120 о. 0,154 нм. 7.Встановити відповідність між класом сполук та особливостями будови їх молекул: 1)алкени а) потрійний зв’язок; 2)алкіни б) гідроксильна група; 3)арени в) ароматичний зв’язок; 4)карбонові кислоти г)карбонільна група;
д) подвійний зв’язок; е)карбоксильна група. Позааудиторна самостійна робота № 17 Тема: Хімічний зв'язок в органічних молекулах та взаємний впливатомів План
Час виконання: 2 години Мета роботи: ознайомитися з типами хімічного зв’язку в органічних молекулах та взаємним впливом атомів один на одного.
В органічній та біоорганічній хімії найпоширенішим є ковалентний зв'язок. Він виникає в результаті усуспільнення пари електронів двох атомів, які утворюють між собою хімічний зв'язок. Наприклад, два атоми Гідрогену утворюють молекулу водню:
Ковалентний зв'язок має певні характеристики. Розглянемо дві з них. Довжина зв’язку – відстань між ядрами сусідніх атомів. Зі збільшенням кратності його довжина зменшується. Так, одинарний зв'язок має довжину 1,54 Å, подвійний – 1,34 Å, потрійний – 1,21 Å. Полярність зв’язку – нерівномірний розподіл електронної густини між двома сусідніми атомами, які значновідрізняються своїми електронегативностями. Усі елементи періодичної системи Д. І. Менделеєва за електронегативністю розміщені в певній послідовності (шкала Полінга). За цією шкалою елементи що утворюють біоорганічні сполуки, розміщені так: F - 4,0; O – 3,5; Cl – 3,0; Br – 2,8; S – 2,5; C – 2,5; H – 2,1. Найбільшу електронегативність має атом Флуору, найменшу – атом Гідрогену. Якщо хімічний зв'язок утворюють атоми з однаковою електронегативністю, такий зв'язок буде неполярним,якщо атоми з різною електронегативністю – полярним. Що більша різниця електронегативностей між сусідніми атомами, то полярніший зв'язок (С – С – неполярний зв'язок, С - N - слабополярний; С – F - сильнополярний). В органічній хімії розрізняють два типи зміщень електронів: а) електронні зміщення, що відбуваються у системі σ – звязків; б) електронні зміщення, які передаються системою π – звязків. У першому випадку має місце так званий індукційний ефект, у другому – мезомерний. Індукційний ефект – це перерозподіл електронної густини. Який виникає в результаті різниці електронегативностей між атомами молекули.
Як вже зазначалося, електронна густина в молекулах зміщена в бік більш електронегативного атома. Це зміщення передається вздовж σ – звязків карбонового скелета. Наприклад: δ3+ δ2+ δ1+ δ+ δ- СН3 → СН2 →СН2 →СН2 →Cl δ3+ < δ2+ < δ1+ < δ+ Атоми або групи атомів, що притягують до себе електрони, мають – І ефект, а замісники, які відштовхують від себе електрони, мають +І – ефект. Позитивний індукційний ефект мають алкільні радикали (СН3 -, С2Н5 –тощо). Усі інші замісники, сполучені з атомом Карбону, мають негативний індукційний ефект. Індукційний ефект графічно зображають прямою стрілкою. Мезомерний ефект – це перерозподіл електронної густини вздовж системи спряжених π – звязків. До спряжених систем належать молекули органічних сполук, в яких чергуються подвійні та одинарні звязки, або якщо поряд з подвійним звязком знаходиться атом, що має на р – орбіталі неподілену пару електронів. У першому випадку має місце π, π -, а у другому – р, π – спряження. Спряжені системи бувають з відкритим і замкненим ланцюгом спряження. Прикладом таких сполук є бута – 1.3 – дієн і бензин. У молекулах цих сполук атоми Карбону перебувають у стані sp2 – гібридизації, і за рахунок негібридних р – орбіталей утворюються π – зв’язки, які, взаємодіючи між собою, утворюють єдину електронну хмару, тобто спостерігається спряження. У замкнених спряжених системах делокалізація р – орбіта лей виражена ще більше, завдяки чому в молекулі бензену електронна густина розподілена між усіма атомами Карбону
Є два види мезомерного ефекту – позитивний мезомерний ефект (+М) і негативний (-М). Позитивний мезомерний ефект виявляють замісники, що надають р – електрони у спряжену систему, а негативний – замісники, що відтягують на себе π – електронну густину зі спряженої системи. При цьому +М-ефект виявляють:
– атоми або атомні групи, які мають негативні заряди: О2- Мезомерний ефект називають негативним (–М-ефект), якщо атоми або групи атомів приймають електронну густину від p -зв’язку (тобто являються акцепторами електронів). При цьому –М-ефект виявляють замісники, які приймають („стягують”) на себе електронну густину:
Мезомерний ефект графічно зображають зігнутою стрілкою, яка показує напрямок зміщення електронів. Методичні рекомендації 1.При вивченні першого питання скласти опорний конспект опрацьованого матеріалу. 2.Розглядаючи друге питання, звернути увагу на види індукційного та мезомерного ефектів та частинки, що виявляють ці ефекти. Завдання для самоконтролю: 1.Заповнити порівняльну таблицю:
2. Дати визначення поняттям: індукційний ефект (±І) і мезомерний ефект (± М). 3. Дати визначення поняттям: ефект спряження, спряжена система. У формулах сполук а)-г) показати розподіл електронної густини, вказати тип спряження:
Тести для самоконтролю: Рівень І 1.Вказати елемент, що має найменшу електронегативність: а) Хлор; б) Гідроген; в) Сульфур; г) Бром; д) Флуор. 2. Який з параметрів не є характеристикою ковалентного зв’язку: а) довжина; б) полярність; в) геометричність. 3.Який із замісників має - І – ефект:
а) Cl -; б) CH3 -; в) C2H5 -; г) C3H7 -; д) C4H9 -. Рівень ІІ 4. Вказати спряжену систему з замкненим ланцюгом спряження: а) пента – 1,3 – дієн; б) бензен; в) бута – 1,3 - дієн; г) гекса – 2, 4 - дієн. 5. Який із замісників має - М – ефект: а) = С = О; б) Cl -; в) Br -; г) F -. Рівень ІІІ 6. Показати розподіл електронної густини в молекулах:
7. У якій з молекул спостерігається σ – π – спряження: а) бута – 1,3 – дієн; б) пропілен; в) хлористий вініл; г) алільний карбокатіон.
|
||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 679; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.8.141 (0.019 с.) |
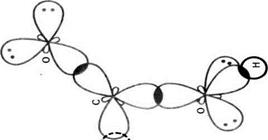
 -зв'язок;
-зв'язок; С -; г) – СООН.
С -; г) – СООН.










