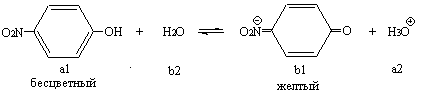Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химическая кинетика. Семинар.
Задания для самостоятельной работы
3.67: 3.70; 3.83; 3.91; 3.97; 3.111
Дата __________ Занятие ____________ МОДУЛЬ 04. Свойства растворов. СЕМИНАР. Задания для самостоятельной работы 4.12; 4.25; 4.43; 4.47; 4.54; 4.59; 4.64; 4.68; 4.70 4.86; 4. 92; 4.100
Дата _________ Занятие ________ МОДУЛЬ №05. Протолитические равновесия и процессы. Задания для самостоятельной работы
5.16; 5.52; 5.53; 5.60; 5.67;5.69; 5.70; 5.72; 5.75
Дата _______ Лабораторная работа 6.4
Буферная емкость растворов. Цель: Научиться исследовать зависимость буферной емкости раствора от разбавления и экспериментально определять буферную емкость по кислоте и основанию. Задание: Приготовить несколько растворов, содержащих ацетатный буфер. Установить зависимость буферной емкости от разбавления. Рассчитать буферную емкость по кислоте и основанию. Оборудование и реактивы: Набор пробирок в штативе, бюретки вместимостью 25 мл, воронки, мерные цилиндры, конические колбы, пипетки, стеклянные палочки, капельницы с растворами. Соляная кислота, растворы уксусной кислоты, гидроксида натрия, ацетата натрия (0,1 моль/л), раствор метилового оранжевого в этаноле, раствор метилового красного в этаноле. Сущность работы: Визуальное наблюдение за изменениями в пробирках, содержащих буферные растворы и при разбавлении. Буферную емкость по кислоте определяют ацидиметрическим методом, буферную емкость по основанию – алкалиметрическим методом (см. Модуль 01).
Выполнение эксперимента: Опыт 1. Установление зависимости буферной емкости раствора от разбавления.
Наблюдения: Вывод: Опыт 2. Определение буферной емкости раствора по кислоте.
Расчет: Буферную емкость по кислоте рассчитываеют по формуле:
βа = V(HCL)c(HCL) / Vбуф.р.∆ рН,
где c(HCL)- молярная концентрация хлороводорода в титранте, моль/л; V(HCL) – результат титрования,мл; Vбуф.р – объем испытуемого буферного раствора,мл; ∆ рН – изменение рН испытуемого раствора в процессе добавления соляной кислоты; ∆ рН = . рН (испыт.р) - рН(свидетеля)
* В выводе указывают полученные результаты, дают объяснения полученным результатам.
Вывод: Дата ___________ Занятие ________
Задания для самостоятельной работы 5.102; 5.106; 5.107; 5.120; 5.126;5.128; 5.129; 5.131; 5.135
Дата ___________
Лабораторная работа 6.1 Определение рН раствора фотоэлектроколориметрическим методом.
Цель работы. Научиться определять рН растворов с помощью фотоэлектроколориметрического метода. Задание: определить рН одного-двух растворов по указанию преподавателя; сопоставить полученный результат с расчетным для данной протолитической системы. Оборудование и реактивы: колориметр КФК-2 с набором кювет, штатив с пробирками, бюретки, воронки, пипетки градуированные. Водный р-р карбоната натрия (с=0,1 моль/л), набор индикаторов по Михаэлису, универсальный индикатор, исследуемые растворы, дистиллированная вода. Сущность работы. М етод основан на использовании кислотно-основных индикаторов, представляющих собой слабые кислоты или основания, изменяющие характер или интенсивность окраски в обратимых реакциях протонирования - депротонирования. У одноцветных индикаторов молекулярная форма бесцветна, а ионная - окрашена. Пример одноцветного индикатора – n -нитрофенол:
При прибавлении к водному раствору n-нитрофенола небольшого количества сильной кислоты сопряженное основание (Ind-) переходит в соответствующую бесцветную кислоту (HInd); интенсивность окраски уменьшается или она исчезает вовсе. Наоборот, прибавление небольшого количества сильного основания вызывает смещение равновесия в противоположном направлении: концентрация окрашенной формы индикатора (Ind-) возрастает, интенсивность окраски усиливается. Изменение соотношения HInd и Ind- сопровождается визуальными изменениями в определенном диапазоне значений pH, что позволяет судить о положения равновесия и, следовательно, определять pH:
c(Ind-) pH= pKa+lg ----------- c(HInd), где рКа- силовой показатель индикатора. Сущность фотоэлектроколориметрического метода определения рН заключается в измерении оптической плотности (Ах) испытуемого раствора с индикатором и раствора, в котором добавленный индикатор полностью ионизирован и имеет максимальную интенсивность окраски, т.е. максимальную оптическую плотность (Аmax).
Выполнение эксперимента: 1. Выбирают одноцветный индикатор для измерения рН. 2. Готовят колориметр КФК-2 к работе. 3. Готовят растворы для фотометрирования. 4. Измеряют оптическую плотность анализируемого раствора. 5. Измеряют оптическую плотность раствора индикатора, в котором он полностью ионизирован. 6. Рассчитывают степень ионизации индикатора в исследуемом растворе. 7. Рассчитывают рН исследуемого раствора.
Экспериментальные данные Приблизительное значение рН _____________ Выбранный индикатор ____________________________ Светофильтр ___________________ Значения оптической плотности: Ах = ______________ Аmax = ________________
Обработка результатов эксперимента. 1. Рассчитывают степень ионизации индикатора α в исследуемом растворе, для чего используют соотношение: α =Ах/Аmax. 2. Для расчета рН используют уравнение: рКа+ lg α рН= ----------- 1- α Расчеты: * В Выводе указывают значение рН исследуемого раствора, относительную ошибку. Выводы
Дата __________ Занятие ___________
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 188; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.9.115 (0.013 с.) |