
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хвильова природа електрона. Електронні хмари
У 20-х рр. ХХ ст. завдяки роботам де Бройля, Шредінгера, Гейзенберга та інших вчених були розроблені основи хвильової теорії про двоїсту корпускулярно-хвильову природу світлового випромінювання. Ейнштейн довів, що випромінювання є потоком неподільних матеріальних частинок (фотонів), енергія яких визначається рівнянням Планка. Із рівнянь Планка (E = h n) і Eйнштейна (E = mc 2) випливає, що h n= mc 2. Враховуючи, що n=с/l і швидкість руху фотона v дорівнює швидкості світла с, одержимо основне рівняння хвильової механіки – рівняння де Бройля:
Із цього рівняння випливає, що частинці масою m, яка рухається із швидкістю v, відповідає хвиля довжиною l. Рівняння (11) можна застосовувати для ха-рактеристики руху не лише фотона, а й інших матеріальних мікрочастинок: електрона, нейтрона, протона тощо. Отже, електрон одночасно є і частинкою, і хвилею. У 1925 р. Гейзенберг запропонував принцип невизначеності, згідно з яким не можна одночасно встановити точне місцезнаходження електрона в просторі та його швидкість, або імпульс. Нове уявлення про електрон примусило відмовитись від прийнятої раніше моделі атома, за якою електрон рухається по певних колових або еліптичних орбіталях. Електрон може знаходитися в будь-якій частині простору, який оточує ядро атома, однак ймовірність його місцезнаходження в тій чи іншій частині атома неоднакова. Рух електрона має хвильовий характер, тому квантова механіка описує цей рух в атомі за допомогою хвильової функції y, яка набуває різних значень у різних точках атомного простору. Відомо, щоб знайти точку в просторі, треба визначити її координати x, y, z, що математично записується залежністю y= f (x, y, z). Оскільки рух електрона хвилеподібний, визначення хвильової функції зводиться до знаходження амплітуди електронної хвилі. Рух електронної хвилі кількісно характеризується амплітудою y, яку можна обчислити з диференціального рівняння Шредінгера, що пов’язує хвильову функцію y з потенціальною і повною енергією електрона. Для одноелектронного атома гідрогену рівняння Шредінгера має такий вигляд:
де m – Для атомів з кількома електронами застосовують наближене рівняння Шредінгера. Треба зазначити, що допустимі розв’язки рівняння (12) можливі тільки для певних дискретних значень енергії електрона. Кожній із функцій y1, y2, y3,..., yn, які є розв’язками хвильового рівняння, відповідає певне значення енергії Е 1, Е 2, Е 3,..., Е n.
За рівнянням (12) можна обчислити y-амплітуду електронної хвилі (хвильову функцію). Квадрат амплітуди y2 виражає ймовірність місцезнаходження електрона в певній точці атомного простору, а величина y2 d V – ймовірність місцезнаходження електрона в елементі об’єму d V. Як модель стану електрона в атомі у квантовій механіці прийнято уявлення про електронну хмару, густина відповідних ділянок якої пропорційна ймовірності перебування там електрона. Електрон ніби “розмазаний” навколо ядра по сфері, віддаленій від нього на певну відстань. Одна з можливих форм електронної хмари атома показана далі (рис. 9).
няння. Тому можна вважати, що хвильова функція, яка є розв’язком рівняння Шредінгера, називається орбіталлю. Отже, ядро атома оточене електронними хмарами. Основні характеристики, які визначають рух електрона навколо ядра, - це його енергія і просторові особливості відповідної йому орбіталі. Квантові числа Згідно з квантово-механічною теорією стан електрона в атомі характеризується значеннями чотирьох квантових чисел: n – головного, l – орбітального, ml – магнітного, s – спінового. Головне квантове число n. Основною характеристикою електрона, який обертається навколо ядра, є його енергія. У реальному атомі енергія електрона квантована, тобто набуває не будь-яких, а певних дискретних значень, що відповідають теорії квантів. Перехід електрона з одного квантового стану в інший пов’язаний зі стрибкоподібною зміною його енергії.
Головне квантове число визначає радіус рівня (середню відстань від ядра до ділянки підвищеної електронної густини) або загальну енергію електрона на певному рівні. Воно має додатні цілочислові значення1,2,3…¥. Найменшу енергію електрон має при n =1. Квантовий стан атома з найменшою енергією Е називається основним. Зі збільшенням значення n загальна енергія електрона збільшується. Квантовий стан атома з більшими значеннями енергії Е 2, Е 3,..., Е n називається збудженим. Електрон в основному стані зв’язаний із ядром найміцніше; у збудженому - зв’язок послаблюється. Стан електрона, який характеризується певним значенням головного квантового числа, називають енергетичним рівнем. Для енергетичних рівнів електрона в атомі, що відповідають різним значенням n, прийняті позначення великими латинськими літерами: Головне квантове число 1 2 3 4 5 6 7 Енергетичні рівні K L M N O P Q Максимальна кількість енергетичних рівнів, яку може мати атом в основному стані, відповідає номеру періоду, у якому розміщений певний хімічний елемент. Щоб перевести електрон із нижчого енергетичного рівня на вищий, необхідна енергія. Цією величиною і визначається енергія зв’язку Е зв електрона, вона обернено залежить від квадрата головного квантового числа:
Головне квантове число визначає розміри електронної хмари. Квантові переходи електрона відповідають стрибкоподібній зміні середнього розміру електронної хмари: зменшення енергії зв’язку електрона з ядром пов’язане зі збільшенням об’єму хмари і навпаки. Згідно з квантово-механічними обчисленнями радіуси з найбільшою імовірністю місцезнаходження електрона в атомі гідрогену дорівнюють 0,053 нм (n =1), 0,212 нм (n =2), 0,477 нм (n =3) і т.д. Значення цих радіусів відносяться як квадрати простих чисел (головного квантового числа), тобто 12:22:32 і т.д. Отже, максимальні електронні густини в атомі водню зосереджені на таких відстанях від ядра, які відповідають радіусам орбіталей у теорії Бора. Однак узгоджені висновки двох теорій (теорії Бора і квантово-механічної) одержані лише для атома гідрогену, але й вони мають різне трактування. Орбітальне квантове число l. Під час розгляду через спектроскоп із високою роздільною здатністю лінійчастих спектрів, які відповідають переходу електрона з одного енергетичного рівня на інший, видно, що вони переважно складаються з кількох близько розміщених окремих ліній. Така тонка структура спектрів (мультиплетність) указує на різні квантові стани електронів на певному енергетичному рівні, що зумовлено різною формою електронних орбіталей. Отже, основні енергетичні рівні складаються з певного числа енергетичних підрівнів, які й проявляються в тонкій структурі спектрів. Для характеристики енергії електрона на підрівні, або форми електронних орбіталей, введено орбітальне квантове число l,яке називається також азимутальним квантовим числом. Воно дорівнює значенню орбітального моменту кількості руху електрона. Орбітальне квантове число може мати значення від 0 до n -1. Кожному значенню l відповідає певний підрівень. Енергетичні підрівні позначаються цифрами й маленькими латинськими літерами:
Орбітальне квантове число 0 1 2 3 Енергетичні підрівні s p d f Можлива кількість підрівнів для кожного енергетичного рівня дорівнює номеру рівня, тобто величині головного квантового числа. Так, на першому енергетичному рівні, що характеризується головним квантовим числом n = 1, може бути лише один підрівень з орбітальним квантовим числом l = 0. На другому енергетичному рівні (n = 2) можуть бути два підрівні, яким відповідають орбітальні квантові числа l = 0;1. Третій енергетичний рівень (n = 3) має три підрівні з відповідними їм орбітальними квантовими числами 0;1;2. На четвертому енергетичному рівні (n = 4) можуть бути чотири підрівні, кожен із яких має своє значення орбітального квантового числа: 0;1;2;3. Відповідно до літерних позначень енергетичних підрівнів електрони, які знаходяться на них, називаються s -, p -, d -, f -електронами. На першому енергетичному рівні можуть знаходитись лише s-електрони; на другому – s - і p -електрони; на третьому – s -, p - і d -електрони. При певному значенні головного квантового числа n найменшу енергію мають s -електрони, потім - p -, d - і f -електрони. Відповідно до квантово-механічних розрахунків s -орбіталі мають форму кулі (сферичну симетрію), p -орбіталі – форму гантелі, d - і f -орбіталі – складніші форми. Під формою орбіталі треба розуміти таку просторову геометричну модель, у межах якої перебування електрона найімовірніше. Форми граничних поверхонь s -, p - і d -орбіталей наведені на рис. 10.
Магнітне квантове число ml.
себе подібно до магніту і тому характеризується не лише орбітальним, а ще й магнітним моментом. Енергетичні зміни електронів, які при цьому відбуваються, можна пояснити різним розміщенням електронних орбіталей у просторі одна відносно одної.
Просторове розміщення електронних орбіталей відносно направленості магнітного поля характеризується третім квантовим числом ml, яке називається магнітним. Магнітне квантове число може мати цілочислові значення (додатні й від’ємні) від + l до – l. Отже, число значень магнітного квантового числа залежить від орбітального квантового числа і вказує, скільки може бути орбіталей з певним значенням l. Так, для s -електронів можливе лише одне значення ml =0(2×0+1=1); для р -електронів (l= 1) - три значення ml (-1;0;+1); для d -електронів (l =2) магнітне квантове число може мати п’ять значень (-2;-1;0;+1;+2); для f -електронів (l= 3) – сім значень (-3;-2;-1;0;+1;+2;+3). Певному значенню l відповідає (2 l + 1) можливих значень магнітного квантового числа.Орбіталі з однаковою енергією називаються виродженими,тому р -стан вироджений трикратно, d -стан – п’ятикратно, а f -стан – семикратно. На відміну від кулястої s -орбіталі p -, d - і f -орбіталі в просторі мають певний напрямок (рис. 10). За характером орієнтації в просторі р -орбіталі позначають рx , py, pz, які витягнуті відповідно вздовж осей xx¢, yy¢, zz¢,. Напрям d -орбіталей не тільки збігається з осями координат, а й лежить між ними: d -орбіталі, орієнтовані вздовж осей координат, позначають dx2-y2 (витягнуті вздовж осей xx¢ та yy¢) і dz2 (витягнуті вздовж осі zz¢); d -орбіталі, орієнтовані між осями координат, позначають d xy, d yz, d xz (розташовані по бісектрисах між осями); f -орбіталі мають складнішу форму. Слід зазначити, що кожну орбіталь іноді зображують як енергетичну (квантову комірку у вигляді квадрата. Для s -електронів може бути лише одна орбіталь або одна енергетична комірка c; для р -електронів – три ccc; для d -електронів – п’ять ccccc; для f -електронів – сім ccccccc. Число енергетичних комірок визначається магнітним квантовим числом. Спінове квантове число s. На основі вивчення тонкої структури атомних спектрів установлено, що стан електронів у атомі залежить не тільки від обертання навколо ядра, яке визначається квантовими числами n, l, ml, а й від їх власного руху – спіну. Спрощено спін (від англ. spin – крутіння, обертання) можна уявити як рух електрона навколо своєї осі. Цей рух характеризується спіновим квантовим числом s, яке може мати тільки два значення +1/2 або –1/2. Спін зображують стрілочками: , ¯. Спіни електронів, напрямлені в один бік, називаються паралельними, а в протилежні – антипаралельними. Принцип Паулі Значення чотирьох квантових чисел характеризують сукупність складних рухів електронів у атомі, але не дають повного уявлення про розподіл електронів у ньому. На основі аналізу атомних спектрів і врахування положення елементів у періодичній системі в 1925 р. фізик Паулі сформулював принцип, який дає змогу визначити такі комбінації квантових чисел, які відповідають реальному розподілу електронів у атомі. Згідно з принципом Паулі, в атомі не може бути двох електронів з однаковими значеннями всіх чотирьох квантових чисел. Наприклад, два електрони, які мають однакові значення трьох квантових чисел m,l і n, відрізняються значенням четвертого квантового числа s. Суть принципу Паулі полягає в тому, що одну орбіталь, яка характеризується певними значеннями n, l і m, можуть займати не більше ніж два електрони з антипаралельними спінами.
Розподіл електронів на енергетичних рівнях і підрівнях записується так: великою арабською цифрою позначається номер енергетичного рівня. Маленькими латинськими літерами – підрівні, а число електронів на підрівні – маленькою арабською цифрою у верхньому правому індексі. Наприклад, розподіл електронів на третьому енергетичному рівні можна записати: 3 s 23 p 63 d 10.
|
|||||||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 260; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.42.168 (0.025 с.) |
 . (11)
. (11)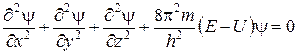 , (12)
, (12) маса електрона; h – стала Планка; Е – повна енергія електрона; U – потенціальна енергія електрона.
маса електрона; h – стала Планка; Е – повна енергія електрона; U – потенціальна енергія електрона. Максимальна електронна густина відповідає найбільшій імовірності місцезнаходження електрона, тобто визначається величиною y2. Очевидно, чим міцніший зв’язок електрона з ядром, тим електронна хмара менша за розміром і компактніша за розподілом заряду.
Максимальна електронна густина відповідає найбільшій імовірності місцезнаходження електрона, тобто визначається величиною y2. Очевидно, чим міцніший зв’язок електрона з ядром, тим електронна хмара менша за розміром і компактніша за розподілом заряду. Дж.
Дж. Стан електрона в атомі, що відповідає певним значенням n і l, записують так: спочатку цифрою позначають головне квантове число, а потім буквою – орбітальне квантове число. Наприклад, позначення 3 s відповідає електрону, який характеризується головним квантовим числом n = 3 і орбітальним квантовим числом l = 0 (орбіталь має форму кулі); 4 р означає, що електрон характеризується головним квантовим числом n = 4 і орбітальним р = 1 (орбіталь має форму гантелі).
Стан електрона в атомі, що відповідає певним значенням n і l, записують так: спочатку цифрою позначають головне квантове число, а потім буквою – орбітальне квантове число. Наприклад, позначення 3 s відповідає електрону, який характеризується головним квантовим числом n = 3 і орбітальним квантовим числом l = 0 (орбіталь має форму кулі); 4 р означає, що електрон характеризується головним квантовим числом n = 4 і орбітальним р = 1 (орбіталь має форму гантелі).


