
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Атомно-молекулярне вчення. Класифікація неорганічних сполукСтр 1 из 20Следующая ⇒
ВСТУП Навчальний процес повинен не лише забезпечувати фундаментальну наукову підготовку студентів, але й прищеплювати їм навички самостійної роботи, стимулювати потяг до безперервного поповнення знань. У підготовці майбутніх технологів харчових виробництв винятково важлива роль належить курсу за-гальної хімії. Під час його засвоєння в студентів розвивається діалектичний спосіб мислення, здатність аналізувати явища та на молекулярному рівні розуміти процеси, розширюється світогляд, поглиблюються наукові уявлення про матерію, будову та властивості речовин, формується база для подальшого опанування фахових дисциплін. Загальна хімія - це методологічна основа для оволодіння студентами-технологами харчових виробництв спеціальними дисциплінами. Правильна організація харчування потребує знань хімічного складу харчової сировини і готових харчових продуктів, уявлень про способи їх отримання, про перетворення, які відбуваються в ході їх добування та кулінарної обробки. Під час виробництва харчових продуктів має місце складний комплекс біохімічних, мікробіологічних, фізико-хімічних процесів. Розуміння їх суті можливе лише за умови опанування основ загальної хімії. Однією з причин недостатньої пізнавальної активності студентів є відсутність науково обґрунтованих, створених з урахуванням профілю майбутніх спеціалістів, підручників, навчальних посібників. Існуючі видання не розраховані на самостійне вивчення матеріалу, громіздкі, перевантажені здебільшого фактами, а не тлумаченням законів, які ці факти зумовлюють. Даний посібник допоможе студентам самостійно опрацьовувати програмний матеріал. У виданні подана загальна характеристика основних понять і законів хімії; викладені закономірності перебігу хімічних реакцій із залученням елементів термодинаміки та кінетики, особливості взаємодії в розчинах; розглянуті питання будови речовини. Посібник створений для роботи за кредитно-модульною системою організації навчального процесу. Кожен модуль містить теоретичний матеріал, приклади застосування теоретичних положень і розв’язування задач, окрім того, завдання, вправи й задачі для самоконтролю. Обрана авторами система структурування матеріалу сприятиме кращому засвоєнню теоретичних основ дисципліни, свідомому підходу до підготовки. Застосовані способи подання інформації лаконічні, зручні, відомі студентам, вони легко відтворюються під час пригадування. Зразки виконання типових практичних завдань відповідають стандартним вимогам і призначені для того, щоб студенти не тільки опанували способи розв’язання задач і виконання практичних вправ, але й навчилися правильно оформляти свою роботу.
Модуль 1 АТОМНО-МОЛЕКУЛЯРНЕ ВЧЕННЯ. КЛАСИФІКАЦІЯ НЕОРГАНІЧНИХ СПОЛУК Ще за часів давньогрецьких філософів вважали, що речовини складаються з дуже маленьких неподільних часток – атомів. Однак експериментального підтвердження того не було. Наукові уявлення про атом виникли значно пізніше, унаслідок розвитку експериментальної фізики й хімії. У XVII ст. англійський вчений Бойль, хімічні уявлення якого грунтувалися на атомістиці, пояснював усі хімічні зміни об’єднанням і роз’єднанням атомів. У XVIII ст. М. Ломоносов сформулював основні положення атомно-молекулярного вчення. Кількісна база атомно-молекулярного вчення була створена на основі праць багатьох вчених наприкінці XVIII – на початку XIX ст. Англійський вчений Дальтон сформулював закон кратних відношень і вперше ввів поняття атомної маси. Французький хімік Гей-Люссак відкрив закон об’ємних відношень. Італійський вчений Авогадро в 1811 р. запропонував визначення молекули як здатної до самостійного існування найменшої частки речовини, що складається з атомів. Він також відкрив закон, який отримав його ім’я. На початку XIX ст. французькі вчені Пруст і Бертоллє визначили й розмежували поняття хімічна речовина і механічна суміш. Пруст у 1808 р. сформулював закон сталості складу речовин. Чітко охарактеризував поняття атом і молекула у 1858 р. італійський хімік Канніццаро. Усі ці визначення були прийняті в 1860 р. на Першому міжнародному конгресі хіміків у м. Карлсруе. Так було створено атомно-молекулярне вчення, яке в подальшому підтвердилось, розвинулось відкриттям у 1869 р. Д.І. Менделєєвим періодичного закону хімічних елементів, розробкою в 1860 р. О.М. Бутлеровим теорії хімічної будови органічних речовин, оголошенням у 1873 р. голландським вченим Ван-дер-Ваальсом принципу безперервності рідкого й газоподібного станів речовин, працями голландського фізико-хіміка Вант-Гоффа в галузі хімічної кінетики.
ОСНОВНІ ПОНЯТТЯ ТА ЗАКОНИ ХІМІЇ Ключові положення атомно-молекулярного вчення 1.Речовини мають дискретну будову. Вони складаються з часток (структурних елементів – молекул, атомів чи іонів). 2.Частки речовини безперервно безладно рухаються. 3.Між складовими частками речовини діють сили взаємного притягання і відштовхування. 4.Між складовими частками речовини є проміжки. 5.Молекули складаються з атомів. 6.Молекули зберігаються під час фізичних явищ і руйнуються під час хімічних. 7.Атоми зберігаються під час хімічних реакцій – при цьому відбувається їх перегрупування, що зумовлює утворення нових речовин. 8.Різноманітність речовин пов’язана з різним сполученням атомів. Поняття загальної хімії Ключовими поняттями хімії є молекула, атом, хімічний елемент, речовина. Молекула (від латин. moles – маса) - це здатна до самостійного існування найменша частка речовини, яка зберігає властивості цієї речовини. Атом (від грец. atomos – неподільний) – це хімічно неподільна електронейтральна частка речовини, що складається з позитивно зарядженого ядра й негативно заряджених електронів. Хімічний елемент – це сукупність атомів з однаковими зарядами ядер. Речовина – це вид матерії, що характеризується певними фізичними та хімічними властивостями за даних умов. За умов сталих тиску й температури об'єми реагуючих між собою газів, а також об'єми газоподібних продуктів реакції відносяться як невеликі ці лі числа. Наприклад, у реакції N2 + 3H2 = 2NH3
V(N2): V(H2): V(NH3) = 1: 3: 2. 4. Закон Авогадро сформулював італійський учений Авогадро в 1811 р.: ПІДСУМКИ Необхідно зрозуміти 1. На підставі закону збереження маси речовин можна проводити обчислення кількісних відношень реагентів та продуктів реакції. 2. Розрахунки кількостей речовин-реагентів та продуктів реакції можна значно спростити, якщо застосовувати закон еквівалентних відношень. 3. Закон об’ємних співвідношень дозволяє обчислити об’ємні відношення газоподібних речовин, що беруть участь у хімічній реакції чи утворюються під час її перебігу. Треба вміти 1.Визначати відносні молекулярні та молярні маси речовин; кількість частинок у певній кількості речовини, масі речовини, об’ємі газу; об’єм певної маси або кількості речовини газу за нормальних умов; відносну густину газу за іншим газом; масову частку елемента у сполуці за її формулою. 2.Встановлювати хімічну формулу речовини за масовими частками елементів, що входять до її складу. 3.Визначати молярні маси газоподібних речовин за молярним об’ємом, відносною густиною, рівнянням Менделєєва-Клапейрона. 4.Обчислювати за рівняннями хімічних реакцій масу, об’єм, кількість речовини за відомою масою, кількістю речовини одного з реагентів чи продуктів реакції. 5.Здійснювати перехід від нормальних до експериментальних умов на підставі газових законів. 6.Обчислювати молярні маси еквівалентів різних речовин.
7.Проводити розрахунки на основі закону еквівалентних відношень. Слід запам’ятати
M екв(Н2) = М (1/2H2) = М екв(О2) = М (1/4О2) = M f (AaBb) =
Рис. 1. Класифікація неорганічних сполук
Метали складаються з атомів хімічних елементів – металів (натрій Na, калій К, залізо Fe, магній Mg, срібло Ag тощо). Неметали складаються, як правило, з молекул хімічних елементів – неметалів (хлор Cl2, сірка S8, фосфор P4, кисень О2, азот N2 тощо). Метали та неметали мають різні хімічні властивості, що пояснюється електронною будовою їх атомів. Із властивостями цих простих сполук ми ознайомимося пізніше. Складні речовини поділяються на такі класи: оксиди, основи, кислоти, солі. Поділ складних речовин на класи заснований на схожості хімічних властивостей. Оксиди Оксидами називаються речовини, що складаються з двох елементів, одним з яких є Оксиген зі ступенем окиснення (–2). В оксидах атоми Оксигену сполучаються з атомами інших елементів і не зв’язані між собою: C=O, O=C=O, O=B-O-B=O Сполуки елементів з Оксигеном, у молекулах яких є зв’язок між атомами Оксигену, називають пероксидами (Н2О2 – гідроген пероксид Н-О-О-Н). Пероксиди металів належать до класу солей, гідроген пероксид виявляє кислотні властивості. Номенклатура. Загальне правило: у назві будь-якої складної неорганічної сполуки – спочатку вказують катіон, а потім аніон. Назви оксидів за новою систематичною номенклатурою можна побудувати двома способами: 1)за допомогою числових префіксів (N2O5 – динітроген пентаоксид, Sb2O3 – дистибій триоксид, Na2O – динатрій оксид); 2)вказуючи ступінь окиснення елемента у формі катіона (N2O5 – нітроген(V) оксид, Sb2O3 – стибій(ІІІ) оксид, Na2O – натрій оксид). Якщо елемент утворює лише один оксид або єдиний оксид у звичайній валентності, то назва його може складатися лише з назви елемента та слова “оксид”: BaO – барій оксид, B2O3 – бор оксид, К2О – калій оксид. Сполуки Оксигену з більш електронегативним елементом Флуором треба називати флуоридами: OF2 – оксиген флуорид, O2F2 – діоксиген дифлуорид. За хімічними властивостями оксиди поділяються на солетворні та несолетворні. Оксиди, які не утворюють солі, називаються несолетворними – NO – нітроген(ІІ) оксид, N2O – нітроген (І) оксид, SiO2 – силіцій(ІV) оксид. Несолетворних оксидів мало. Оксиди, які під час хімічних реакцій утворюють солі, є солетворними. До них належить більшість оксидів. Солетворні оксиди поділяються на основні, кислотні та амфотерні.
Основні оксиди. Основними називають оксиди, гідрати яких є основами. До таких належать лише оксиди металів: Магнію, Лантану, лужних (Li, Na, K, Rb, Cs), лужноземельних (Ca, Sr, Ba, Ra), а також усіх інших металів, нижчих ступенів окиснення (Cr(+2), Mn(+2), Pb(+2)). Кислотні оксиди. Кислотними називаються оксиди, гідрати яких є кислотами. У зв’язку з цим кислотні оксиди ще називаються ангідридами кислот. До них належать оксиди неметалів, а також металів, які проявляють вищі ступені окиснення: SO2, SO3, CO2, CrO3, Mn2O7. Амфотерні оксиди. Амфотерними називаються оксиди, які залежно від умов виявляють властивості основних і кислотних оксидів. До амфотерних належать оксиди деяких металів головних підгруп (Берилію, Алюмінію), а також оксиди багатьох металів побічних підгруп періодичної системи елементів з проміжними ступенями окиснення: BeO, Al2O3, ZnO, MnO2, Fe2O3. Характеристика оксидів наведена далі (табл. 2). Таблиця 2. Фізичні та хімічні властивості оксидів
Основи Основами називають сполуки, які складаються з атома металу чи амонійної групи (NH4) та однієї чи декількох гідроксогруп – ОН -. З погляду теорії електролітичної дисоціації основи – це електроліти, які під час дисоціації утворюють гідроксид – аніони. Наприклад: NaOH, Ca(OH)2, Mg(OH)2, La(OH)3. Cлід зазначити, що ОН - - це гідроксид-іон, заряд його дорівнює (–1). Число гідроксид-іонів у основі визначається ступенем окиснення металу. Номенклатура. Назви основ та амфотерних гідроксидів утворюють з назви катіона і слова “гідроксид”, вказуючи ступінь окиснення елемента або додаючи відповідні числові префікси. Якщо ж метал утворює тільки один гідроксид, то ступінь його окиснення не вказують: Fe(OH)2 – ферум(ІІ) гідроксид, або ферум дигідроксид; Аl(OH)3 – алюміній гідроксид, або алюміній тригідроксид.
Кислотність. Число гідроксогруп, зв’язаних з атомом металу, визначає кислотність основи. Наприклад LiOH, NaOH – однокислотні основи; Са(OH)2, Ba(OH)2 – двокислотні; Cr(OH)3, Bi(OH)3 – трикислотні. Фізичні властивості. Основи - це тверді речовини. За розчинністю у воді вони поділяються на дві групи: розчинні (луги) та нерозчинні. Лугами є гідроксиди лужних металів (елементів головної підгрупи І групи) і лужноземельних (елементів головної підгрупи ІІ групи, крім берилію та магнію). Луги – це іонні сполуки. У вузлах кристалічних ґраток твердих лугів знаходяться іони металів і гідроксид-іони. В інших основах хімічний зв’язок має іонно-ковалентний характер. Хімічні властивості основ. Характерні для основ хімічні реакції наведені в табл. 3. Лише розчинні у воді основи – луги - як сильні електроліти у водних розчинах практично повністю дисоціюють з утворенням гідроксид-іонів: NaOH«Na+ + OH-. Тому вони мають деякі загальні властивості, обумовлені наявністю гідроксид-іонів, наприклад впливають на забарвлення багатьох кислотно-основних індикаторів. Нерозчинні у воді основи як слабкі електроліти не змінюють колір індикаторів, не взаємодіють з кислотними та амфотерними оксидами, а також солями. Дуже слабко дисоціюють на іони. Невеликої кількості гідроксид-іонів, які містяться в насичених розчинах основ, недостатньо для забезпечення перебігу зазначених реакцій. Нерозчинні у воді основи дають тільки дві реакції. Амфотерні гідроксиди – це гідроксиди, які виявляють основні та кислотні властивості залежно від умов, тобто від природи другого компонента, який бере участь у кислотно-основній взаємодії. До амфотерних гідроксидів належать гідроксиди деяких металів головних підгруп (Берилію, Алюмінію), а також багатьох металів побічних підгруп періодичної системи елементів проміжних ступенів окиснення: Be(OH)2 , Al(OH)3, Zn(OH)2,Cr(OH)3. Тип зв’язку між атомами металу та гідроксогрупами – ковалентний. Усі амфотерні гідроксиди – слабкі електроліти. Оскільки полярність ковалентних зв’язків Ме–О і О–Н у їх молекулах близька, амфотерні гідроксиди можуть дисоціювати і як основа, і як кислота:
Al(OH)3 «[Al(OH)2]+ + OH- «[Al(OH)]2+ + 2OH- «Al3+ + 3OH-;
Амфотерні гідроксиди не змінюють забарвлення індикаторів. Кислоти Кислотами називають сполуки, до складу яких входять атоми Гідрогену, здатні заміщуватися атомами металу. Згідно з теорією електролітичної дисоціації кислоти – це електроліти, які під час дисоціації утворюють тільки один вид позитивно заряджених іонів - катіони Гідрогену. Номенклатура. Назву кислоти можна визначити за латинською назвою кислотного залишку. До основи назви кислотного залишку додають закінчення: для безоксигенових кислот - ідна чи - идна; для оксигеновмісних кислот - ітна чи - итна (кислотоутворювальний елемент проміжного ступеня окиснення); - атна (кислотоутворювальний елемент вищого ступеня окиснення). Наприклад: HCl – хлоридна, H2S – сульфідна, HNO2 – нітритна, HNO3 – нітратна. Кислоти класифікують за різними критеріями (рис. 2).
Рис. 2. Схема класифікації кислот
Оксигеновмісні кислоти є гідратами (продуктами сполучення з водою) оксидів неметалів, а також оксидів деяких металів вищих ступенів окиснення (+5, +6, +7). Наприклад, карбонатна кислота Н2СО3 - продукт сполучення з водою СО2, сульфатна кислота H2SО4 - SO3, хроматна кислота Н2СrО4 - СrО3. Число атомів Гідрогену кислоти, здатних заміщуватися атомами металу з утворенням солі, визначає основність кислоти. Так, НСl, НВr, HNO3, СН3СООН - одноосновні кислоти; H2S, H2SO4, Н2СO3, Н3РO3 — двохосновні; Н3РО4, H3AsO4 - трьохосновні. Негативні іони, які утворюються в результаті відриву від молекули кислоти одного або кількох іонів Гідрогену, називаються кислотними залишками. Значення негативного заряду іона кислотного залишку визначається числом іонів Гідрогену, що відірвалися. Наявність атомів Гідрогену в кислотних залишках позначається словом гідроген-, якщо треба – з відповідним префіксом. Наприклад, HSO4- – гідрогенсульфат, H2PO4- – дигідрогенфосфат. Фізичні властивості. Кислоти можуть бути твердими (боратна Н3ВО3, силікатна H2SiО3) або рідкими (сульфатна H2SO4, нітратна HNО3). Більшість із них добре розчиняються у воді. Кислотами є також водні розчини газоподібних водневих сполук деяких неметалів (НСl, НВr, H2S, HCN, HCNS). У молекулах кислот атоми Гідрогену зв'язані з кислотними залишками ковалентним полярним зв'язком. Хімічні властивості. 1. Кислоти у водних розчинах дисоціюють на іони, сильні кислоти - повністю, слабкі - мало: НСl«Н+ + Сl-; H2SO4 «Н+ + HSO4-; Н3РО4 «Н+ + Н2РO4-. Кислоти мають деякі загальні властивості, обумовлені наявністю іонів Гідрогену Н+. Так, вони змінюють забарвлення багатьох індикаторів (табл. 4).
Таблиця 4. Інтервали переходу індикаторів
2. Кислоти реагують з основами. Взаємодія кислоти з основою, в результаті якої утворюється сіль і вода, називається реакцією нейтралізації: NaOH + HCl ® NaCl + H2O. Реакції між нерозчинними основами та амфотерними гідроксидами й кислотою теж є реакціями нейтралізації. За цих умов амфотерний гідроксид виявляє основні властивості. Якщо в реакції нейтралізації беруть участь багатокислотні основи або багатоосновні кислоти, можуть утворюватися середні, кислі та основні солі: Fе(ОН)3 + НС1 ® Fe(OH)2Cl + H2O; Fe(OH)3 + 3HCl ® FeCl3 + 3Н2О; NaOH + H2SO4 ® NaHSO4 + H2O. 3. Кислоти взаємодіють з основними та амфотерними оксидами з утворенням солі та води: СаО + 2HNO3 ® Ca(NO3)2 + Н2О; Fе2O3 + 6НNО3 ® 2Fe(NO3)3 + 3Н3O. 4. Кислоти реагують з металами. У результаті реакції утворюється сіль і виділяється водень: Zn + Н2SO4(розв) ® ZnSO4 + H2. Метали, які в ряді стандартних електродних потенціалів знаходяться ліворуч від водню, витісняють його з кислот, а розташовані праворуч (Cu, Hg, Ag, Аu, Pt) — не витісняють. 5. Кислоти взаємодіють із солями. При цьому можуть утворюватися такі сполуки: а) нова кислота та сіль (середня або кисла): 2NaCl(cyx) + Н2SO4(конц) ® Na2SO4 + 2НС1; 2NaNO3(cyx) + Н2SO4(конц) ® Na2SO4 + 2HNO3; FeS + 2HCl ® FeCl2 + H2S. Якщо кислота, яка утворюється, є нестійка, вона може розкладатися з утворенням кислотних оксидів: Na2CO3 + 2НСl ® 2NaCl + Н2О + СO2. б) кисла сіль: Na2S + H2S ® 2NaHS; СаСО3 + Н2СО3 ® Са(НСО3)2. в) кілька солей і вода: NaA1O2 + 4НСl ® NaCl + АlСl3 + 2Н2O; 2NaAl(OH)4 + 4H2SO4 ® Na2SO4 + A12(SO4)3 + 8H2O. 6. Під час нагрівання оксигеновмісні кислоти розкладаються на воду та кислотний оксид: H2SO4 4НNO3 Солі Солі - це продукти заміщення гідрогену кислоти металом або продуктами обміну гідроксогрупи гідроксидів металів на кислотні залишки: H2SO4 + Zn = ZnSO4 + Н2; Кислота Сіль NaOH + НСl = NaCl + Н2О. Основа Сіль З позиції теорії електролітичної дисоціації солі – це електроліти, які під час дисоціації утворюють катіони залишку основи та аніони кислотного залишку. Номенклатура. Назва солі складається з назви металу в називному відмінку (римською цифрою зазначається валентність металу, якщо він проявляє їх декілька), та назви кислотного залишку. Наприклад, NaCl – натрій хлорид; розчин СaSO4 – розчин кальцій сульфату; Fe(NO3)2 – ферум(ІІ) нітрат. Фізичні властивості. Солі - це тверді кристалічні речовини. Залишки основ і кислот у солях зв'язані між собою, як правило, іонним зв'язком. Солі мають різний колір і характеризуються неоднаковою розчинністю у воді. Солі бувають середні, кислі, основні (рис. 3).
Рис. 3. Класифікація солей
Середні солі - це продукти повного заміщення Гідрогену кислоти металом або повного обміну гідроксогруп основи на кислотні залишки, наприклад: 2Na + H2SO4 ® Na2SO4 + Н2; Fe(OH)3 + 3НClО4 ® Fе(С1О4)3 + 3Н2O. Прості солі - це солі, до складу яких входить атоми одного металу. Наприклад, Na2SO4, Ca(NO3)2 тощо. Якщо атоми Гідрогену в кислоті заміщуються атомами різних металів, такі солі називаються подвійними. Наприклад, KAl(SO4)2. Коли гідроксогрупи основ обмінюються на різні кислотні залишки, то утворюються змішані солі(наприклад Са(ОСl)Сl). Комплексні солі - це такі продукти, до складу яких входять комплексні іони: К4[Fе(СN)6], Na[Al(OH)4], Na3[Al(OH)6]. Кислі солі - продукти неповного заміщення Гідрогену багатоосновної кислоти металом, наприклад, NaHSО4, Са(НСО3)2. Основні солі - це продукти неповного обміну гідроксогруп багатокислотної основи на кислотні залишки, наприклад: Mg(OH)2 + HCl ® MgOHCl+ Н2O; А1(ОН)3 + НС1 ® А1(ОН)2С1 + Н2O. Хімічні властивості. 1. Солі реагують з лугами або амоній гідроксидом. Унаслідок цього утворюються нові солі (середні, кислі, основні) та гідроксид або основна сіль (залежно від молярних співвідношень реагентів): MgCl2 + NaOH ® Mg(OH)Cl + NaCl; MgCl2 + 2NaOH ® Mg(OH)2+ 2NaCl; NaH2PO4 + NaOH ® Na2HPO4 + H2O. 2. Солі реагують із кислотами. Такі реакції можливі, якщо утворюється осад чи слабкий електроліт. Продуктами цієї взаємодії можуть бути (залежно від молярних співвідношень реагентів) різні сполуки: а) нова кислота і нова сіль: FeS + 2HCl ® FeCl2 + H2S; б) кисла та середня солі: Ca3(PO4)2 + 2H2SO4 ® Ca(H2PO4)2 + 2CaSO4; в) кисла сіль: CaCO3 + CO2 + H2O ® Ca(HCO3)2; г) одна або дві середні солі, основна сіль: Fe(OH)2Cl + HCl ® Fe(OH)C12 + H2O. 3. Солі взаємодіють між собою. Така реакція можлива, якщо утворюється осад. Її продуктами будуть нові солі: CaCl2 + Na2CO3 ® CaCO3¯ + 2NaCl. Середня сіль може реагувати з кислою або основною сіллю одного й того ж металу, якщо між реагентами існує проміжна за складом кисла чи основна сіль, що й буде продуктом реакції: Na3PO4 + NaH2PO4 ® 2Na2HPO4; FeCl3 + Fe(OH)2Cl ® 2FeOHCl2. 4. Солі взаємодіють з металами з утворенням нової солі та металу: CuSO4 + Fе ® FeSO4 + Сu. Кожен метал може витіснити з розчинів солей метали, які знаходяться в ряді стандартних електродних потенціалів після нього, і не витісняє метали, що стоять перед ним: FeSO4 + Сu (реакція не відбувається). Метали, розташовані ліворуч від магнію (К, Ва, Са, Na та ін.), не використовують для витіснення металів із розчинів їх солей, оскільки вони реагують із водою з утворенням водню та лугу. Останній, у свою чергу, взаємодіє із сіллю з утворенням нерозчинного гідроксиду: CuSO4 + 2Na + 2Н2O ® Сu(ОН)2¯ + Na2SO4 + H2. 5. Солі взаємодіють з оксидами (кислотними або амфотерними) під час нагрівання з утворенням солі та кислотного оксиду, більш леткого, ніж вихідний: Na2CO3 + SiO2 ® Na2SiO3 +CO2; 4LiNO3 + 2А12О3 ® 4LiA1O2 + 4NO2 + О2. 6. Солі розкладаються під час нагрівання. Залежно від природи металу та кислоти утворюються різні продукти: СаСО3 2NaNO3 Рис. 4. Генетичний зв’язок між найважливішими Класами неорганічних сполук Наведемо конкретний приклад, запишемо формулу води у вигляді НОН: S Ca ¯ ¯ SO3 + HOH + CaO ¯ ¯ H2SO4 + Ca(OH)2 ¯ CaSO4
Порівнюючи формули кислоти й води, можна зробити висновок, що кислота утворюється заміною гідроксильної групи у воді на кислотний залишок. Аналогічно основа утворюється заміною атома Гідрогену у воді на метал, а сіль — заміною атомів Гідрогену в кислоті на метал або гідроксильної групи в основі на кислотний залишок, або гідроксильної групи води на кислотний залишок, а атома Гідрогену на метал. ПІДСУМКИ Необхідно зрозуміти 1. Усі неорганічні речовини поділяють на прості та складні. 2. До складних речовин належать оксиди, кислоти, основи, солі. 3. Назва складної речовини являє собою назву катіона й аніона. Треба вміти 1. Розрізняти класи неорганічних сполук. 2. Записувати рівняння хімічних реакцій, що характеризують властивості різних класів неорганічних сполук. Слід запам’ятати 1. Визначення класів неорганічних сполук. 2. Хімічні властивості різних класів неорганічних сполук. МОДУЛЬ 2 БУДОВА РЕЧОВИНИ Сучасні поняття елемента, атома, простої речовини, молекули як сукупності зв'язаних між собою атомів сформувалися порівняно недавно. Але атомістична теорія будови матерії - вчення про те, що всі речовини складаються з найдрібніших частинок, - пройшла довгий і важкий шлях. Припущення стародавніх вчених, засновані лише на роздумах, у принципі, не такі вже далекі від нинішніх уявлень: існують певні типи атомів (елементи), які можуть по-різному з'єднуватися один з одним, утворюючи дуже багато речовин зі своєрідними властивостями. Таке вчення було найбільшим досягненням людського розуму. Дуже влучно про це висловився американський фізик, лауреат Нобелівської премії Річард Фейнман. Він зазначив, що якби внаслідок якої-небудь світової катастрофи всі накопичені наукові знання були знищені й до прийдешніх поколінь живих істот надійшла тільки одна фраза, складена з якнайменшої кількості слів, яка б несла найбільшу інформацію, то це була б атомна гіпотеза. Відповідно до неї усі тіла складаються з атомів - маленьких тілець, які перебувають у безперервному русі, притягуються на невеликій відстані, але відштовхуються, якщо одне з них щільніше притиснути до іншого. У одній цій фразі міститься неймовірна кількість інформації про світ, варто лише додати до неї небагато уяви та трохи міркування. До кінця XIX ст. вважали, що атом - найменша частинка простої речовини, він неподільний і незмінний. Це підтверджувалось хімічними реакціями, у яких речовини реагують у певних співвідношеннях (закони стехіометрії). Після завершення формування атомістики на основі неподільності атома виникло питання щодо його внутрішньої структури. Припущення про зв'язок атомів з електричним зарядом дедалі міцніше утверджувалося у свідомості вчених у міру нагромадження нових наукових відкриттів та їх узагальнення. БУДОВА АТОМА Складність будови атома Перші моделі атома
негативно заряджені електрони. Виходячи з розміщення елементів у періодичній системі Д.І.Менделєєва і періодичної зміни їх хімічних властивостей Томсон припустив, що електрони в атомі розміщуються пошарово й хімічні властивості елементів зумовлені зовнішнім шаром електронів. Така модель атома трактувала тільки деякі його властивості (випромінювання, розсіювання, поглинання світла). Багато експериментальних даних, зокрема досліди Резерфорда, модель Томсона пояснити не могла. Для перевірки цієї моделі та більш точного визначення внутрішньої будови атома Резерфорд провів серію дослідів з a-частинками, які утворюються в результаті радіоактивного розпаду. Він спрямував a-частинки, спостерігаючи за їх рухом, на тоненькі металеві пластинки (рис. 7). Учений встановив, що переважна більшість a-частинок проникала крізь металеві пластинки, деякі з них відхилялись під кутом від прямолінійного напряму руху і тільки незначна кількість (1 частинка із 10 000) була відкинута у вихідне положення. Проходження a-частинок через металеву пластинку і відкидання від неї неможливо пояснити з позиції моделі атома Томсона. Справді, a-частинка, яка має подвійний позитивний заряд і значну масу, під час її швидкого руху може бути відкинута у вихідне положення лише тоді, коли зіткнеться зі значно більшим позитивним зарядом. Крім того, проходження великої кількості a-частинок крізь металеву пластинку є доказом того, що атом майже “порожній” і має дискретну будову.
Рис. 7. Схема досліду Резерфорда: 1 – свинцева скринька; 2 – препарат Радію; 3 – пучок a-частинок; 4 – екран; 5 – проміння a-частинок, що відхилилися на невеликі кути або різко змінили напрям руху; 6 – тонка металева пластинка; 7 – a-частинки, які не змінили свій напрямок
На основі своїх дослідів Резерфорд у 1911 р. запропонував ядерну модель атома. Відповідно до неї в центрі атома міститься позитивно заряджене ядро, маса якого майже дорівнює масі атома, навколо ядра рухаються електрони, число яких дорівнює позитивному заряду ядра. Між ядром і електронами взаємодіють електростатичні (кулонівські) сили, зрівноважені відцентровою силою, що виникає внаслідок руху електронів. Якщо сила кулонівського притягання до ядра дорівнює
де m – маса електрона; v – швидкість руху електрона; e – заряд електрона; r – радіус орбіталі, по якій рухається електрон. Досліди з a-частинками дали змогу Резерфорду оцінити величину заряду ядер різних атомів. Результати обчислень показали, що заряд ядра атома чисельно дорівнює порядковому номеру елемента в періодичній системі. Атоми елементів нейтральні, а тому кількість електронів у кожному з них також дорівнює відповідному порядковому номеру елемента. Велике значення у встановленні заряду ядра атома мали дослідження учня Резерфорда англійського фізика Мозлі. Атомні спектри
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 209; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.116.159 (0.175 с.) |

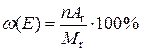 - масова частка елемента в складі сполуки;
- масова частка елемента в складі сполуки;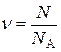 =
= 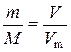 - кількість речовини;
- кількість речовини;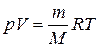 - рівняння Менделєєва-Клапейрона;
- рівняння Менделєєва-Клапейрона;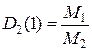 - відносна густина газу 1 за газом 2;
- відносна густина газу 1 за газом 2;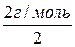 = 1 г/моль – молярна маса еквівалентів водню;
= 1 г/моль – молярна маса еквівалентів водню;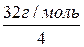 = 8 г/моль – молярна маса еквівалентів кисню;
= 8 г/моль – молярна маса еквівалентів кисню;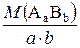 =
= 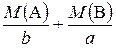 - молярна маса еквівалентів складної речовини;
- молярна маса еквівалентів складної речовини;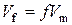 - еквівалентний об’єм;
- еквівалентний об’єм;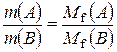 , чи
, чи 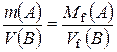 - закон еквівалентних відношень.
- закон еквівалентних відношень. H3AlO3 «3H+ + AlO
H3AlO3 «3H+ + AlO  «HAlO2 + H2O «H+ + AlO
«HAlO2 + H2O «H+ + AlO 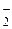 + H2O.
+ H2O.
 4Н2O + SO3;
4Н2O + SO3;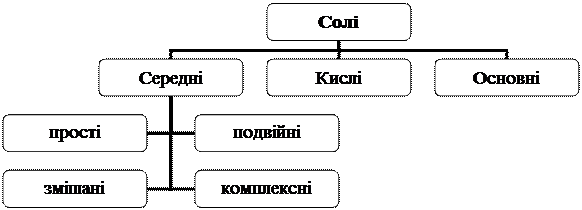
 У ході вивчення катодного випромінювання і радіоактивності виявилося, що до складу атомів елементів входять електрони. Оскільки атоми електронейтральні, то вони повинні мати стільки позитивних зарядів, скільки міститься в них електронів. З’ясуємо, як же розміщуються в атомі електрони й позитивні заряди.
У ході вивчення катодного випромінювання і радіоактивності виявилося, що до складу атомів елементів входять електрони. Оскільки атоми електронейтральні, то вони повинні мати стільки позитивних зарядів, скільки міститься в них електронів. З’ясуємо, як же розміщуються в атомі електрони й позитивні заряди.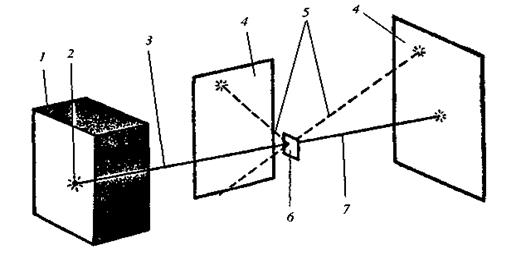
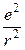 , а відцентрова сила
, а відцентрова сила 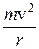 , то
, то


