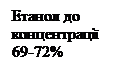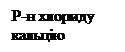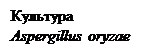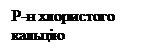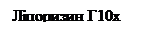Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Стабілізація та стандартизація ферментних препаратів
Стандартизація і стабілізація ферментних препаратів мають велике значення в процесах їхнього виробництва, зберігання і використання. Стандартизацією називають процес отримання препаратів з певною ферментативною активністю. Досить часто ферментативна активність партії готового препарату помітно відрізняється від попередніх. Споживач же повинен отримувати препарат з певною стандартною активністю. Тому на підприємстві на основі тривалого аналізу продукції, що випускається, встановлюють стандартний рівень активності із запасом 20 – 30%. Стандартизація ферментного препарату – доведення активності ферменту до стандартів, відповідно вимогам ДСТУ, ТУ. Для цього використовують різні нейтральні наповнювачі – крохмаль, лактоза. Важливо, щоб наповнювач був стосовно ферменту стабілізатором, а не просто інертною речовиною. Необхідно також враховувати здатність наповнювача до сорбції водних парів. Наприклад, крохмаль та лактоза запобігають зволоженню ферментного препарату, а хлориди калію і натрію сприяють зволоженню, тому у разі їх використання необхідна герметична упаковка ферментного препарату. При змішуванні готового сухого препарату з наповнювачем необхідно, щоб вони мали однаковий ступінь подрібнення і вологість не більше 10 – 12%. Кількість наповнювача можна розрахувати за формулою: S= (a*b)/c - b, де S – кількість наповнювача, необхідна для отримання стандартного за активністю препарату, кг; a – активність вихідного препарату, од.ФА/г; b – кількість вихідного препарату, кг; c – стандартна активність препарату, од.ФА/г. Стандартизація препарату хлористим натрієм і крохмалем в рівних кількостях дозволяє зберігати його без втрат до двох років.
Питання для самоконтролю: 1. Охарактеризуйте процеси підготовки засівного матеріалу і ферментації при одержанні ферментних препаратів. 2. Які переваги має глибинне культивування для отримання ферментів? 3. Які методи стерилізації поживних середовищ Вам відомі? 4. Опишіть процеси попереднього оброблення культуральної рідини і біомаси продуценту. Яке значення вони мають для подальшого виділення ферментів? 5. Проаналізуйте втрати, що можуть виникати при виробництві ферментних препаратів, та запропонуйте методи їх запобігання.
6. Які фізико-хімічні властивості ферментів дозволяють здійснювати їх виділення шляхом осадження органічними розчинниками і солями? 7. Яким чином здійснюється фракціонування ферментів за допомогою органічних розчинників? 8. Які методи дозволяють отримати високо очищені гомогенні ферментні препарати? 9. Які мембранні методи можуть використовуватися для очищення ферментів? 10. Чому ферментні препарати мають бути стандартизовані до їх відправлення споживачу? ОСОБЛИВОСТІ ОДЕРЖАННЯ ОКРЕМИХ ФЕРМЕНТНИХ ПРЕПАРАТІВ Амілази Амілолітичні ферменти гідролізують крохмаль та інші полісахариди, які складаються з амілози та амілопектину, мономернні глюкозні одиниці яких з’єднані a- 1,4 та a-1,6 глікозидними зв’язками. Ці ферменти випускаються промисловістю у великій кількості та знаходять застосування у багатьох галузях. Амілази утворюються багатьма організмами і можуть бути отримані з рослинної та тваринної сировини, але головним джерелом амілаз є мікроорганізми, частіше бактерії, рідше гриби і дріжджі. Амілолітичні ферменти поділяються на екзо- і ендогідролази. a-амілази належать до ендогідролаз, оскільки невпорядковано гідролізують глікозидні зв’язки з утворенням лінійних і розгалужених олігосахаридів як продуктів гідролізу. Решта амілолітичних ферментів є екзодіючими, тобто вони атакують субстрат з нередукуючого кінця з утворенням моно- та олігосахаридів. a-амілази (a-D-1,4 – глюканглюканогідролази, ЕС 3.2.1.1) здійснюють невпорядкований гідроліз внутрішніх a-D-1,4 зв’язків у полімерах глюкози (амілозі та амілопектині), звільнюючи суміш вуглеводів: глюкози, мальтози, олігосахаридів і декстринів. Глюкоза відщеплюється при дії ферменту на кінцеву мономерну одиницю, мальтоза при гідролізі другого глікозидного зв’язку, олігосахариди і декстрини – вкорочені сегменти крохмалю – формуються в результаті невпорядкованого гідролізу внутрішніх глікозидних зв’язків. a-амілази поширені у бактерій, грибів, вищих рослин та тварин. Вони відіграють домінантну роль у метаболізмі вуглеводів, ці ферменти продукуються великою кількістю мікроорганізмів. проте, найширшого застосування набули a-амілази, які виділяють бактерії роду Bacillus.
b-амілази (a-D-1,4- глюканмальтогідролази, ЕС 3.2.1.2) каталізують відщеплення b-мальтози з нередукуючого кінця полі- і олігосахаридів до місць a-D-1,6 розгалужень. Поширені головним чином у вищих рослин. Основними мікробними продуцентами b-амілази є представники роду Clostridium. Глюкоамілази (a-D-глюканглюкогідролази, ЕС 3.2.1.3), які також називають амілоглюкозидазами, вибірково відщеплюють термінальні залишки a-D-глюкози з нередукуючого кінця полі- і олігосахаридів. Фермент розщеплює залишкові a-D-1,4-глікозидні зв’язки й атакує a-D-1,6-глікозидні зв’язки, проте з меншою швидкістю. До амілолітичних ферментів загалом належить 85 ферментів, які гідролізують глікозидні зв’язки як у полісахаридах, так і в глікокон’югатах. Крім амілаз поширеними є полюланази та ізоамілази, які здатні розщеплювати a-D-1,6-глікозидні зв’язки. У мікроорганізмів ці ферменти є позаклітинними виділяються в середовище мезофільними бактеріями родів Bacillus, Clostridium, Lactobacillus і термофільними бактеріями родів Thermococcus, Pirococcus. Застосування. Амілолітичні ферменти, які використовують в процесах переробки крохмалю, становлять майже 30% кількості всіх ензимів, що використовуються для індустріальних потреб на сучасному етапі розвитку промислових технологій, а їхня загальна вартість становить 156 млн. доларів США за рік у світовому масштабі. Амілази бактеріального походження використовують у різних галузях народного господарства: при виробництві цукру та алкоголю, для утворення адгезивних речовин, обробці стічних вод, приготування фуражу. Амілолітичні ферменти незамінні в окремих процесах у випіканні хліба (поліпшують якість тіста), у виготовлені паперу і тканин (розшліхтовують волокна), пивоварінні і виноробстві. Алкалостабільні амілази знайшли застосування при виробництві детергентів для мийних засобів і пральних порошків, бактеріальні b-амілази застосовують у харчовій промисловості для отримання мальтозного сиропу, який є складовою частиною шоколаду і харчових сумішей. Амілази також є складовою частиною медичних препаратів, які призначені для лікування і профілактики гастроентерологічних захворювань. Отримання амілолітичних ферментів. У разі отримання амілаз за допомогою поверхневого культивування продуцентами можуть бути Aspergillus oryzae, A. awamori, A. niger. Принципову технологічну схему отримання амілаз з поверхневих культур наведено на рис. 13.1. Основа поживного середовища для одержання ферменту – пшеничні висівки, до яких додають солодові проростки. Середовище зволожується 0,1н розчином сірчаної або соляної кислот. Культивування здійснюється при 36 – 37ºС. Готова культура має вологість 36-50%. Процес очищення починається з екстрагування ферменту водою при температурі 20-25ºС. Для зменшення обнасіненості мікроорганізмами екстракт може бути оброблено розчинами електролітів. Осадження ферментів з екстракту здійснюють органічними розчинниками: етанолом при концентрації в розчині 69-72%, ацетоном 60-62% або ізопропанолом 54-55%. За таких умов амілази випадають в осад майже повністю (93-96%). Однак, на сьогодні поверхнева культура не вважається перспективною сировиною для виробництва високоочищених амілолітичних препаратів.
Рис. 13.1. Принципова схема одержання амілолітичних ферментів поверхневим способом
Продуцентом амілолітичних ферментів може бути також бактеріальна культура, наприклад B. subtilis. Якщо поживне середовище містить велику кількість азоту – цей продуцент накопичує ферменти протеолітичного комплексу, якщо вуглецю – ферменти амілолітичного комплексу. Всі ці препарати є вихідним матеріалом для отримання кристалічної глюкоамілази. Отримання кристалічної α-амілази. Для отримання кристалічного ферменту препарат із ступенем очистки 3х розчиняють у дистильованій воді. Необхідно зазначити, що повністю препарат у воді не розчиняється, оскільки відбувається часткова денатурація білка в попередніх стадіях виділення і очистки. Суспензію після розчинення залишають при температурі 3-5ºС на кілька хвилин і здійснюють центрифугування. Отриманий розчин направляють на стадію звільнення від сторонніх ферментів. Використовують оксалати, фосфати, сульфат кальцію, барію, ацетат свинцю і інше. Утворюється забарвлений осад, який видаляють, а освітлений розчин надходить на стадію осадження цільового ферменту сульфатом амонію. α-амілаза – металоензим, тому добре стабілізується іонами кальцію. Перед стабілізацією в розчин додають 0,25 н ацетат кальцію і 0,25н розчин їдкого натру для доведення рН до значення 7. Додавання сульфату амонію повинне бути поступовим для запобігання різкому локальному підвищенню концентрації солі. Утворюється рихлий осад. Внесення сульфату здійснюють до насичення 0,75. Отримують осад, який містить в основному цільовий фермент. Для позбавлення від солі осад розчиняють, здійснюють діаліз або ультрафільтрацію. Фракціонування риванолом (сіль молочної кислоти) здійснюють в 2 етапи. Спочатку вносять 50% від розрахованої кількості риванолу. Випадає темно-зелений осад (баластні речовини). Їх видаляють. До решти речовини додають наступні 50% риванолу, випадає жовтий осад α-амілази. Осад, що містить фермент, знов розчиняють в ацетатному буфері і розчин надходить на наступну стадію – відбувається сорбція на бетоніті (сорбуються домішки). Після цього розчин, що містить фермент, надходить на стадію осадження ацетоном. Ацетон охолоджують до -2ºС і додають до одного об’єму розчину 1,3 об’єму ацетону. При низьких температурах і за умови запобігання різкому локальному підвищенню концентрації ацетону випадає осад ферменту, який видаляють центрифугуванням. Додають розчин ацетату кальцію для стабілізації розчину, додають ацетон (температура -10ºС). При додаванні 20 – 30% ацетону утворюється легкий осад. Процес припиняють і лишають на 2 – 3 доби. Поступово утворюються кристали α-амілази різної форми. Більше 80% активності в розчині втрачається.
Протеази Субстратами для протеолітичних ферментів є пептиди і білки. До останніх належать прості білки (що складаються лише з амінокислот) та складні білки, які поряд з білковою частиною містять сполуки небілкової природи (вуглеводи, вітаміни, ліпіди) – протеїди. Всі протеолітичні ферменти розділено на дві групи: КФ 3.4.11 – 15 пептидази і КФ 3.4.21 – 24 протеїнази. Пептидази розподіляються на підкласи в залежності від механізму розщеплення пептидних зв’язків. КФ 3.4.11 – a-аміноацилпептидгідролази – розщеплюють перший з N-кінця пептидний зв’язок. КФ 3.4.12 – гідролази пептидиламинокислот або гідролази ациламінокислот – діють на перший з С-кінця зв’язок. КФ 3.4.13 – дипептидгідролази – гідролізують дипептиди. КФ 3.4.14 – дипептидилпептид гідролази і КФ 3.4.15 – пептидилдипептид – гідролізують дипептиди відповідно з N- і С-кінця. Протеїнази розподілено у чотири підкласи в залежності від особливостей механізму каталізу, встановленого за функціонуванням активного центру ферменту, а також впливу рН на його активність. Специфічність до субстрату розглядають лише з позиції ідентифікації індивідуальних ферментів в межах кожної групи. КФ 3.4.21 – серинові протеїнази – характерною ознакою є наявність в активному центрі амінокислот: аспарагінової, гістидину і серіну. До цього підкласу належать відомі протеїнази тваринного походження (хімотрипсин, трипсин, тромбін). КФ 3.4.22 – тіолові протеїнази – мають в активному центрі SH групу цистеїну. До цього підкласу відносять рослинні протеїнази (папаїн, фіцин, бромелаїн). КФ 3.4.23 – кислі протеїнази – мають оптимальний рН дії менше 5. Найбільш відомі протеїнази цього підкласу пепсин, катепсин. КФ 3.4.24 – протеїнази, що містять іони металів. В основному нейтральні мікробні протеїнази та деякі протеїнази тваринного походження. Використання. Найбільша необхідність в протеолітичних ферментах обумовлена їхнім використанням у складі синтетичних миючих засобів. Протеолітичні препарати, особливо тваринного походження, широко використовуються в медичній промисловості і медицині. Вони застосовуються для приготування живильних і діагностичних середовищ, для виготовлення ряду лікувальних сироваток і вакцин. Протеїнази різного ступеня очищення використовуються як лікарські препарати для регулювання процесів згортання крові, при лікуванні запальних процесів, для заповнення недостачі ферментів в організмі і т. д.. Протеолітичні ферменти також входять до складу ферментних медичних препаратів, що використовуються для лікування і профілактики захворювань, пов'язаних з порушення травлення. Замісна ферментна терапія є основним напрямком у терапії хворих із синдромом порушеного травлення, особливо при неможливості усунення причин його розвитку. В даний час у клінічній практиці використовується безліч ферментних препаратів, що відрізняються комбінацією компонентів, ензимною активністю, способом виробництва і формою випуску.
Коротка фармакологічна характеристика протеолітичних ферментних препаратів: Ацидин-пепсин – препарат, що містить протеолитический фермент. Одержують зі слизової оболонки шлунка свиней. Таблетки по 0,5 і 0,25 г містять 1 частину пепсину, 4 частини ацидину (бетаїну гідрохлориду). Призначаються при гіпо- і анацидних гастритах по 0,5 г 3–4 рази на добу під час їжі. Таблетки попередньо розчиняються в 1/2 склянки води. Вобензим - комбінований препарат, що містить високоактивні ферменти рослинного і тваринного походження. Крім панкреатину містить папаїн, бромелаїн (з ананаса звичайного) і рутозид (група вітаміну Р). Займає особливе місце в ряді ферментних препаратів, тому що поряд з вираженими ферментативними властивостями характеризується протизапальною, протинабряковою і фібринолітичною дією. Використовується при панкреатиті, виразковому коліті, хворобі Крона, травмах, аутоіммунних онкологічних, урологічних, гінекологічних захворюваннях. Доза встановлюється індивідуально і складає від 5 до 10 драже 3 рази на добу. Дигестал – містить панкреатин, екстракт жовчі великої рогатої худоби і геміцелюлазу. Препарат призначається по 1–2 драже 3 рази в день під час або після їжі. Креон – препарат, у желатиновій капсулі якого утримується велика кількість панкреатину в стійких до соляної кислоти гранулах. Препарат характеризується швидким (протягом 4–5 хв) розчиненням желатинових капсул у шлунку, вивільненням і рівномірним розподілом стійких до шлункового соку гранул по всьому хімусу. Гранули безперешкодно проходять через пілоричний сфінктер одночасно з хімусом у дванадцятипалу кишку, цілком захищають ферменти панкреатину при пасажі через кисле середовище шлунка і характеризуються швидким вивільненням ферментів при надходженні препарату в дванадцятипалу кишку. Мезим-форте – частіше призначається для корекції короткочасних і незначних дисфункцій підшлункової залози. Драже мезим-форте покрито спеціальною глазурной оболонкою, що захищає компоненти препарату від агресивного впливу кислого середовища шлунка. Застосовується по 1–3 драже З рази в день перед їжею. Ораза – кислотостійкий комплекс протеолітичних і амілолітичнх ферментів (з культури гриба Aspergillus oryzae), що складається з амілази, мальтази, протеази, ліпази. Препарат не руйнується в шлунку, розчиняється в кишечнику (при лужному рН), Призначається по 0.5 –1 чайній ложці гранул 3 рази на день під час або відразу після їжі. Панкреатин – препарат підшлункової залози великої рогатої худоби, що містить ферменти. Добова доза панкреатину складає 5–10 г. Панкреатин приймають по 1 драже 3–6 рази на день перед їжею. Панкурмен – комбінований препарат, у 1 драже якого утримується панкреатин і екстракт куркуми (жовчогінний засіб). Приймають по 1–2 драже до їжі 3 рази в день. Панцитрат – препарат нового покоління з високим вмістом панкреатину. Має фармакодинаміку подібну з Креоном. Желатинові капсули містять мікротаблетки в спеціальній оболонці, резистентній до шлункового соку, що гарантує звільнення усіх ферментів у кишечнику. Призначається по 1 капсулі 3 рази в день. Джерела отримання. Протеолітичні ферменти синтезуються практично всіма живими істотами. У промислових цілях як джерело одержання протеїназ використовуються тваринні тканини, рослини і мікроорганізми. Тваринними тканинами для одержання протеїназ є ферментна сировина, яка збирається на м'ясокомбінатах, що складається з підшлункової залози і слизової оболонки шлунку. З рослин промисловий інтерес представляють плоди динного дерева, листя інжиру і відходи переробки ананасів. Найбільш широким і перспективним джерелом протеїназ є мікроорганізми. Активними продуцентами протеїназ є бактерії, мікроскопічні гриби й актиноміцети. Можна назвати сотні мікроорганізмів, які належать до різних таксономічних груп, що використовуються при промисловому одержанні протеїназ. Найчастіше продуцентами є представники родів Bacillus, Aspergillus, Penicillium, streptomyces. Мікроскопічні гриби, на відміну від бактерій, утворюють не тільки серинові і металовмісні протеїнази, але і карбоксильні протеїнази і комплекс пептидаз. Отримання мікробних протеїназ. Мікроорганізми є одним з головних джерел протеолітичних ферментів. У промисловості найчастіше одержують комплекс протеолітичних ферментів, переваги якого визначаються з урахуванням наступного застосування ферментного препарату. Сумарна протеолітична активність такого препарату визначається на відповідному субстраті: гемоглобіні, желатині, рослинному білку, еластині, колагені і т.д.. Технологічні схеми виробництва мікробних протеїназ відрізняються одна від одної насамперед на першій стадії одержання мікробної культури продуцента, на стадіях виділення розходження менші. Поверхневий спосіб культивування. Використання поверхневого способу для виробництва протеїназ знижується з року в рік. В даний час протеїнази в більшості випадків одержують при культивуванні продуцента в глибинних умовах. При поверхневому культивуванні як продуцентів найчастіше використовують мікроскопічні гриби А. oryzae, A.flavus, A. terricola. Основним компонентом середовища є зволожені до 56–65% пшеничні висівки. Для збагачення пшеничних висівок можуть бути використані деякі добавки, звичайно рослинного походження, такі як білковий відстій (пивоварне виробництво), солодові паростки, просяне борошно, соєве борошно і т.п. Середовища при зволоженні не підкисляються, тому що введення кислот знижує здатність мікроскопічних грибів до синтезу. Звичайно рН середовища становить 5,6–6,2. Для поліпшення умов аерації культури доцільно вносити в середовище до 10–20% тирси, наприклад, березової. Крім того, внесення розрихлювача дозволяє трохи підвищити вологість середовища –до 62–65%, що сприяє посиленню біосинтезу протеїназ. Режим аерації, температури і тривалість процесу для кожного продуцента встановлюються експериментально. Готова культура або висушується (у такому випадку отримують препарат Пх), або надходить на наступне очищення. Водний екстракт може бути сконцентрований (препарат П2х), або використаний для осадження ферментів. При осадженні етанолом вихід препарату від вихідної культури становить близько 5% з переходом в осад до 70 – 73% ферменту; при осадженні ізопропіловим спиртом вихід близько 2,2 – 2,5% з переходом в осад до 85–90% протеїназ. Глибинний спосіб культивування. Як продуцентів протеолітичних ферментів при глибинному культивуванні в промислових умовах використовують бактерії в основному роду Bacillus, рідше – актиноміцети і мікроскопічні гриби. Здатність до утворення протеолітичних ферментів відзначається практично у всіх відомих мікроорганізмів, оскільки роль цих ферментів у регуляції життєвих функцій дуже велика. Протеолітичні ферменти в переважній більшості випадків є позаклітинними. Глибинним способом культивують більшість продуцентів протеолітичних ферментів. Для виробництва нейтральних і лужних протеаз використовують спороносні бактерії й актиноміцети, для одержання кислих – мікроскопічні гриби. Найбільш широко в нашій країні застосовуються штами бактерій, що відносяться до видів Bacillus subtilis і В. mesentericus, на основі яких випускаються препарати протосубтилін і протомезентерин різного ступеня очищення, призначені для різних галузей – від харчових технологій до використання в миючих засобах і в сільському господарстві. При конструюванні оптимальних середовищ для кожного продуцента вивчаються його фізіологія, потреба в джерелах азоту, вуглецю і інших речовинах. Вміст сухої речовин в поживному середовищі в залежності від продуцента може змінюватися від 6 до 20%. На основі культуральної рідини, що містить позаклітинні протеїнази, можна одержати ферментні препарати різного ступеня очищення, використовуючи різноманітні методи – починаючи від висушування розпиленням готової культуральної рідини і до методів одержання високоочищених ферментних препаратів і кристалічних протеїназ. Кристалічні препарати бактеріальних протеїназ. Для отримання кристалічних препаратів необхідно культуральну рідину очищати за допомогою ультрафільтрації, концентрувати її та доочищувати на ДЕАЕ-целюлозі та КМ-целюлозі. Процес одержання кристалічної протеази наведено на рис. 13.2. Експериментальним шляхом було встановлено, що найкращі результати ультрафільтрації можна отримати за використання мембран з порами розміром 54*10-10 м, на яких при зміні тиску від 0,2 до 0,4 МПа швидкість ультрафільтрації збільшується з 13 до 21 мл/год. Значний вплив на вихід ферменту при ультрафільтрації має значення рН. Оптимальним є рН 7,3, за якого вихід ферменту становить 98%. За температури 10-12°С втрати ферменту будуть мінімальними.
Рис. 13.2. Схема одержання кристалічних протеїназ
При ультрафільтрації відбувається не лише ефективне концентрування ферментів (у десятки разів), а й звільнення їх від низькомолекулярних домішок (на 83%) та інертних білків (на 43%). Вихід протеази в концентраті становить від 86 до 97%. Ефективним для очищення ферментів є поєднання сорбції на ДЕАЕ-целюлозі та КМ-целюлозі. Міцність адсорбції кожного білка на іонообміннику визначається величиною заряду білка, який залежить від рН розчину та його солевої концентрації. При елюювання білків відбувається розрив зв’язків, що досягається зміною рН розчину, а також підвищенням його іонної сили 9збільшенням концентрації буферу чи додаванням нейтральних солей). Протеолітичний комплекс ферментів B. subtilis не сорбується на ДЕАЕ-целюлозі і виходить з колонки з фронтом буферу. Вихід протеаз з колонки становить 90-100%. Ця операція дозволяє повністю видалити пігменти. Найкращі результати отримують за використання 0,002 М фосфатного буферу з рН 7,0 – 7,5. Наступним етапом є хроматографія на колонці з КМ-целюлозою. Використовують колонку попередньо врівноважену 0,01 М розчином ацетату кальцію, який характеризується сильної буферністю і має стабілізуючий вплив на протеази. З фронтом буферу виходять залишкові пігменти. Елюцію здійснюють тим же буфером з хлоридом натрію. При концентрації хлориду натрію 0,25 – 0,3 М елюються нейтральні протеази, а при 0,4 – 0,45 М – лужна протеаза. Хроматографію здійснюють на колонці з КМ-целюлозою 27Х250 мм, швидкість протоку 30 мл/год. Для отримання кристалів протеази до елюату додають ацетон шляхом обережного нашарування. Процес припиняють, якщо додавання нової порції ацетону не спричинює помутніння на межі розподілу фаз. Отримані кристали відділяють центрифугуванням, суспендують в малому об’ємі 0,01 М розчину ацетату кальцію і ліофілізують. Вихід по активності нейтральної протеази не менше 30%, лужної – не менше 40%. Ліпази Ліполітичні ферменти відіграють виключно важливу роль у обміні ліпідів всіх живих організмів. Вони приймають участь у процесах накопичення та мобілізації жиру, який використовується в якості енергетичного резерву клітини; крім того, включаючись до метаболізму внутришньоклітинних ліпідів, вони приймають участь у функціонуванні біологічних мембран. Ліполітичними ферментами називають гідролази ефірів жирних кислот з довгим ланцюгом, тобто насичені чи ненасичені аліфатичні кислоти, що містять не менш ніж 12 атомів вуглецю. Оскільки за хімічними, фізичними та біологічними властивостями найбільш “типова” жирна кислота – це олеїнова кислота, то довільну естеразу, яка має здатність гідролізувати ефіри олеїнової кислоти, можна вважати ліполітичним ферментом. Спиртова група такого ефіру може бути представлена або гліцерином (ліпази), або його похідним (фосфоліпази 1 та 2, лізофосфоліпаза, галактоліпаза), або стеарином (холестерол-естераза). Всі ці ефіри належать до природних або фізіологічних субстратів, однак більшість ліполітичних ферментів можуть гідролізувати також штучно отримані ефіри, часто із зовсім іншою структурою. Класифікація ферментів ліполітичного комплексу. За класифікацією, рекомендованою Міжнародним біохімічним союзом, всі ліполітичні ферменти відносять до класу гідролаз (клас 3), крім того всі ліполітичні ферменти є гідролазами ефірів, тобто належать до підкласу 1. Ліполітичні ферменти гідролізують ефіри жирних кислот, тобто відносяться до підкласу гідролаз ефірів карбонових кислот (КФ 3.1.1). Фосфоліпази, включені до групи ліполітичних ферментів, належать до підкласу гідролаз фосфодіефірів (КФ 3.1.4), а фосфатидфосфогідролаза – до підкласу фосфомоноефірів (КФ 3.1.3). Розглядаючи класифікацію ліполітичних ферментів докладніше можна виділити такі основні групи цих ферментів: Гідролази ефірів гліцерину (КФ 3.1.1.3) – це власне “ліпази”, тобто ацилгідролази вищих тригліцеридів. Позиційна специфічність по відношенню до первинних ефірних зв’язків присутня, але не в усіх випадках. Як правило ці ферменти можуть гідролізувати також ді- та моногліцериди. Найвідомішим представником цієї групи є панкреатична ліпаза. Холестерол-естераза гідролаза стиролових ефірів (КФ 3.1.1.13), можливо ідентична моногліцеридліпазі, але це питання ще остаточно не вирішене. Фосфоліпаза-2-фосфатид–2-ацилгідролаза (КФ 3.1.1.4), її називають ще лецитіназа або фосфоліпаза А, належить до ліполітичних ферментів із чіткою субстратною специфічністю; ферменти цієї групи гідролізують ацилефірний зв’язок в 3-фосфогліцеридах лише в положенні 2. Лізофосфоліпази лізолецитин–ацилгідролаза (КФ 3.1.1.5), специфічно гідролізуючи в лізофосфоліпідах ефірний зв’язок в положенні 1 або 2, можливо існують, однак поки ще така специфічність не виявлена; є привід вважати, що “лізофосфоліпази” є ферментами з дуже широкою специфічністю, тому їх можна віднести до групи амфіфільних гідролаз ефірів карбонових кислот. Фосфогідролази: фосфатидат–фосфогідролаза (КФ 3.1.3.4), фосфоліпаза 3 (КФ 3.1.4.3), яка гідролізує в фосфогліцеридах фосфоефірний зв’язок в положенні 3, та сфінгомієлаза (КФ 3.1.4.–), яка гідролізує відповідний зв’язок в сфінгомієліні. Не виключено, що існують ферменти, які мають активність як фосфоліпази 3, так і сфінгомієлази. Фосфоліпази 4 фосфатидилхолін–фосфатидогідролаза (КФ 3.1.4.4) каталізують гідролітичне відщеплення гідрофільного спирту як від фосфогліцеридів, так і від сфінгомієлінів. Субстратна специфічність ліпази включає: – позиційну специфічність, тобто здатність гідролізувати в тригліцеридах лише первинні, або первинні та вторинні ефірні зв’язки; – стерео специфічність, тобто здатність (гіпотетичну) гідролізовати складноефірний зв’язок лише в положенні 1 або тільки в положенні 3 тригліцериду; – схильність до гідролізу складноефірних зв’язків, утворених жирними кислотами з більш довгим або більш коротким ланцюгом, насиченими або ненасиченими; і в цілому залежність швидкості реакції від структури субстрату. Позиційну специфічність можна визначити хроматографією в тонкому шарі силікагелю, насиченого борною кислотою, 1,2-дігліцериди відокремлюють від 1,3-дігліцеридів та 1- та 2-моногліцеридів. Ці продукти можна оцінити кількісно безпосередньо газорідинною хроматографією після перетворення іх в похідні триметилкремнієвої кислоти. Можна також використовувати в якості субстрату змішані тригліцериди з відомим позиційним розподіленням жирних кислот. Після ліполізу продукти реакції відокремлюють та аналізують. Наприклад, тригліцериди, жирні кислоти та дігліцериди можна відокремити на колонці з кремнієвою кислотою при елююванні сумішшю гексан–діетиловий ефір. Стереоспецифічність ліпази також можна перевірити, використовуючи субстрат з відомим стеричним розподіленням жирних кислот, котрий отримують або повним хімічним синтезом, або ацилуванням по третьому положенню 1,2-дігліцериду, отриманого із фосфоліпіду за допомогою фосфоліпази 3. Застосування ферментів ліполітичного комплексу. Мікробна ліпаза в комплексі з амілазою використовуються в якості лікувального препарату, що сприяє травленню. Такий препарат має бути активним в широкому діапазоні рН, щоб гідролізувати жири в шлунку та кишківнику. Препарати, отримані із культуральної рідини Aspergillus oryzae, є комплексами з протеазою та амілазою, використовуються для фармацевтичної та косметичної промисловості. Ліпаза А. awamori була використана для знежирювання та очищення грізеофульвіна, отриманого при культивуванні P. nigricans. Застосування ліпази дозволило підвищити вихід антибіотику та поліпшити його якість. Не меншу цікавість має практичне використання ліпаз в харчовій та інших галузях промисловості. Окрім того, ліпаза входить до складу багатьох синтетичних миючих засобів як активна біодомішка. Значний інтерес можуть представити ліпази для отримання різних жирних кислот із тригліцеридів у зв’язку з можливістю використання жирних кислот в якості антиканцерогенних препаратів. При культивуванні дріжджів на середовищах з парафінами в клітинах та в середовищі накопичуються тригліцериди. Внесення в культуральну рідину ліпази дозволить значно підвищити вихід біомаси дріжджів за рахунок використання ними продуктів гідролізу. Гідроліз дешевих тваринних жирів мікробними ліпазами перед омиленням жирних кислот може бути одним з методів отримання гліцерину. Отримання ліпаз. Ліполітичні препарати можуть бути отримані з тваринних тканин, насіння деяких рослин та мікроорганізмів. Джерелом тваринної ліпази є підшлункова залоза. Серед бактерій активні продуценти ліпаз належать до родів Pseudomonas, Bacillus, Acinetobacter, Propionibacterium, Chromobacterium, Alcaligenes. Серед дріжджів найкращими продуцентами є представники роду Candida (C. lipolytica, C. paralipolytica, C. cylindraceae). Високою ліпазною активністю характеризуються мікроскопічні гриби родів Geotrichum, Aspergillus, Mucor, Rhizopus, Penicillium, Oospora, Humicola. Серед актиноміцетів продуцентами можуть бути представники видів Streptomyces flavogriseus, Thermoactinomyces vulgaris. Бактерії, як правило, накопичують внутрішньоклітинну ліпазу, актиноміцети, гриби та дріжджі – переважно позаклітинну. Джерелами вуглецю в середовищі для отримання ліпаз можуть бути крохмаль, декстрини, моно- та олігосахариди. До складу поживних середовищ часто вводять компоненти ліпідної природи, оскільки, на думку деяких дослідників, ліпази є індуцибельними ферментами. Однак, не кожен ліпідний компонент стимулює утворення ліпаз. Найчастіше в поживних середовищах використовують оливкову та бавовникову олію, рідше – соняшникову, рапсову, кукурудзяну, касторову, соєву олії. В залежності від потреб продуценту в середовищах використовують мінеральні, органічні та змішані джерела азоту. Важливим компонентом поживного середовища є соєва мука, ліпідний комплекс якої стимулює утворення ліпаз багатьма мікроорганізмами. Отримання препаратів ліпаз і їх очищення здійснюється з фільтратів культуральних рідин. Біомаса продуценту та тверді домішки видаляють центрифугуванням або фільтруванням. Рідка фаза стабілізується додаванням солей і концентрується ультрафільтрацією або вакуум-вапарюванням. Отримай концентрат може бути висушений для отримання препаратів ліпази з індексом Г3х. Подальша очистка ферментів передбачає їхнє осадження органічними розчинниками або неорганічними солями. Ліпази досить чутливі до впливу органічних розчинників, під їх впливом часто спостерігається часткова денатурація білка, що призводить до порушення структури активного центру та втрати активності. Тому для виділення ліпаз частіше використовують висолювання сульфатом амонію. Для отримання високоочищених препаратів ліпази використовуються всі методи хроматографії, електрофорез, гель-фільтрація, ізофокусування. Кривовой А.Ю. із співавторами розроблений для промислового використання спосіб виділення гомогенної ліпази із препарату Ліпоризин Г10х. Для очищення ферменту запропоновано використовувати метод метало-хелат-афіної хроматографії. Схема очищення наведена на рис. 13.3. Використовуючи такий метод вихідний препарат Ліпоризин Г10х було очищено у 44 рази.
Рис. 13.3 Схема очищення препарату Ліпоризин Г10х Японська фірма «Тойокодьо» запатентувала спосіб очищення ліпаз із використанням сорбентів у вигляді солей вищих жирних кислот, які формуються у вигляді гранул і мікрокапсул. Цей метод дозволяє отримувати високоочищені препарати з активністю до 90-95% від вихідної. Варто зазначити, що існують різноманітні методи очищення ліполітичних ферментів і їхній вибір базується на врахування властивостей продуценту, складу середовища, а головне властивостей ліпази, що отримується. 13.4 Лактаза (β-Галактозидаза) Лактоза – дисахарид, який складається з глюкози і галактози. Міститься в молоці і молокопродуктах (близько 4%). Однією з важливих медичних проблем є корекція дефіциту лактази (b-галактозидази) в організмі людини. Лактаза виробляється у верхньому відділі тонкого кишечнику і розщеплює лактазу на глюкозу і галактозу, які після цього легко всмоктуються у кров. Відсутність чи недостатність цього ферменту призводить до того, що хворі практично позбавлені можливості використовувати у своєму раціоні молоко і молочні продукти. Використання екзогенного ферменту лактази може вирішити цю проблему. Найбільш відомі фармацевтичні препарати, що містять цей фермент, Lact-Aid (США), що містить дріжджову лактазу з Kluyveromyces lactis, Lactrasa і Lactrasa-N (США), що містить грибну лактазу з Aspergillus oryzae і Aspergillus niger відповідно. Ці препарати призначені для приймання всередину одночасно з молоком.
|
|||||||||
|
Последнее изменение этой страницы: 2016-07-14; просмотров: 887; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.218.215 (0.081 с.) |