Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення валентності елементів за формулою.
У формулах бінарних сполук сумарна валентність усіх атомів одного елемента завжди дорівнює сумарній валентності всіх атомів іншого елемента. Наприклад, ІІІ ІІІІ ІІ І ІІ Сr2O3 CuO Na2O Послідовність складання хімічних формул за валентністю: 1. Над символами елементів написати валентність. 2. Знайти найменше спільне кратне. 3. Поділити найменше спільне кратне на валентність кожного елемента. 4. Отримані числа записати в хімічній формулі як індекси. Наприклад: 1. AlІІІОІІ 2. Найменше спільне кратне 6 (3 · 2 = 6). 3. Al – 6: 3 = 2; O – 6: 2 = 3. 4. Al2O3.
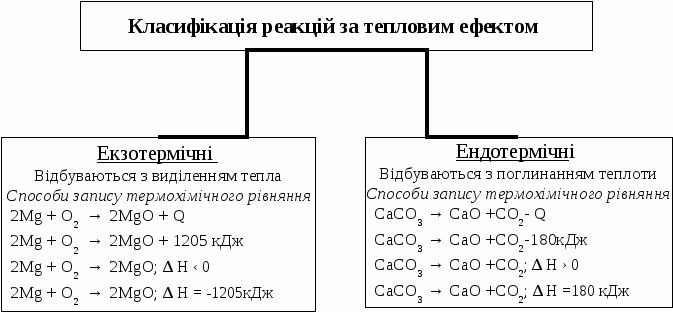
Основні закони хімії Закон збереження маси: сума мас речовин, які прореагували, дорівнює сумі мас речовин, що утворилися внаслідок реакції. У природі ніщо не виникає з нічого і не зникає безслідно. Закон сталості складу: кожна хімічна сполука має сталий якісний і кількісний склад незалежно від способу її добування. Закон Гей-Люссака: об'єми газів, що вступають у реакцію, відносяться один до одного і до об'ємів газоподібних продуктів реакції як прості цілі числа (за однакових умов). Коефіцієнти перед газоподібними речовинами у хімічному рівнянні дорівнюють об'ємам газів. Об’єднаний газовий закон:
де P0, V0, T0 – тиск, об’єм і температура газу за нормальних умов (P0 = 101325 Па, Т0 = 273 К). Рівняння Менделєєва-Клапейрона описує залежність об’єму газу від кількості речовини цього газу, температури і тиску. PV = де P – тиск газу, Па; V – об’єм газу, л; m – маса газу, г; M – молярна маса газу, г/моль; ν – кількість речовини газу, моль; R – універсальна газова стала, R = 8,314 Дж/(моль·К). Закон Авогадро: в однакових об’ємах різних газів за однакових умов міститься однакове число молекул. 1 моль будь-якої речовини містить 6,02·1023 структурних одиниць (молекул, атомів, йонів, електронів). Молярний об’єм – це об’єм 1 моль газу. За нормальних умов (P0 = 101,3 кПа, Т0 = 273 К) він дорівнює 22,4 л/моль. Кількісні величини в хімії
План характеристики хімічних елементів за положенням
У періодичній системі та будовою атомів 1. Назва елемента, його символ, Аr 2. Положення у періодичній системі: - номер періоду, - номер групи, підгрупи - порядковий номер. 3. Будова атома: - заряд ядра атома, - кількість протонів, нейтронів, електронів, - кількість електронних рівнів, - електронна формула, коміркова структура, - кількість електронів на зовнішньому електронному шарі. 4. Визначити властивості елемента та його сполук: - метал чи неметал, - записати формулу оксиду, визначити його характер та дати назву, - записати формулу гідроксиду (основи чи кислоти), вказати характер, дати назву, - записати формулу леткої водневої сполуки елемента з Гідрогеном (для неметалічних елементів). 5. Скласти хімічні рівняння, які характеризують властивості елемента:
6. Скласти хімічні рівняння, які характеризують властивості оксиду елемента:
7. Скласти хімічні рівняння, які характеризують властивості гідроксиду елемента:
Найважливіші кислоти
Ряд активності кислот: сильні середні слабкі
НІ, HClО4,H2SO4,HF, СН3СООН, H2CO3, HCl, HNO3H3PO4, H2SO3 H2S, H2SiO3
Можливі ступеня окиснення Деяких хімічних елементів
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-14; просмотров: 286; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.124.244 (0.015 с.) |
 = const; або
= const; або 
 RTабо PV = νRT,
RTабо PV = νRT,
 ; υ =
; υ = 
 ;
DН2=
;
DН2=  ;DО2=
;DО2=  ;Dпов.=
;Dпов.=  ;
;
 100%
100%
 100%
100%

 100%
100%
 100%
η=
100%
η=  100%
η=
100%
η=  100%
100%