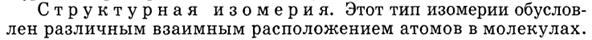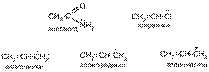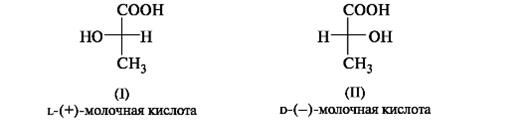Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
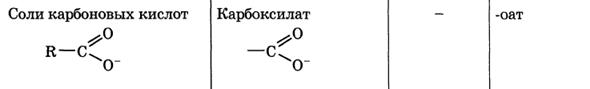
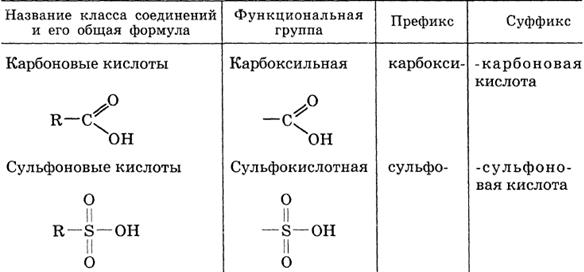
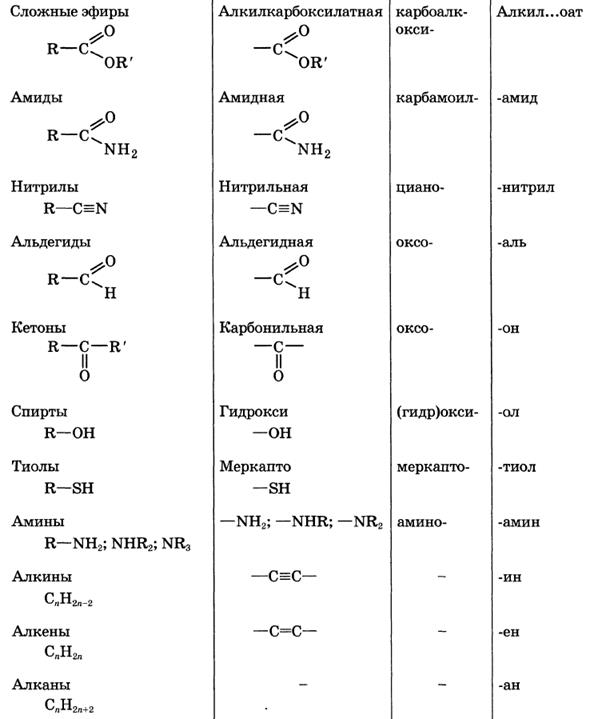
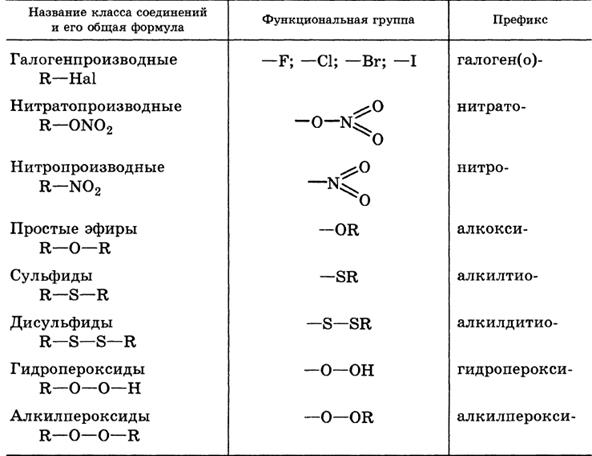
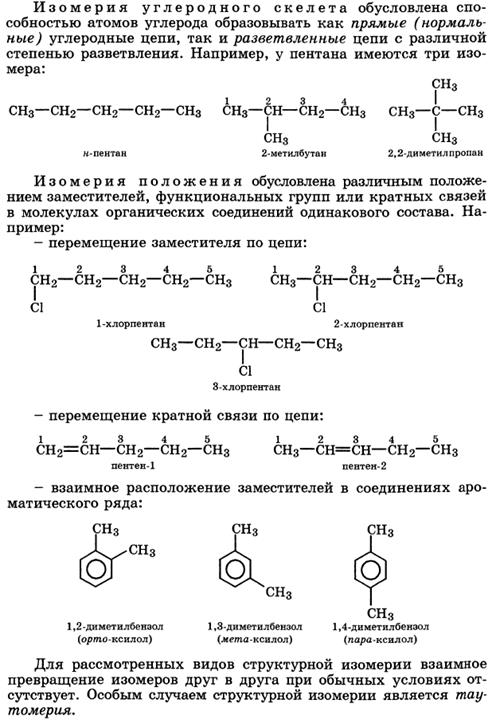
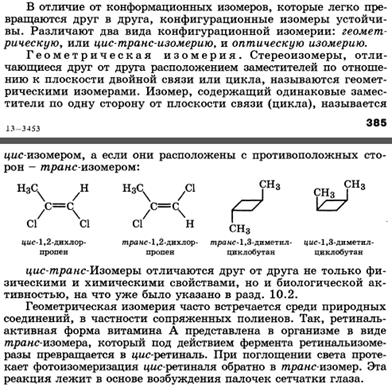
Классификация и номенклатура органических соединений. Виды изомерии.
Номенклатура – совокупность правил составления названий химических веществ, классов, групп и др. Главное место в органической химии занимает международная систематическая номенклатура, разрабатываемая комиссией Международного союза теоретической и прикладной химии (ИЮПАК). Название органического соединения отражает особенности его строения. У соединений жирного ряда корень слова обозначает число углеродных атомов главной цепи. Главной считают самую длинную и непрерывную цепь атомов углерода, имеющую наибольшее число заместителей или связанную со старшей функциональной группой.
3.Понятие о сопряженных системах. Понятие об ароматичности.Правило Хюккеля. π-π – сопряжение: делокализованная МО образуется за счет двух или более двойных связей:
р-π – сопряжение: в сопряжении участвуют соседние с π-связью атомы, имеющие негибрилизованные р-орбитали:
В результате сопряжения выделяется энергия, внутренняя энергия уменьшается, и молекула становится термодинамически более устойчивой. Энергия сопряжения – это энергия, выделяющаяся в результате сопряжения (т.е. это энергетический выигрыш в результате сопряжения) - с увеличением цепи сопряжения энергия сопряжения увеличивается. Различаются линейные и циклические системы сопряжения, последние в отличие от первых имеют замкнутую цепь сопряжения, в которой все входящие в неё атомы имеют негибридизованную р-орбиталь. АРОМАТИЧНОСТЬ Ароматичность – это понятие, обозначающее совокупность особых свойств некоторых циклических сопряженных систем. Ароматические соединения, несмотря на высокую степень ненасыщенности: 1) предпочтительно вступают в реакции замещения, а не присоединения; 2) устойчивы к мягкому окислению. Типичными представителями ароматических систем являются арены и их производные. Особенности электронного строения ароматических углеводородов наглядно проявляются в атомно-орбитальной модели молекулы бензола. Каркас бензола образуют шесть sp2-гибридизованных атомов углерода. Все σ-связи (C-C и C-H) лежат в одной плоскости.
Ароматические системы (молекулы)– системы, отвечающие критериям ароматичности: 1) наличие плоского σ-скелета, состоящего из sp2-гибридизованных атомов; 2) делокализация электронов, приводящая к образованию единого π-электрон-ного облака, охватывающего все атомы цикла (циклов); 3) соответствие правилу Э. Хюккеля, т.е. электронное облако должно насчитывать 4n+2 π-электронов, где n=1,2,3,4… (обычно цифра указывает на количество циклов в молекуле); 4) высокая степень термодинамической устойчивости (высокая энергия сопряжения).
Правило Хюккеля: N= 4n+ 2, гдеN– число π- и р-электронов в сопряженной системе; n = 0,1,2,3 … Ароматическая система – это циклическая сопряженная система, удовлетворяющая правилу Хюккеля. сопряженные и ароматические системы обладают повышенной термодинамической устойчивостью. Они содержат меньший запас внутренней энергии и в основном состоянии занимают более низкий энергетический уровень по сравнению с несопряженными системами. По разнице этих уровней можно количественно оценить термодинамическую устойчивость сопряженного соединения, т. е. его энергию сопряжения(энергию делокализации). С увеличением длины сопряженной цепи энергия сопряжения и соответственно термодинамическая устойчивость соединений возрастают. Конденсированные бензоидные ароматические системы
Небензоидные ароматические системы
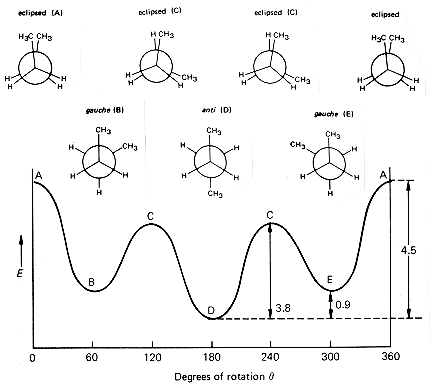
Этан
Бутан
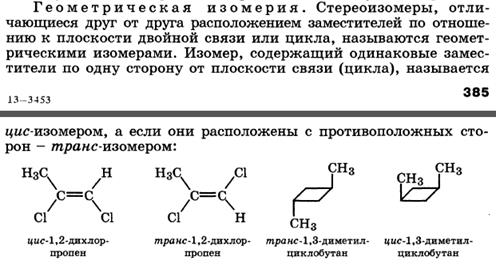
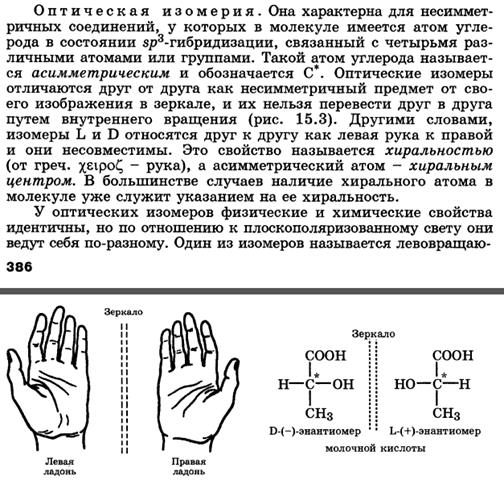
Понятие о конфигурации молекул. Оптическая, или зеркальная изомерия. Элементы симметрии молекул (ось, плоскость, центр). Ассиметрический атом углерода как центр хиральности. Оптическая активность и удельное вращение веществ.
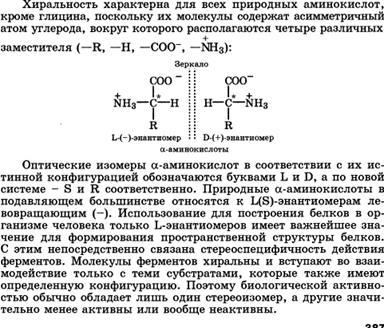
Молекулы с одним центром хиральности (энантиомерия). Глицериновый альдегид как кон-фигурационный стандарт. Проекционные формулы Фишера. Относительная и абсолютная конфигурация. D-, L- и R-, S-системы. Понятие о рацематах. Энантиомеры - стереоизомеры, относящиеся друг к другу, как предмет и несовместимое с ним зеркальное отображение.
В виде энантиомеров могут существовать только хиральные молекулы.
Хиральность - это свойство объекта быть несовместимым со своим зеркальным отражением. Хиральными (от греч. cheir - рука), или асимметричными, объектами являются левая и правая рука, а также перчатки, ботинки и др. Эти парные предметы представляют собой объект и его зеркальное отражение (рис. 7.1, а). Такие предметы не могут быть полностью совмещены друг с другом.
В то же время существует множество окружающих нас предметов, которые совместимы со своим зеркальным отражением, т. е. они являются ахиральными (симметричными), например тарелки, ложки, стаканы и т. д. Ахиральные предметы обладают по крайней мере одной плоскостью симметрии, которая делит объект на две зеркальноидентичные части (см. рис. 7.1, б).
Подобные взаимоотношения наблюдаются также в мире молекул, т. е. молекулы делятся на хиральные и ахиральные. У ахиральных молекул есть плоскости симметрии, у хиральных их нет.
В хиральных молекулах имеется один или несколько центров хиральности. В органических соединениях в качестве центра хиральности чаще всего выступает асимметрический атом углерода.
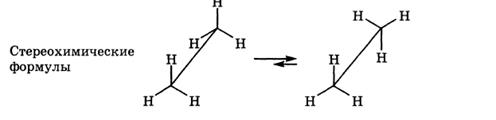
Асимметрическим является атом углерода, связанный с четырьмя различными атомами или группами.
При изображении стереохимической формулы молекулы символ «С» асимметрического атома углерода обычно опускается.
Для изображения конфигурационных изомеров на плоскости можно пользоваться стереохимическими формулами. Однако удобнее применять более простые в написании проекционные формулы Фишера (проще - проекции Фишера). Тетраэдрическую модель одного из энантиомеров располагают в пространстве так, чтобы цепь атомов углерода оказалась в вертикальном положении, а карбоксильная группа - сверху. Связи с неуглеродными заместителями (Н и ОН) у хирального центра должны быть направлены к наблюдателю. После этого модель проецируют на плоскость. Символ асимметрического атома при этом опускается, под ним понимают точку пересечения вертикальной и горизонтальной линий. Тетраэдрическую модель хиральной молекулы перед проецированием можно располагать в пространстве по-разному,. Необходимо только, чтобы связи, образующие на проекции горизонтальную линию, были направлены к наблюдателю, а вертикальные связи - за плоскость рисунка. • в проекционной формуле разрешается менять местами два любых заместителя у одного и того же хирального центра четное число раз (двух перестановок бывает достаточно); • проекционную формулу разрешается поворачивать в плоскости рисунка на 180? (что эквивалентно двум перестановкам), но не на 90?. За конфигурационный стандарт был принят глицериновый альдегид. Его левовращающему энантиомеру была произвольно приписана формула (I). Такая конфигурация атома углерода была обозначена буквой l (от лат. laevus - левый). Правовращающему энантиомеру соответственно была приписана формула (II), а конфигурация обозначена буквой d (от лат. dexter - правый). Заметим, что в стандартной проекционной формуле l-глицеринового альдегида группа ОН находится слева, а у d-глицеринового альдегида - справа.
Отнесение к d- или l-ряду других родственных по структуре оптически активных соединений производится путем сравнения конфигурации их асимметрического атома с конфигурацией d- или l-глицеринового альдегида. Например, у одного из энантиомеров молочной кислоты (I) в проекционной формуле группа ОН находится слева, как у l-глицеринового альдегида, поэтому энантиомер (I) относят к l-ряду. Из тех же соображений энантиомер (II) относят к d-ряду. Так из срав- нения проекций Фишера определяют относительную конфигурацию.
Следует отметить, что l-глицериновый альдегид имеет левое вращение, а l-молочная кислота - правое (и это не единичный случай). Более того, одно и то же вещество может быть как лево-, так и правовращающим в зависимости от условий определения (разные растворители, температура). Знак вращения плоскости поляризованного света не связан с принадлежностью к d- или l-стереохимическому ряду. Практическое определение относительной конфигурации оптически активных соединений проводят с помощью химических реакций: либо исследуемое вещество превращают в глицериновый альдегид (или другое вещество с известной относительной конфигурацией), либо, наоборот, изd- или l-глицеринового альдегида получают исследуемое вещество. Разумеется, что в ходе всех этих реакций не должна изменяться конфигурация асимметрического атома углерода. Произвольное приписание лево- и правовращающему глицериновому альдегиду условных конфигураций было вынужденным шагом. В то время абсолютная конфигурация не была известна ни для одного хирального соединения. Установление абсолютной конфигурации стало возможным только благодаря развитию физико-химических методов, особенно рентгеноструктурного анализа, с помощью которого в 1951 г. впервые была определена абсолютная конфигура,ция хиральной молекулы - это была соль (+)-винной кислоты. После этого стало ясно, что абсолютная конфигурация d- и l-глицериновых альдегидов действительно такая, какая им была первоначально приписана. d,l-Система в настоящее время применяется для α-аминокислот, гидроксикислот и (с некоторыми дополнениями) для углеводов R,S-Система обозначения конфигурации. d,L-Система имеет весьма ограниченное применение, так как часто невозможно соотнести конфигурацию какого-либо соединения с глицериновым альдегидом. Универсальной системой обозначения конфигурации центров хиральности является R,S-система (от лат. rectus - прямой, sinister - левый). В ее основе лежит правило последовательности, основанное на старшинстве заместителей, связанных с центром хиральности.
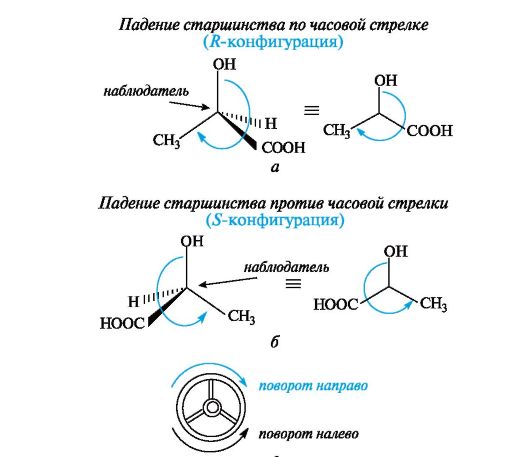
Старшинство заместителей определяется атомным номером элемента, непосредственно связанного с центром хиральности, - чем он больше, тем старше заместитель. Так, группа ОН старше NH2, которая, в свою очередь, старше любой алкильной группы и даже СООН, поскольку в последней с асимметрическим центром связан атом углерода. Если атомные номера оказываются одинаковыми, старшей считается группа, у которой следующий за углеродом атом имеет больший порядковый номер, причем, если этот атом (обычно кислород) связан двойной связью, он учитывается дважды. В результате следующие группы так располагаются в порядке падения старшинства: -СООН > -СН=О > -СН2ОН. Для определения конфигурации тетраэдрическую модель соединения располагают в пространстве так, чтобы самый младший замес- титель (в большинстве случаев это атом водорода) был наиболее удален от наблюдателя. Если старшинство трех остальных заместителей убывает по часовой стрелке, то центру хиральности приписывают R-конфигурацию (рис. 7.4, а), если против часовой стрелки - S -конфигурацию (см. рис. 7.4, б), как это видно водителю, находящемуся за рулем (см. рис. 7.4, в).
Рис. 7.4. Определение конфигурации энантиомеров молочной кислоты по R,S- системе (объяснение в тексте) Для обозначения конфигурации по RS-системе можно применить проекции Фишера. Для этого проекцию преобразуют так, чтобы
|
||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 1597; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.15.15 (0.032 с.) |