
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обработка результатов анализа ⇐ ПредыдущаяСтр 2 из 2
Результаты измерения массы пустого тигля (доведенного до постоянной массы) и тигля с осадком (также доведенного до постоянной массы) заносят в журнал. Рассчитывают массу осадка (m
m Приборы, посуда и реактивы 1) Муфельная печь, с температурой нагрева от 800─900 0С; 2) весы лабораторные рычажные 1 и 2-го классов точности; 3) фарфоровые стаканы для прокаливания (тигли); 4) эксикатор; 5) кальций хлористый, прокаленный при температуре 700─800 0С, для заполнения эксикатора или силикагель; 6) хлорид бария с массовой долей 4 %; 7) нитрат серебра с массовой долей 1 %; 8) азотная кислота, раствор (1: 1); 9) вода дистиллированная; 10) стаканы химические объемом 250 см3; 11) палочки стеклянные; 12) цилиндры мерные объемом 10 и 100 см3; 14) бумага фильтровальная (синяя лента).
Лабораторная работа № 3 «Определение массовой доли Кристаллизационной воды в кристаллогидратах Гравиметрическим методом» Цель работы: освоение основных операций весового анализа и определение содержания воды в кристаллогидрате BaCl2.2H2O или CuSO4.5H2O. Краткая характеристика метода Определение воды в твёрдых веществах – один из наиболее важных случаев определения, так как вода нередко входит в состав анализируемых веществ. Содержание воды определяют как прямыми, так и косвенными методами. Ниже приводится метод определения кристаллизационной воды косвенным методом. Кристаллизационной называется вода, входящая в структуру кристаллов некоторых веществ, называемых кристаллогидратами. Содержание кристаллизационной воды в кристаллогидратах отвечает определённым химическим формулам, например, BaCl2.2H2O, CuSO4.5H2O, Na2SO4.10H2O, Na2SO4.7H2O и т. д. При нагревании кристаллогидраты разлагаются с выделением воды. На этом основано определение содержания кристаллизационной воды в большинстве кристаллогидратов методом отгонки. Так, в данной лабораторной работе навеску BaCl2.2H2O или CuSO4.5H2O, помещённую в бюкс, нагревают до 120–125 0С в сушильном шкафу до тех пор, пока не перестанет изменяться масса вещества (высушивание до постоянной массы). Достижение постоянной массы свидетельствует о том, что вся кристаллизационная вода уже удалена.
Порядок проведения работы Тщательно вымытый бюкс высушивают в сушильном шкафу, не закрывая крышкой, при температуре 120–125 0С в течение 20–30 минут. Затем бюкс охлаждают в эксикаторе и после этого, соблюдая все правила, взвешивают бюкс вместе с крышкой на технохимических весах, а затем на аналитических весах. Во взвешенный бюкс помещают около 1,5 г свежеперекристаллизованного BaCl2.2H2O или 0,5 г CuSO4.5H2O и, закрыв крышкой, снова точно взвешивают на технохимических, а затем на аналитических весах. Открыв бюкс, ставят его на полку сушильного шкафа. Выдерживают бюкс в шкафу при температуре 125±5 0С приблизительно 2 часа. Затем тигельными щипцами переносят бюкс с крышкой в эксикатор, охлаждают 30–40 минут и, закрыв крышкой, точно взвешивают на аналитических весах. Массу бюкса записывают. Обработка результатов анализа Результаты измерения массы пустого бюкса (доведенного до постоянной массы) и бюкса с анализируемым веществом (так же доведенного до постоянной массы) заносят в журнал. Массовую долю кристаллизационной воды (Х) в процентах вычисляют по формуле
где m1 - масса навески вещества с бюксом до высушивания, г; m2 - масса навески вещества с бюксом после высушивания, г; Приборы, посуда и реактивы 1) шкаф сушильный с терморегулятором любого типа, обеспечивающий температуру нагрева 120–125 0С; 2) весы лабораторные рычажные 1 и 2-го классов точности; 3) термометр ртутный стеклянный с ценой деления не более 5 0С; 4) стаканы для взвешивания с крышками (бюксы); 5) эксикатор; 6) кальций хлористый, прокаленный при температуре от 700 до 800 0С, для заполнения эксикатора, или силикагель.
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ОФОРМЛЕНИЮ ОТЧЁТА ПО РАБОТЕ Отчет должен содержать следующие разделы: 1) цель работы; 2) основные теоретические положения, используемые в данной работе; 3) расчетные формулы, уравнения и расчеты по ним; 4) выводы о проделанной работе; 5) решение задач.
КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Сущность гравиметрического анализа. Классификация. Его основные достоинства и недостатки. 2. Кратко охарактеризуйте метод осаждения. Какие вещества можно определять методом осаждения? Приведите пример.
3. Как проводят выбор осадителя в гравиметрическом анализе?
4. Что такое гравиметрический фактор и как он рассчитывается? 5. Чем отличаются условия осаждения кристаллических осадков от аморфных? 6. Как влияет одноимённый ион на растворимость осадка? Изобразите эту зависимость графически. 7. Как влияют электролиты на растворимость осадка? 8. Как зависит растворимость малорастворимого соединения от ионной силы раствора? Приведите формулы для расчёта растворимости осадка. 9. Чем следует промывать кристаллические и аморфные осадки, чтобы избежать потерь при растворимости? 10. Что такое соосаждение? Как можно предотвратить это явление? 11. Что такое адсорбция, окклюзия и инклюзия? К чему приводят эти процессы? 12. Как влияет температура на растворимость осадков и одноимённый ион на растворимость осадков? Изобразите эту зависимость графически. 13. Почему при выделении осадка следует избегать большого избытка осадителя? 14. Укажите важнейшие неорганические осадители, употребляемые для отделения ионов, приведите примеры их применения. 15. Исходя из правила произведения растворимости, сформулируйте условия: 1) образования осадка; 2) растворения осадка. 16. Что такое осаждаемая форма? Весовая форма? Какие требования предъявляются к ним в гравиметрическом анализе? 17. Укажите оптимальные условия осаждения кристаллических осадков. 18. Укажите оптимальные условия осаждения аморфных осадков. 19. Опишите гравиметрическое определение сульфат-ионов в растворе (осадитель, осаждаемая и весовая формы, формулу для расчетов результатов анализа). 20. Как выполняют в гравиметрии операцию фильтрования? Какие фильтры для этого используют? Как их выбирают? 21. Как выполняют в гравиметрии операцию промывания осадков? Как выбирают промывную жидкость? 22. Как выполняют в гравиметрии операцию высушивания и прокаливания осадков? Какое для этого требуется оборудование? 23. Опишите гравиметрическое определение ионов железа в растворе (осадитель, осаждаемая и весовая формы, формулу для расчетов результатов анализа). 24. Сформулируйте правило произведения растворимости. 25. На чём основан метод выделения? Приведите пример. 26. На чём основан метод отгонки? Что такое прямая и косвенная отгонка? 27. Опишите гравиметрическое определение кристаллизационной воды в кристаллогидратах.
ЗАДАЧИ Примеры решения задач Задача 1 Для определения содержания сульфата алюминия взяли 100 см3 этого раствора и осадили сульфат-ион SO42– в виде BaSO4, масса которого оказалась равной 0,2640 г. Рассчитать массу сульфата алюминия в 1 дм3 раствора. Дано: Решение:
Стехиометрический коэффициент для BaSO4 равен трем, так как 1 моль Al2(SO4)3 содержит 3 моль SO42–, которые и могут образовать 3 моль BaSO4. Находим массу сульфата алюминия в 100 см3 раствора:
Масса сульфата алюминия в 1 дм3 раствора (т.е. в 1000 см3) составит:
Задача 2 Вычислить растворимость PbC2O4 в воде. Решение (для нахождения ПР используем справочные данные). При растворении PbC2O4 в воде протекает диссоциация по уравнению:
PbC2O4 ПРPbC2O4= [Pb2+][C2O42-] Если S – растворимость PbC2O4 (моль/л), то S = [Pb2+] = [C2O42-] 5.2 Задачи для самостоятельного решения
1. Сколько алюминия (Al3+) содержалось в анализируемом растворе, если масса гравиметрической формы Al2O3 равна 0,3060 г. 2. Определить процентное содержание серы в образце угля, влажность которого составляет 1,30 %. Для анализа взята воздушно-сухая навеска угля 0,8460 г, после соответствующей обработки получено 0,1025 г BaSO4 (гравиметрическая форма). 3. В растворе сульфата железа (III) железо осадили в виде гидроксида железа (III) и прокалили. Масса прокалённого осадка Fe2O3 оказалась равна 0,3288 г. Написать уравнения реакций и вычислить массу ионов железа в растворе. 4. Для анализа раствора сульфата алюминия взяли 50 см3 и осадили сульфат-ионы в виде сульфата бария. Масса BaSO4 оказалась равной 0,2640 г. Вычислить массовую долю ионов бария в растворе. 5. При анализе навески апатита массой 0,1112 г было получено 0,9926 г осадка (NH4)PO4.12MoO3...Вычислить массовую долю фосфора и Р2О5 в этой пробе. 6. Для анализа взяли 0,1534 г технического сульфата натрия и после обработки хлоридом бария получили 0,2233 г сульфата бария. Рассчитать массовую долю сульфата натрия во влажной и сухой навеске соли, если влажность составляет 4,25 %. 7. Сколько миллилитров 2М раствора серной кислоты надо взять для осаждения свинца из раствора серной кислоты, содержащего 0,5 г нитрата свинца? 8. Навеска известняка 0,5015 г. Анализом установлено, что содержание оксида кальция равно 0,3248 г. Определить содержание кальция в растворе. 9. Образуется ли осадок гидроксида железа (II), если к раствору, содержащему 5.10-3 моль сульфата железа (II), прибавить равный объём 0,5 М раствора гидроксида аммония? 10. Вычислить растворимость Ag2CrO4, а также концентрацию ионов Ag+ и CrO42- в граммах на литр с учётом коэффициентов активности этих ионов. ПР = AgCrO4 =1,2.10-12. 11. Вычислить, сколько граммов серебра содержится в 500 см3 насыщенного раствора фосфата серебра. ПР Ag3PO4 = 1,3 . 10-20. 12. Смешали 500 см3 0,002 М раствора хлорида бария и 500 см3 0,001 М раствора сульфата калия. Выпадет ли в этих условиях осадок сульфата бария? ПР(ВаSO4)=1,1·10-10. 13. Рассчитать растворимость фосфата серебра в 0,02 М растворе фосфата натрия ПР Ag3PO4 =1,3·10-20. 14. В 1 дм3 воды растворяется 0,04892 г иодата серебра. Рассчитать ПР иодата серебра.
ОСНОВНЫЕ ТРЕБОВАНИЯ ТЕХНИКИ БЕЗОПАСНОСТИ
|
|||||||||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 681; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.149.242 (0.033 с.) |
 ) и гравиметрический фактор (F=
) и гравиметрический фактор (F= 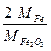 ). Содержание ионов железа рассчитывают по формуле
). Содержание ионов железа рассчитывают по формуле = m
= m 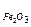 ´. F.
´. F.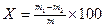 ,
, 

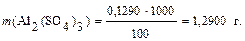
 Pb2+ + C2O42-
Pb2+ + C2O42- = 2,2. 10-5 моль/л.
= 2,2. 10-5 моль/л.


