
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основы гравиметрического метода анализаСтр 1 из 2Следующая ⇒
Н. В. Степанова
ВЕСОВОЙ (ГРАВИМЕТРИЧЕСКИЙ) МЕТОД АНАЛИЗА Методические рекомендации по выполнению лабораторной работы по дисциплине «Аналитическая химия» для студентов специальности 240300 «Химическая технология энергонасыщенных материалов и изделий» направлений подготовки 240700 «Биотехнология» и 260100 «Продукты питания из растительного сырья» всех форм обучения
Бийск Издательство Алтайского государственного технического университета им. И.И.Ползунова УДК 543. 257 Рецензент: профессор, кандидат химических наук Ю.В. Мороженко
Работа подготовлена на кафедре общей химии и экспертизы товаров Степанова, Н.В. Весовой (гравиметрический) метод анализа: методические рекомендации по выполнению лабораторной работы по курсу «Аналитическая химия» для студентов специальности 240300 «Химическая технология энергонасыщенных материалов и изделий» и направлений подготовки 240700 «Биотехнология» и 260100 «Продукты питания из растительного сырья» всех форм обучения / Н.В. Степанова; Алт. гос. техн. ун-т БТИ. – Бийск: Изд-во Алт. гос. техн. ун-та, 2013. – 26с.
В методических рекомендациях приведены теоретические сведения по теме данной лабораторной работы. Изложена методика проведения экспериментов. Для закрепления материала предусмотрены контрольные вопросы и задачи. Работа выполнена в рамках современных требований СМК к изложению и качеству учебно-методического материала. Методические рекомендации составлены в соответствии с государственными стандартами высшего образования указанной специальности и направлений.
УДК 543. 257
Рассмотрены и одобрены на заседании кафедры общей химии и экспертизы товаров Протокол № 4 от 07.03. 2013 г.
Содержание
ВВЕДЕНИЕ Изучение дисциплины «Аналитическая химия» должно способствовать решению следующих задач: - освоению студентами качественных и количественных химических методов анализа для оценки качества и идентификации органических, неорганических веществ, биологически активных веществ и лекарственных препаратов; - изучению теоретических основ методов анализа сырья, готовой продукции и объектов окружающей среды; - получению студентами прочных практических навыков в области физико-химических методов анализа, применяемых при аналитическом контроле производства заводскими лабораториями предприятий важнейших отраслей промышленности и в лабораториях НИИ. Изучение дисциплины «Аналитическая химия» должно способствовать формированию у студентов следующих профессиональных компетенций по видам деятельности. Направление подготовки 240700 «Биотехнология»: - стремиться к саморазвитию, повышению своей квалификации и мастерства, приобретать новые знания в области техники и технологии, математики, естественных, гуманитарных, социальных и экономических наук (ОК-7); - быть способным и готовым использовать основные законы естественнонаучных дисциплин в профессиональной деятельности, применять методы математического анализа и моделирования, теоретического и экспериментального исследования (ПК-1);
- использовать знания о современной физической картине мира, пространственно-временных закономерностях, строении вещества для понимания окружающего мира и явлений природы (ПК-2); - уметь работать с научно-технической информацией, уметь использовать отечественный и зарубежный опыт в профессиональной деятельности, систематизировать и обобщать информацию по использованию ресурсов производства (ПК-6); - владеть планированием эксперимента, обработкой и анализом полученных результатов (ПК-8).
Направление подготовки 260100 «Продукты питания из растительного сырья» - использовать основные законы естественнонаучных дисциплин в профессиональной деятельности, применять методы математического анализа и моделирования, теоретического и экспериментального исследования (ОК-10); - обладать способностью определять и анализировать свойства сырья и полуфабрикатов, влияющие на оптимизацию технологического процесса и качество готовой продукции, ресурсосбережение, эффективность и надежность процессов производства (ПК-4). Специализация 240301 «Химическая технология органических соединений азота», 240302 Химическая технология полимерных композиций, порохов и твердых ракетных топлив» и 240305.65 «Автоматизированное производство химических предприятий» - обладать пониманием экологических и технологических последствий своей профессиональной деятельности, роли охраны окружающей среды и рационального природопользования для сохранения и развития цивилизации (ОК-10); - обладать способностью применять современные методы исследования, проводить стандартные и сертифицированные испытания материалов, изделий и технологических процессов (ПК-21); - обладать способностью планировать и проводить необходимый эксперимент, корректно обрабатывать его результаты и анализировать полученные результаты (ПК-22); - обладать способностью изучать научно-техническую информацию, отечественный и зарубежный опыт по тематике исследований (ПК-23).
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Основы гравиметрического метода анализа
Сущность гравиметрического анализа заключается в том, что взвешиванием на аналитических весах измеряют массу определяемого компонента. Для этого его выделяют либо в виде элемента, либо в виде соединения определенного состава. Гравиметрия является абсолютным методом анализа, так как измеряемый аналитический сигнал сразу же дает количество определяемого компонента при условии полноты превращения и чистоты выделенного вещества. Гравиметрия является наиболее простым, точным, хотя и продолжительным методом анализа. При анализе простых образцов с содержанием определяемого компонента свыше 1 % точность гравиметрического анализа редко удается превзойти с помощью других методов. Гравиметрические методы широко применяются для количественного определения неорганических и органических веществ. Гравиметрические методы подразделяют на методы отгонки, выделения и методы осаждения. В методах отгонки определяемый компонент выделяют из пробы в виде летучего соединения с последующим определением массы отогнанного вещества (прямое определение) или массы остатка (косвенное определение). Поскольку методы отгонки базируются на летучести определяемых компонентов, они не универсальны и малочисленны.
В методе выделения определяемый компонент количественно осаждают в виде простого вещества.
Метод осаждения Оптимальные условия осаждения аморфных осадков Осаждение аморфных осадков необходимо вести из горячих растворов и в присутствии коагулирующего электролита, т.к. они склонны к образованию коллоидных растворов. Для предупреждения явления адсорбции осаждение аморфных осадков следует вести из концентрированных растворов. После окончания осаждения к раствору с осадком необходимо прилить большой объем (до 100 см3) воды и смесь перемешать. При этом часть адсорбционных ионов перейдет в раствор.
Аморфный осадок не рекомендуется оставлять в соприкосновении с раствором, поэтому его отфильтровывают сразу после образования.
Метод выделения и отгонки Метод выделения основан на выделении определяемого компонента из анализируемого вещества и его точном взвешивании. Например, определение золы в твердом топливе. Метод отгонки. В этом методе определяемый компонент выделяют в виде летучего соединения действием кислоты или высокой температуры. Возможны различные варианты этого метода: Прямой метод - определяемый компонент выделяют в виде летучего соединения и поглощают поглотителем, расчёт ведут по изменению массы поглотителя. - отгоняемое вещество отгоняют и отгон (дистиллят) взвешивают. Косвенный метод - вещество взвешивают, совершают отгон и вновь взвешивают. Расчёт производят по уменьшению массы навески. Методом отгонки определяют, например, содержание кристаллизационной воды в кристаллогидратах, если вещество при нагревании не претерпевает других химических изменений, кроме выделения воды: ВаС12. 2Н2О (к) = ВаС12 (к) + 2Н2О (г). Убыль массы исходной навески равна содержанию воды. Метод отгонки применяют также при анализе карбонатов, некоторых нитратов и других соединений, образующих летучие продукты реакции. Содержание анализируемого компонента определяют по уменьшению массы вещества в результате термической обработки или по увеличению массы поглотителя газообразных продуктов реакции
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Порядок проведения работы Рассчитывают, какой объем 4 %-ного раствора хлорида бария нужно взять для осаждения, предполагая, что анализируемый раствор содержит до 0,3 г сульфат-иона. Вычисленный объем раствора хлорида бария увеличивают в 1,3 раза, так как для достижения полноты осаждения достаточно 30 %-ного избытка осадителя. Подготовка фарфоровых тиглей Для выполнения анализа выбирают два фарфоровых тигля. Чистые сухие маркированные тигли с помощью тигельных щипцов помещают в муфельную печь и прокаливают 40 мин при температуре 800 0С. Тигли охлаждают в эксикаторе до комнатной температуры, затем взвешивают. Осаждение сульфата бария В два чистых и подписанных стакана объемом 250−300 см3 наливают для двух параллельных определений раствор серной кислоты. Помещают в каждый стакан стеклянную палочку. Во избежание потерь вещества стеклянную палочку не вынимают из стакана до конца анализа. Анализируемые растворы разбавляют дистиллированной водой примерно до 100 см3 (во избежание разбрызгивания содержимого стаканов воду лить по палочке!), нагревают на водяной бане почти до кипения.
В два стакана объемом 100─200 см3 отмеряют с помощью цилиндра вычисленный объем 4 %-ного раствора хлорида бария. Раствор осадителя разбавляют равным объемом дистиллированной воды и нагревают почти до кипения (не кипятить!). Горячий раствор хлорида бария очень медленно, по каплям приливают к горячему раствору серной кислоты, постоянно перемешивая содержимое стакана стеклянной палочкой (следует избегать касания палочкой стенок и дна стакана!). Раствор осадителя должен литься по палочке, а не падать каплями в середину стакана во избежание разбрызгивания. Не вынимая палоч- ку, стаканы с осажденным сульфатом бария накрывают листом фильтровальной бумаги и оставляют на горячей водяной бане. Приборы, посуда и реактивы 1) муфельная печь с температурой нагрева от 800─900 0 С; 2) весы лабораторные рычажные 1 и 2-го классов точности; 3) фарфоровые стаканы для прокаливания (тигли); 4) эксикатор; 5) кальций хлористый, прокаленный при температуре 700─800 0С, для заполнения эксикатора или силикагель; 7) хлорид бария с массовой долей 4 %; 8) нитрат серебра с массовой долей 1 %; 9) азотная кислота, раствор (1: 1); 10) вода дистиллированная; 11) стаканы химические объемом 250 см3; 12) палочки стеклянные; 13) цилиндры мерные объемом 10 и 100 см3. Порядок проведения работы Анализируемый раствор, содержащий до 0,0500 г железа, помещается в химический стакан емкостью 100─150 см3, в котором он подкисляется 15─20 каплями HNO3 и нагревается до кипения для перевода Fe2+ в Fe3+, далее раствор разбавляется 25 см3 воды и снова нагревается до начала кипения. Одновременно с этим в стакане емкостью 100─150 см 3 нагревают до кипения раствор нитрата аммония (NH4NO3). Затем горячий анализируемый раствор быстро нейтрализуют концентрированным раствором аммиака (NH4OH) до темно-красного окрашивания раствора.
Далее осторожно по каплям при постоянном помешивании стеклянной палочкой прибавляют 10 %-ный раствор NH4OH до остающегося едва различимого запаха избытка раствора аммиака. В случае полного осаждения железа, если прекратить размешивание, будет наблюдаться хорошее отстаивание осадка от раствора и отстоявшаяся жидкость над осадком будет бесцветна. Нейтрализацию прекращают и к анализируемому раствору с осадком добавляют от 30 до 40 см3 горячего раствора NH4NO3, перемешивают стеклянной палочкой и перед фильтрованием дают отстояться 5─7 минут. Осадок отфильтровывают через фильтр с красной или белой лентой диаметром 7 см. На фильтре осадок промывают горячим раствором NH4NO3 до исчезновения в пробе фильтрата Cl-. Затем осадок вместе с фильтром помещают во взвешенный фарфоровый тигель, осторожно на электрической плитке подсушивают его, озоляют и прокаливают в муфельной печи при температуре 800─900 0C до постоянной массы. Исходя из массы диоксида железа, рассчитывают массу ионов железа, содержащихся в анализируемом растворе. Приборы, посуда и реактивы 1) Муфельная печь, с температурой нагрева от 800─900 0С; 2) весы лабораторные рычажные 1 и 2-го классов точности; 3) фарфоровые стаканы для прокаливания (тигли); 4) эксикатор; 5) кальций хлористый, прокаленный при температуре 700─800 0С, для заполнения эксикатора или силикагель; 6) хлорид бария с массовой долей 4 %; 7) нитрат серебра с массовой долей 1 %; 8) азотная кислота, раствор (1: 1); 9) вода дистиллированная; 10) стаканы химические объемом 250 см3; 11) палочки стеклянные; 12) цилиндры мерные объемом 10 и 100 см3; 14) бумага фильтровальная (синяя лента).
Гравиметрическим методом» Цель работы: освоение основных операций весового анализа и определение содержания воды в кристаллогидрате BaCl2.2H2O или CuSO4.5H2O. Порядок проведения работы Тщательно вымытый бюкс высушивают в сушильном шкафу, не закрывая крышкой, при температуре 120–125 0С в течение 20–30 минут. Затем бюкс охлаждают в эксикаторе и после этого, соблюдая все правила, взвешивают бюкс вместе с крышкой на технохимических весах, а затем на аналитических весах. Во взвешенный бюкс помещают около 1,5 г свежеперекристаллизованного BaCl2.2H2O или 0,5 г CuSO4.5H2O и, закрыв крышкой, снова точно взвешивают на технохимических, а затем на аналитических весах. Открыв бюкс, ставят его на полку сушильного шкафа. Выдерживают бюкс в шкафу при температуре 125±5 0С приблизительно 2 часа. Затем тигельными щипцами переносят бюкс с крышкой в эксикатор, охлаждают 30–40 минут и, закрыв крышкой, точно взвешивают на аналитических весах. Массу бюкса записывают. Приборы, посуда и реактивы 1) шкаф сушильный с терморегулятором любого типа, обеспечивающий температуру нагрева 120–125 0С; 2) весы лабораторные рычажные 1 и 2-го классов точности; 3) термометр ртутный стеклянный с ценой деления не более 5 0С; 4) стаканы для взвешивания с крышками (бюксы); 5) эксикатор; 6) кальций хлористый, прокаленный при температуре от 700 до 800 0С, для заполнения эксикатора, или силикагель.
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ОФОРМЛЕНИЮ ОТЧЁТА ПО РАБОТЕ Отчет должен содержать следующие разделы: 1) цель работы; 2) основные теоретические положения, используемые в данной работе; 3) расчетные формулы, уравнения и расчеты по ним; 4) выводы о проделанной работе; 5) решение задач.
КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Сущность гравиметрического анализа. Классификация. Его основные достоинства и недостатки. 2. Кратко охарактеризуйте метод осаждения. Какие вещества можно определять методом осаждения? Приведите пример. 3. Как проводят выбор осадителя в гравиметрическом анализе?
4. Что такое гравиметрический фактор и как он рассчитывается? 5. Чем отличаются условия осаждения кристаллических осадков от аморфных? 6. Как влияет одноимённый ион на растворимость осадка? Изобразите эту зависимость графически. 7. Как влияют электролиты на растворимость осадка? 8. Как зависит растворимость малорастворимого соединения от ионной силы раствора? Приведите формулы для расчёта растворимости осадка. 9. Чем следует промывать кристаллические и аморфные осадки, чтобы избежать потерь при растворимости? 10. Что такое соосаждение? Как можно предотвратить это явление? 11. Что такое адсорбция, окклюзия и инклюзия? К чему приводят эти процессы? 12. Как влияет температура на растворимость осадков и одноимённый ион на растворимость осадков? Изобразите эту зависимость графически. 13. Почему при выделении осадка следует избегать большого избытка осадителя? 14. Укажите важнейшие неорганические осадители, употребляемые для отделения ионов, приведите примеры их применения. 15. Исходя из правила произведения растворимости, сформулируйте условия: 1) образования осадка; 2) растворения осадка. 16. Что такое осаждаемая форма? Весовая форма? Какие требования предъявляются к ним в гравиметрическом анализе? 17. Укажите оптимальные условия осаждения кристаллических осадков. 18. Укажите оптимальные условия осаждения аморфных осадков. 19. Опишите гравиметрическое определение сульфат-ионов в растворе (осадитель, осаждаемая и весовая формы, формулу для расчетов результатов анализа). 20. Как выполняют в гравиметрии операцию фильтрования? Какие фильтры для этого используют? Как их выбирают? 21. Как выполняют в гравиметрии операцию промывания осадков? Как выбирают промывную жидкость? 22. Как выполняют в гравиметрии операцию высушивания и прокаливания осадков? Какое для этого требуется оборудование? 23. Опишите гравиметрическое определение ионов железа в растворе (осадитель, осаждаемая и весовая формы, формулу для расчетов результатов анализа). 24. Сформулируйте правило произведения растворимости. 25. На чём основан метод выделения? Приведите пример. 26. На чём основан метод отгонки? Что такое прямая и косвенная отгонка? 27. Опишите гравиметрическое определение кристаллизационной воды в кристаллогидратах.
ЗАДАЧИ Примеры решения задач Задача 1 Для определения содержания сульфата алюминия взяли 100 см3 этого раствора и осадили сульфат-ион SO42– в виде BaSO4, масса которого оказалась равной 0,2640 г. Рассчитать массу сульфата алюминия в 1 дм3 раствора. Дано: Решение:
Стехиометрический коэффициент для BaSO4 равен трем, так как 1 моль Al2(SO4)3 содержит 3 моль SO42–, которые и могут образовать 3 моль BaSO4. Находим массу сульфата алюминия в 100 см3 раствора:
Масса сульфата алюминия в 1 дм3 раствора (т.е. в 1000 см3) составит:
Задача 2 Вычислить растворимость PbC2O4 в воде. Решение (для нахождения ПР используем справочные данные). При растворении PbC2O4 в воде протекает диссоциация по уравнению: PbC2O4 ПРPbC2O4= [Pb2+][C2O42-] Если S – растворимость PbC2O4 (моль/л), то S = [Pb2+] = [C2O42-] 5.2 Задачи для самостоятельного решения
1. Сколько алюминия (Al3+) содержалось в анализируемом растворе, если масса гравиметрической формы Al2O3 равна 0,3060 г. 2. Определить процентное содержание серы в образце угля, влажность которого составляет 1,30 %. Для анализа взята воздушно-сухая навеска угля 0,8460 г, после соответствующей обработки получено 0,1025 г BaSO4 (гравиметрическая форма). 3. В растворе сульфата железа (III) железо осадили в виде гидроксида железа (III) и прокалили. Масса прокалённого осадка Fe2O3 оказалась равна 0,3288 г. Написать уравнения реакций и вычислить массу ионов железа в растворе. 4. Для анализа раствора сульфата алюминия взяли 50 см3 и осадили сульфат-ионы в виде сульфата бария. Масса BaSO4 оказалась равной 0,2640 г. Вычислить массовую долю ионов бария в растворе. 5. При анализе навески апатита массой 0,1112 г было получено 0,9926 г осадка (NH4)PO4.12MoO3...Вычислить массовую долю фосфора и Р2О5 в этой пробе. 6. Для анализа взяли 0,1534 г технического сульфата натрия и после обработки хлоридом бария получили 0,2233 г сульфата бария. Рассчитать массовую долю сульфата натрия во влажной и сухой навеске соли, если влажность составляет 4,25 %. 7. Сколько миллилитров 2М раствора серной кислоты надо взять для осаждения свинца из раствора серной кислоты, содержащего 0,5 г нитрата свинца? 8. Навеска известняка 0,5015 г. Анализом установлено, что содержание оксида кальция равно 0,3248 г. Определить содержание кальция в растворе. 9. Образуется ли осадок гидроксида железа (II), если к раствору, содержащему 5.10-3 моль сульфата железа (II), прибавить равный объём 0,5 М раствора гидроксида аммония? 10. Вычислить растворимость Ag2CrO4, а также концентрацию ионов Ag+ и CrO42- в граммах на литр с учётом коэффициентов активности этих ионов. ПР = AgCrO4 =1,2.10-12. 11. Вычислить, сколько граммов серебра содержится в 500 см3 насыщенного раствора фосфата серебра. ПР Ag3PO4 = 1,3 . 10-20. 12. Смешали 500 см3 0,002 М раствора хлорида бария и 500 см3 0,001 М раствора сульфата калия. Выпадет ли в этих условиях осадок сульфата бария? ПР(ВаSO4)=1,1·10-10. 13. Рассчитать растворимость фосфата серебра в 0,02 М растворе фосфата натрия ПР Ag3PO4 =1,3·10-20. 14. В 1 дм3 воды растворяется 0,04892 г иодата серебра. Рассчитать ПР иодата серебра. ОСНОВНЫЕ ТРЕБОВАНИЯ ТЕХНИКИ БЕЗОПАСНОСТИ ЛИТЕРАТУРА 1. Аналитическая химия. В 3 т. Т.1 Методы идентификации и определения веществ: учеб. для студ. вузов /А. А. Белюстин [и др.]; под ред. Л. Н. Москвина. – М: Издательский центр Академия», 2008. - 576 с. 2. Васильев, В. П. Аналитическая химия. В 2 кн. Кн. 1. Аналитическая химияя / В. П. Васильев. – М: Дрофа, 2003. - 384 с. 3. Основы аналитической химии /под ред. Ю. А. Золотова.—М.: Химия, 1999. — Кн. 1-2. - 380 с. 4. Кунце, У., Основы качественного и количественного анализа./У. Кунце, Г. Шведт. – М.: Мир,1997. - 424 с.
Министерство образования и науки РФ Бийский технологический институт (филиал) федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Алтайский государственный технический университет Им. И.И. Ползунова»
Н. В.Степанова
ВЕСОВОЙ (ГРАВИМЕТРИЧЕСКИЙ) МЕТОД АНАЛИЗА Методические рекомендации по выполнению лабораторной работы по дисциплине «Аналитическая химия» для студентов специальности 240300 «Химическая технология энергонасыщенных материалов и изделий» направлений подготовки 240700 «Биотехнология» и 260100 «Продукты питания из растительного сырья» всех форм обучения
Автор Н. В.Степанова Зав. кафедрой……………………...…………....А.Л. Верещагин
Председатель ФК МКО………………..………В.В. Еремина
Нормоконтролер………………............……….Е.А. Морозова
Зав. библиотекой……………………….……….О.В. Перышкина
Редактор…………………….…………………...
Первый зам. директора по УР…………..… ….В.А. Харитонов Бийск Издательство Алтайского государственного технического университета им. И.И. Ползунова Н. В. Степанова
ВЕСОВОЙ (ГРАВИМЕТРИЧЕСКИЙ) МЕТОД АНАЛИЗА Методические рекомендации по выполнению лабораторной работы по дисциплине «Аналитическая химия» для студентов специальности 240300 «Химическая технология энергонасыщенных материалов и изделий» направлений подготовки 240700 «Биотехнология» и 260100 «Продукты питания из растительного сырья» всех форм обучения
Бийск Издательство Алтайского государственного технического университета им. И.И.Ползунова УДК 543. 257 Рецензент: профессор, кандидат химических наук Ю.В. Мороженко
Работа подготовлена на кафедре общей химии и экспертизы товаров Степанова, Н.В. Весовой (гравиметрический) метод анализа: методические рекомендации по выполнению лабораторной работы по курсу «Аналитическая химия» для студентов специальности 240300 «Химическая технология энергонасыщенных материалов и изделий» и направлений подготовки 240700 «Биотехнология» и 260100 «Продукты питания из растительного сырья» всех форм обучения / Н.В. Степанова; Алт. гос. техн. ун-т БТИ. – Бийск: Изд-во Алт. гос. техн. ун-та, 2013. – 26с.
В методических рекомендациях приведены теоретические сведения по теме данной лабораторной работы. Изложена методика проведения экспериментов. Для закрепления материала предусмотрены контрольные вопросы и задачи. Работа выполнена в рамках современных требований СМК к изложению и качеству учебно-методического материала. Методические рекомендации составлены в соответствии с государственными стандартами высшего образования указанной специальности и направлений.
УДК 543. 257
Рассмотрены и одобрены на заседании кафедры общей химии и экспертизы товаров Протокол № 4 от 07.03. 2013 г.
Содержание
ВВЕДЕНИЕ Изучение дисциплины «Аналитическая химия» должно способствовать решению следующих задач: - освоению студентами качественных и количественных химических методов анализа для оценки качества и идентификации органических, неорганических веществ, биологически активных веществ и лекарственных препаратов; - изучению теоретических основ методов анализа сырья, готовой продукции и объектов окружающей среды; - получению студентами прочных практических навыков в области физико-химических методов анализа, применяемых при аналитическом контроле производства заводскими лабораториями предприятий важнейших отраслей промышленности и в лабораториях НИИ. Изучение дисциплины «Аналитическая химия» должно способствовать формированию у студентов следующих профессиональных компетенций по видам деятельности. Направление подготовки 240700 «Биотехнология»: - стремиться к саморазвитию, повышению своей квалификации и мастерства, приобретать новые знания в области техники и технологии, математики, естественных, гуманитарных, социальных и экономических наук (ОК-7); - быть способным и готовым использовать основные законы естественнонаучных дисциплин в профессиональной деятельности, применять методы математического анализа и моделирования, теоретического и экспериментального исследования (ПК-1); - использовать знания о современной физической картине мира, пространственно-временных закономерностях, строении вещества для понимания окружающего мира и явлений природы (ПК-2); - уметь работать с научно-технической информацией, уметь использовать отечественный и зарубежный опыт в профессиональной деятельности, систематизировать и обобщать информацию по использованию ресурсов производства (ПК-6); - владеть планированием эксперимента, обработкой и анализом полученных результатов (ПК-8).
Направление подготовки 260100 «Продукты питания из растительного сырья» - использовать основные законы естественнонаучных дисциплин в профессиональной деятельности, применять методы математического анализа и моделирования, теоретического и экспериментального исследования (ОК-10); - обладать способностью определять и анализировать свойства сырья и полуфабрикатов, влияющие на оптимизацию технологического процесса и качество готовой продукции, ресурсосбережение, эффективность и надежность процессов производства (ПК-4). Специализация 240301 «Химическая технология органических соединений азота», 240302 Химическая технология полимерных композиций, порохов и твердых ракетных топлив» и 240305.65 «Автоматизированное производство химических предприятий» - обладать пониманием экологических и технологических последствий своей профессиональной деятельности, роли охраны окружающей среды и рационального природопользования для сохранения и развития цивилизации (ОК-10); - обладать способностью применять современные методы исследования, проводить стандартные и сертифицированные испытания материалов, изделий и технологических процессов (ПК-21); - обладать способностью планировать и проводить необходимый эксперимент, корректно обрабатывать его результаты и анализировать полученные результаты (ПК-22); - обладать способностью изучать научно-техническую информацию, отечественный и зарубежный опыт по тематике исследований (ПК-23).
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Основы гравиметрического метода анализа
Сущность гравиметрического анализа заключается в том, что взвешиванием на аналитических весах измеряют массу определяемого компонента. Для этого его выделяют либо в виде элемента, либо в виде соединения определенного состава. Гравиметрия является абсолютным методом анализа, так как измеряемый аналитический сигнал сразу же дает количество определяемого компонента при условии полноты превращения и чистоты выделенного вещества. Гравиметрия является наиболее простым, точным, хотя и продолжительным методом анализа. При анализе простых образцов с содержанием определяемого компонента свыше 1 % точность гравиметрического анализа редко удается превзойти с помощью других методов. Гравиметрические методы широко применяются для количественного определения неорганических и органических веществ. Гравиметрические методы подразделяют на методы отгонки, выделения и методы осаждения. В методах отгонки определяемый компонент выделяют из пробы в виде летучего соединения с последующим определением массы отогнанного вещества (прямое определение) или массы остатка (косвенное определение). Поскольку методы отгонки базируются на летучести определяемых компонентов, они не универсальны и малочисленны. В методе выделения определяемый компонент количественно осаждают в виде простого вещества.
Метод осаждения
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 862; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.110.119 (0.217 с.) |

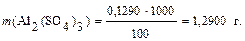
 Pb2+ + C2O42-
Pb2+ + C2O42- = 2,2. 10-5 моль/л.
= 2,2. 10-5 моль/л.


