
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослідження процесів корозії металів та методів захисту від корозії ⇐ ПредыдущаяСтр 6 из 6 7.1 Мета роботи
Вивчити корозійну стійкість ряду металів та освоїти теорію фізико-хімічного пояснення досліджуваних процесів.
7.2 Методичні вказівки з організації самостійної роботи студентів
У плівкових та напівпровідникових мікросхемах широко застосовуються різноманітні метали з високою електричною провідністю: Au, Ag, Cu, Al, причому останній здебільшого для внутрішніх сполук. Для матеріалів резистивних плівок перевагу віддають танталу, ніхрому, хромосиліцидам та іншим сплавам на основі хрому і танталу. Деякі з названих металів є корозійностійкими внаслідок їх високого окислювально-відновлювального потенціалу, інші – через самочинне утворення пасивуючих окислених плівок на їх поверхні (Au, Ni, Cr, Ta). Однак при контакті резисторів з цих металів та алюмінію не можна уникнути виникнення гальванічних пар Cr-Al, Ni-Al та ін., що надзвичайно чутливі до будь-якого забруднення. Таким забрудненням можуть бути: залишок вологи, слід кисню та деякі хімічні речовини, які виділяються зі стінок корпуса та захисного покриття при технологічних операціях герметизації та захисту схеми. В результаті електрохімічної корозії алюміній в місці контакту руйнується, що призводить до розриву електричного ланцюга. Тому особливої уваги слід надати підбору резистивних та контактних матеріалів, режиму експлуатації інтегральних мікросхем і технології їх виготовлення, з корозією пов’язано також і питання про несумісність матеріалів в електроніці. Корозією (від лат. сorrodere – роз'їдати) називається процес руйнування металу внаслідок хімічної або електрохімічної взаємодії з навколишнім середовищем. Класифікація корозії ведеться за такими ознаками: за механізмом процесу, умовами корозії та видами корозійного руйнування. За механізмом протікання корозійних процесів розрізняють хімічну та електрохімічну корозію. За умовами протікання корозія поділяється на такі види: атмосферна, ґрунтова, у морській та річковій воді, газова, корозія під напруженням тощо. Таким чином, класифікація корозії за умовами протікання характеризує те середовище, в якому працює дана металева конструкція або прилад. Деякі з названих видів корозії можуть мати різновиди, наприклад, атмосферна корозія може відбуватися в умовах помірної або високої вологості, нормальної або підвищеної температури повітря. За видом корозійних руйнувань розрізняють суцільну та місцеву корозію. Остання, в свою чергу, поділяється на вибіркову, міжкристалічну, точкову, щілинну тощо. Місцеву корозію виявити складніше, тому вона являє більшу небезпеку. Хімічна корозія – це руйнування металу внаслідок його взаємодії з середовищем, яке не проводить електричний струм. Під час хімічної корозії електрони від атома металу переходять безпосередньо до окисника:
2FeО + OО2 = 2Fe+2O-2
Хімічна корозія буває двох видів - газова та корозія в рідинах-неелектролітах. Газова корозія.відбувається в газах при високих температурах. У більшості випадків це гази, що містять кисень - сухе повітря, вуглекислий газ, чистий кисень. Газова корозія виникає в камерах згоряння, газових турбінах, при термічній обробці, у нагрівальних елементах тощо. Під впливом гарячих газів відбувається окислення металу з утворенням на його поверхні плівки з продуктів реакції, що називається окалиною. Окалина уповільнює подальше окислення, тобто має захисні властивості. Швидкість окислення значною мірою залежить від захисних властивостей поверхневих оксидів. Розсипчаста плівка залишає вільним доступ кисню до поверхні металу і майже не перешкоджає корозії. Щільні оксиди, що мають добре зчеплення з металом і однаковий з ним коефіцієнт лінійного розширення, мають високі захисні властивості. Здатність металу протистояти газовій корозії називається жаростійкістю. Електрохімічною корозією називається процес взаємодії металу з корозійним середовищем (розчином електроліту), при якому іонізація атомів металу та відновлення окислювальних компонентів середовища відбувається не в одному акті, а швидкості цих процесів залежать від електродного потенціалу металу. Для виникнення електрохімічної корозії необхідна наявність двох різних металів, що знаходяться в розчині електроліту і мають контакт між собою. Реакції, що відбуваються при електрохімічній корозії, аналогічні процесам у гальванічному елементі: окислення і розчинення металу анода і відновлення компонентів середовища на катоді. Гальванічна пара може бути утворена не лише двома металами, а й окремими ділянками одного металу, чи сплаву. Потенціал електродів у процесі корозії не залишається постійним: потенціал анода зростає, катода - знижується. Різниця потенціалів між анодом і катодом при цьому зменшується, окислення металу анода уповільнюється. Зміна потенціалу електрода внаслідок протікання через нього електричного струму називається поляризацією. Анодна поляризація пов'язана із зростанням концентрації катіонів металу в приелектродній зоні, утворенням на поверхні електрода шару продуктів корозії і, нарешті, різницею швидкостей руху електронів та іонів. Катодна поляризація також обумовлена різницею швидкостей заряджених часток і, крім того, накопиченням на поверхні катода реагентів, наприклад, бульбашок водню. Поляризація сприяє зниженню швидкості корозії. Процеси, що перешкоджають поляризації, називаються деполяризацією. Відновлення іонів водню на катоді називається водневою деполяризацією, відновлення іонів кисню – кисневою. Усі фактори, що сприяють деполяризації (розчинення атмосферного кисню в електроліті, наявність іонів водню в розчині, перемішування електроліту, механічне очищення анода від продуктів корозії, підвищення температури та ін.) посилюють процеси корозії. Вплив зовнішніх та внутрішніх факторів на швидкість корозійного руйнування необхідно враховувати при розробці методів захисту металів від корозії. Здатність металу протистояти корозії називається корозійною стійкістю. Високу корозійну стійкість мають благородні метали, які мають високі значення електродного потенціалу. Деякі інші метали внаслідок високої анодної поляризації утворюють на поверхні захисні оксидні плівки і переходять у пасивний стан (явище пасивації). Здатність переходити в пасивний стан характерна для багатьох технічних металів що пасивуються в окислювальному середовищі і навіть самочинно в повітрі. Найбільш схильні до самопасивації в повітрі титан, алюміній, хром, але вони не зберігають пасивний стан у середовищах, що містять мало кисню і багато іонів хлору (вологий грунт, морська вода, неокислюючі кислоти). У тих випадках, коли природної корозійної стійкості металів недостатньо, застосовують методи захисту від корозії. До найважливіших методів захисту металів від електрохімічної корозії належать легування, нанесення захисних покриттів, електрохімічний захист, обробка корозійного середовища, раціональне конструювання металевих виробів та комбіновані методи.
7.3 Порядок виконання роботи і методичні вказівки з її виконання
Д о с л і д 1. Вивчити витискування свинцю цинком із розчину свинцевої солі. Крихітний шматок цинку треба опустити в розчин ацетату свинцю. Залишити розчин в спокійному стані та спостерігати на цинку появу губчастої маси – темно-сірого кольору кристалів свинцю:
Д о с л і д 2. Вивчити виникнення мікрогальванічних пар. Крихітний шматок цинку опустити в пробірку і додати сірчаної кислоти /1:4/. Звернути увагу на повільне виділення водню. Потім у пробірку долити невелику кількість розчину сульфату міді. Спостерігати: 1. Прискорення виділення водню внаслідок утворення мікрогальванічної пари:
2. Виділення водню буде на міді. У цьому процесі мають місце такі реакції:
Д о с л і д 3. Вивчити активізуючу дію іонів. У дві пробірки треба помістити по шматочку алюмінієвого дроту і додати до них розчину сульфату міді, підкисленого сірчаною кислотою.
До другої пробірки додати кілька крапель NaCl. У цьому випадку спостерігатимемо більш інтенсивне протікання реакції, тому що іони хлору є активаторами корозії: При проведенні досліду мають місце реакції:
Утворюється мікрогальванічна пара:
Д о с л і д 4. Вивчити корозію з водневою деполяризацією. Треба скласти гальванічний елемент з цинкової та мідної пластин – електродів, занурених в 1 М розчин
Скласти зовнішній ланцюг, з’єднуючи цинковий та мідний електроди через вольтметр. Відразу після занурення пластин в розчин сірчаної кислоти записати показання вольтметра. Через деякий час спостерігати зменшення електрорушійної сили внаслідок зміни потенціалу мідного електрода. Цей процес має назву корозія з водневою деполяризацією:
Д о с л і д 5. Вивчити корозію з кисневою деполяризацією. Для цього досліду треба скласти гальванічний елемент, аналогічний описаному в досліді 4, але як електроліт слід взяти 1 М розчин NaCl.
Схема гальванічного ланцюга:
Записати показання вольтметра і спостерігати зменшення з часом електрорушійної сили.
Механізм корозії в нейтральному середовищі має назву корозія з кисневою деполяризацією:
Д о с л і д 6. Вивчити реакції, які обумовлюють анодні та катодні покриття. У дві пробірки з 3% розчином NaCl, до якого додано декілька крапель розчину В першому випадку руйнуватиметься цинк. Схема гальванічного елемента:
В другому випадку руйнуватиметься залізо. Схема гальванічного елемента:
Залізо тут є анодом. Іони заліза будуть виявлені з допомогою червоної кров’яної солі за появою синього забарвлення:
Д о с л і д 7. Вивчити вплив інгібіторів корозії. Налити в три пробірки по 2 мл 1 н розчину хлористоводневої кислоти. В одну з пробірок покласти шматочок цинку, а в другу – залізні стружки, в третю – шматочок алюмінію. Коли виділення водню стане інтенсивним, треба додати в кожну пробірку трохи уротропіну:
Спостерігати ефект сповільнення корозії після розчинення інгібітора.
7.4 Контрольні запитання та завдання
1. Що таке корозія металів? 2. Сформулюйте відмінні ознаки хімічної корозії від електрохімічної. 3. Поясніть механізм корозійних руйнувань з водневою та кисневою деполяризацією. 4. Що таке анодне та катодне покриття? 5. Що являють собою інгібітори? 6. Які методи захисту від корозії ще існують?
ПЕРЕЛІК ПОСИЛАНЬ
1. Киреев В.А. Курс физической химии. – М.: Химия, 1975 – 775 с. 2. Практикум по физической химии / Под ред. С.В.Горбачева. – М.: Высшая школа, 1975. – 465 с. 3. Краткий справочник физико-химических величин / Под ред. А.А. Равделя, А.Н.Пономаревой. – Л.: Химия, 1983. – 200 с. 4. Левант Г.К., Райцын Г.А. Практикум по общей химии. – М.: Высшая школа, 1971. – 336 с. 5. Харин А.Н., Катаева Н.А., Харина Л.Т. Курс химии. – М.: Высшая школа, 1983. – 511 с. 6. Глинка Н.Л. Общая химия. – Л.: Химия, 1973. – 728 с.
Електронне видання
Методичні вказівки до лабораторних робіт з дисципліни «ФІЗИЧНА ХІМІЯ» для студентів денної та заочної форм навчання за напрямками: 6.050801 – «Мікро-та наноелектроніка» та 6.050802 – «Електронні пристрої та системи»
Упорядники: АФАНАСЬЄВА Ольга Валентинівна ФЕДОРЕНКО Євгенія Петрівна
Відповідальний випусковий Ю.П.Мачехін
Авторська редакція
|
|||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 246; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.15.149 (0.004 с.) |
 2е
2е

 .
.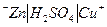 .
.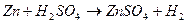 ;
; ;
; ;
; .
. ;
; .
. .
. :
: .
.





 .
.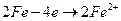



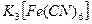 , занурити зразки оцинкованого та вилудженого заліза, передчасно зробивши на їх поверхні в деяких місцях глибокі подряпини.
, занурити зразки оцинкованого та вилудженого заліза, передчасно зробивши на їх поверхні в деяких місцях глибокі подряпини. .
. .
. .
.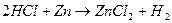

 .
.


