
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення концентрації розчинуСтр 1 из 6Следующая ⇒
Харківський національний університет радіоелектроніки
МЕТОДИЧНІ ВКАЗІВКИ До лабораторних робіт з дисципліни “ФІЗИЧНА ХІМІЯ ”
Електронне видання
Харків 2014 Міністерство освіти і науки України Харківський національний університет радіоелектроніки
МЕТОДИЧНІ ВКАЗІВКИ до лабораторних робіт з дисципліни “ФІЗИЧНА ХІМІЯ ” для студентів денної та заочної форм навчання за напрямками 6.050801 – «Мікро- та наноелектроніка» та 6.050802 – «Електронні пристрої та ситеми»
Електронне видання
Затверджено кафедрою фізичних основ електронної техніки. Протокол № 7 від 16.01.14.
Харків 2014
Методичні вказівки до лабораторних робіт з дисципліни “ФІЗИЧНА ХІМІЯ ” для студентів денної та заочної форм навчання за напрямками 6.050801 – «Мікро- та наноелектроніка» та 6.050802 – «Електронні пристрої та системи»/Упоряд.: О.В. Афанасьєва, Є.П. Федоренко. – Харків: ХНУРЕ, 2014. – 32 с.
Упорядники: О.В. Афанасьєва Є.П. Федоренко
Рецензент к.ф.-м. наук. проф. Черняков Е.І.
ЗМІСТ
Вступ…………………………………………………......................... 3 1 Визначення концентрації розчину………………………………. 5 2 Рефрактометричне дослідження будови молекул………………. 7 3 Визначення поверхневого натягу рідини…………………….…. 10 4 Дослідження процесів адсорбційного очищення речовин............ 12 5 Дослідження електрорушійної сили гальванічних елементів....... 15 6 Електрометричне визначення рН………………………………... 22 7 Дослідження процесів корозії та методи захисту від неї...............26 Перелік посилань……………………………………………………. 31
ВСТУП
Фізична хімія– це фундамент для ряду наступних дисциплін, які вивчають студенти денної форми навчання за напрямками 6.050801 – «Мікро- та наноелектроніка» та 6.050802 –«Електронні пристрої та системи». За програмою навчання студенти першого курсу виконують шість лабораторних робіт, по чотири години кожна. Лабораторні роботи дозволяють розширити та закріпити теоретичні знання з курсу, оволодіти навичками самостійного проведення експерименту, вчаться правильно обробляти отримані результати та проводити їх роз’яснення на базі фундаментальних законів.
Кожній лабораторній роботі повинна передувати самостійна підготовка, у процесі якої студент знайомиться з порядком проведення роботи, рекомендованими літературними джерелами. Після загальної теоретичної підготовки необхідно оформити звіт, у якому повинні знайти відображення головні теоретичні положення, схеми експериментальної установки. У звіті треба накреслити таблиці, куди будуть занесені результати проведених експериментів. Схеми та рисунки слід виконувати з урахуванням вимог ЄСКД. Викладач перевіряє знання кожного студента до початку виконання експериментальної частини лабораторної роботи. Відповідаючи на запитання викладача, студент повинен викласти мету та порядок виконання роботи, показати вміння користуватися вимірювальною апаратурою, зробити теоретичні розрахунки та відповісти на контрольні запитання. При незадовільній підготовці до заняття студент може бути недопущений до виконання роботи. Перед виконанням лабораторних робіт студенти повинні пройти інструктаж з техніки безпеки. Виконуючи експериментальні дослідження, необхідно додержуватися умов виконання роботи та вимог техніки безпеки, дбайливо ставитися до обладнання. Отримані результати треба довести викладачу. Перед початком наступної лабораторної роботи слід подати викладачу звіт попередньої роботи. Залік з лабораторних робіт студент одержує у разі виконання усіх завдань.
Харківський національний університет радіоелектроніки
МЕТОДИЧНІ ВКАЗІВКИ До лабораторних робіт з дисципліни “ФІЗИЧНА ХІМІЯ ”
Електронне видання
Харків 2014 Міністерство освіти і науки України Харківський національний університет радіоелектроніки
МЕТОДИЧНІ ВКАЗІВКИ до лабораторних робіт з дисципліни “ФІЗИЧНА ХІМІЯ ” для студентів денної та заочної форм навчання за напрямками 6.050801 – «Мікро- та наноелектроніка» та 6.050802 – «Електронні пристрої та ситеми»
Електронне видання
Затверджено кафедрою фізичних основ електронної техніки. Протокол № 7 від 16.01.14.
Харків 2014
Методичні вказівки до лабораторних робіт з дисципліни “ФІЗИЧНА ХІМІЯ ” для студентів денної та заочної форм навчання за напрямками 6.050801 – «Мікро- та наноелектроніка» та 6.050802 – «Електронні пристрої та системи»/Упоряд.: О.В. Афанасьєва, Є.П. Федоренко. – Харків: ХНУРЕ, 2014. – 32 с.
Упорядники: О.В. Афанасьєва Є.П. Федоренко
Рецензент к.ф.-м. наук. проф. Черняков Е.І.
ЗМІСТ
Вступ…………………………………………………......................... 3 1 Визначення концентрації розчину………………………………. 5 2 Рефрактометричне дослідження будови молекул………………. 7 3 Визначення поверхневого натягу рідини…………………….…. 10 4 Дослідження процесів адсорбційного очищення речовин............ 12 5 Дослідження електрорушійної сили гальванічних елементів....... 15 6 Електрометричне визначення рН………………………………... 22 7 Дослідження процесів корозії та методи захисту від неї...............26 Перелік посилань……………………………………………………. 31
ВСТУП
Фізична хімія– це фундамент для ряду наступних дисциплін, які вивчають студенти денної форми навчання за напрямками 6.050801 – «Мікро- та наноелектроніка» та 6.050802 –«Електронні пристрої та системи». За програмою навчання студенти першого курсу виконують шість лабораторних робіт, по чотири години кожна. Лабораторні роботи дозволяють розширити та закріпити теоретичні знання з курсу, оволодіти навичками самостійного проведення експерименту, вчаться правильно обробляти отримані результати та проводити їх роз’яснення на базі фундаментальних законів. Кожній лабораторній роботі повинна передувати самостійна підготовка, у процесі якої студент знайомиться з порядком проведення роботи, рекомендованими літературними джерелами. Після загальної теоретичної підготовки необхідно оформити звіт, у якому повинні знайти відображення головні теоретичні положення, схеми експериментальної установки. У звіті треба накреслити таблиці, куди будуть занесені результати проведених експериментів. Схеми та рисунки слід виконувати з урахуванням вимог ЄСКД. Викладач перевіряє знання кожного студента до початку виконання експериментальної частини лабораторної роботи. Відповідаючи на запитання викладача, студент повинен викласти мету та порядок виконання роботи, показати вміння користуватися вимірювальною апаратурою, зробити теоретичні розрахунки та відповісти на контрольні запитання. При незадовільній підготовці до заняття студент може бути недопущений до виконання роботи. Перед виконанням лабораторних робіт студенти повинні пройти інструктаж з техніки безпеки. Виконуючи експериментальні дослідження, необхідно додержуватися умов виконання роботи та вимог техніки безпеки, дбайливо ставитися до обладнання. Отримані результати треба довести викладачу. Перед початком наступної лабораторної роботи слід подати викладачу звіт попередньої роботи. Залік з лабораторних робіт студент одержує у разі виконання усіх завдань.
ВИЗНАЧЕННЯ КОНЦЕНТРАЦІЇ РОЗЧИНУ
1.1 Мета роботи
Набути навички користування одним із методів фізико-хімічного аналізу. Визначити концентрації розчину хлористоводневої кислоти методом титрування.
1.2 Методичні вказівки з організації самостійної роботи студентів
Одна з основних задач дослідження – освоєння методики приготування розчину заданої концентрації, перевірка одержаного результату методом титрування з наступним обчисленням похибки виміру і встановленням дійсної концентрації. До виконання роботи необхідно підготувати відповіді на контрольні запитання.
1.3 Опис лабораторної установки
Лабораторна установка складається із штатива, бюретки, лійки, склянки для титрування, піпетки та індикатора.
1.4 Порядок виконання роботи і методичні вказівки до її виконання
Для виконання роботи необхідно мати розчин лугу NaOH (гідроксид натру), нормальна концентрація якого визначена з точністю до 0,01 н. Під час визначення концентрації розчину хлористоводневої кислоти має місце реакція нейтралізації:
Для того, щоб зафіксувати момент нейтралізації, вливають індикатор метиловий оранжевий або фенолфталеїн. Необхідно ознайомитись із змінюванням кольору індикаторів. Для виконання роботи слід закріпити у штативі вертикальну бюретку, яку перед виконанням роботи необхідно ополоснути розчином лугу. Заповнити бюретку розчином лугу вище нульової позначки. Гумову трубку із скляним наконечником відігнути наверх і, випустивши розчин, заповнити наконечник так, щоб в ньому не залишилось бульбашок повітря. Якщо необхідно, в бюретку ще додати лугу вище нуля і потім надлишок лугу із бюретки випустити в підставлену склянку, поки нижній меніск не встановиться на нульовому діленні бюретки. При відліку око спостерігача повинно бути на одному рівні з нижнім краєм меніска. Потім треба набрати піпеткою розчин кислоти і вилити його в підготовлену склянку ємністю 100 мл. Туди ж треба додати 2 краплі індикатора, який забарвить розчин у рожевий колір. Склянку поставити на білий папір під наконечник бюретки. Приступити до титрування: розчин лугу з бюретки випускати невеликими порціями (приблизно по 0,2 мм) у розчин кислоти, який безперервно треба перемішувати. Частина розчину, куди трапляє луг, забарвлюється в жовтий колір, який при перемішуванні стає рожевим. Коли жовтий колір почне переходити в рожевий повільно, слід додавати розчин лугу по одній краплі і так продовжувати до того моменту, поки від однієї краплі розчин у склянці матиме постійний жовтий колір. На цьому титрування закінчується. Потім з точністю до 0,05 мм визначити у бюретці об’єм розчину лугу, який пішов на нейтралізацію кислоти. Повторити титрування ще чотири рази, починаючи кожного разу з нульової позначки бюретки.
Одержані значення об’єму записати в таблицю. Розходження за результатами титрування не повинні перевищувати 0,1 мм. Із усіх значень об’ємів кислоти знаходять середню величину. Нормальну концентрацію розчину кислоти визначити за формулою:
де
Після цього зробити розрахунок титру розчину кислоти:
де T – титр, тобто кількість речовини, яка міститься в 1 мм розчину;
Розрахувати помилку експерименту. Для цього треба скласти таблицю (див. табл. 1.1), де представлена статистична обробка результатів.
Т а б л и ц я 1.1 – Статистична обробка результатів титрування
У таблиці прийняті такі позначення:
Потім знаходимо похибку:
і розраховуємо помилку:
де
1.5 Зміст звіту Звіт повинен містити: а) мету роботи; б) теоретичні відомості; в) відомості про матеріали та методику вимірювань; г) результати досліджень; д) результати розрахунків; таблиці, графіки; е) висновки; є) перелік посилань.
1.6 Контрольні запитання та завдання
1. Назвіть засоби відображення концентрації. 2. Сформулюйте закон еквівалентів. 3. Як розрахувати еквівалент кислоти, лугу та солі? 4. Чому дорівнює еквівалент водню та кисню?
|
||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 200; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.183.150 (0.036 с.) |
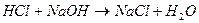 (1.1)
(1.1) , (1.2)
, (1.2) і
і  – концентрації кислоти та лугу;
– концентрації кислоти та лугу;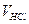 – об’єм кислоти, взятої піпеткою;
– об’єм кислоти, взятої піпеткою; – середнє значення об’єму лугу.
– середнє значення об’єму лугу. , (1.3)
, (1.3) – еквівалент хімічної сполуки.
– еквівалент хімічної сполуки.




 – кількість дослідів;
– кількість дослідів;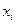 – об’єм лугу, який потрібен для кожного титрування;
– об’єм лугу, який потрібен для кожного титрування; (1.4)
(1.4)
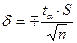 (1.5)
(1.5) – критерій Стьюдента. Значення критерію Стьюдента для п’яти дослідів дорівнює 2,19.
– критерій Стьюдента. Значення критерію Стьюдента для п’яти дослідів дорівнює 2,19.


