Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Средние, кислые и основные соли⇐ ПредыдущаяСтр 11 из 11
Все рассмотренные выше соли являются нормальными или средними солями. Молекулы их содержат катион металла (или аммония NH4+) и кислотный остаток, не содержащий водорода. Кроме средних солей, различают кислые соли и основные соли. Кислые соли – это продукты неполного замещения водорода кислоты на металл – результат и подтверждение ступенчатого характера диссоциации многоосновных кислот.
Первая ступень диссоциации Примеры кислых солей серной кислоты: серной кислоты: H2SO4 ↔ H+ + HSO4- NaHSO4, Ca(HSO4)2, Al(HSO4)3. Примеры кислых солей ортофосфорной кислоты: Na2+HPO42- –– гидрофосфат натрия, Na+H2PO4- –– дигидрофосфат натрия, Ca2+(H2PO4)2- –– дигидрофосфат кальция.
Основные соли – продукты неполного замещения гидроксильных групп основания на кислотный остаток – результат и подтверждение ступенчатого характера диссоциации многоатомных оснований.
Ступенчатая диссоциация: Примеры основных солей:
1. Fe(OH)3 ↔ Fe(OH)2+ + OH- Fe(OH)2Cl, Fe(OH)2NO3, [Fe(OH)2]2SO4. .
2. Fe(OH)2+ ↔ FeOH2+ + OH- FeOHCl2, FeOH(NO3)2, FeOHSO4. Названия солей обобщены в табл.1 приложения 2 и в ремарке после таблицы.
Графические формулы Графическая формула показывает, в каком порядке и каким количеством валентных связей атомы связаны друг с другом. При составлении графической формулы: – каждый атом обозначается символом своего элемента, так что химических знаков элемента в графическом изображении столько, сколько соответствующих атомов, – каждая валентная связь между атомами обозначается черточкой, - как правило, соединяют положительно заряженный атом с отрицательно заряженным. Посмотрим на графические формулы оксида натрия Na2O:
O O
Na –– O –– Na Na –– Na –– O
==С==
O == C == O.
O == Al –– O –– Al == O; Al –– O –– Al
При написании графических формул кислородных кислот необходимо определить степень окисления центрального атома по известным степеням окисления кислорода (2-) и водорода (1+). Число валентных черточек около каждого атома должно отвечать степени его окисления. Следует помнить, что водород соединяется с центральным атомом только через кислород, т.е. в кислородных кислотах присутствуют группы OH. Именно с этих групп, связанных с элементом, образующим кислоту, и удобно начинать составление графической формулы кислоты. Пример: Изобразить графически формулу серной кислоты H2SO4.
В молекуле серной кислоты 2 атома водорода, значит в ней присутствуют 2 гидроксильные группы HO-. Соединим их с атомом серы «S»
H¾O \ S / H¾ O Для завершения графического изображения добавим к атому серы оставшиеся атомы кислорода (их два), используя двойные связи H¾O O \ // S / \\ H¾O O
Формула завершена. Ниже приводятся графические формулы некоторых кислот
Н –– О Н –– О Н –– О ортофосфорная H3PO4 угольная Н2CO3 кремниевая H2SiO4 Изображение графических формул солей удобнее начинать с построения кислотного остатка. Например для силиката бария BaSiO3 кислотный остаток получаем, учитывая, что это остаток кремниевой кислоты, он имеет вид
O –– ½ O == Si ½ O –– В отличие от электронейтральной молекулы кислоты, он потерял два атома водорода. Этот кислотный остаток обеими своими свободными связями в молекуле BaSiO3 связан с атомом бария, который имеет степень окисления 2+
O
O Построение графической формулы кислоты – наиболее сложная задача, равноценная детской игре с пазлами. Предлагается следующая последовательность действий. Надо использовать все атомы, входящие в формулу; надо обеспечить их соединение в единое целое, но так, чтобы положительно заряженные атомы «рукопожимались» только с отрицательно заряженными. При этом количество валентных черточек, исходящих из каждого атома, должно соответствовать его степени окисления (заряду).
Упражнение 1. Постройте графические формулы высших оксидов Si, V, W, B. Упражнение 2. Постройте графические формулы Mg(NO3)2, MgSO4, AlPO4, Ca3(PO4)2, NaBO2
Приложение 2 Справочные таблицы Таблица 1
|
||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 1185; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.93.245 (0.011 с.) |

 правильно неправильно
правильно неправильно Na Na Na Na
Na Na Na Na




 Представим графически формулу СО2. Перед построением графической формулы целесообразно определить степени окисления атомов, входящих в состав молекулы. Так в молекуле CO2 атом углерода четырехвалентен, имеет степень окисления 4+; кислород двухвалентен, 2-. От символа «С» должно исходить 4 черточки:
Представим графически формулу СО2. Перед построением графической формулы целесообразно определить степени окисления атомов, входящих в состав молекулы. Так в молекуле CO2 атом углерода четырехвалентен, имеет степень окисления 4+; кислород двухвалентен, 2-. От символа «С» должно исходить 4 черточки:
 Для некоторых оксидов возможно несколько равноценных вариантов построения графических формул: О
Для некоторых оксидов возможно несколько равноценных вариантов построения графических формул: О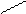
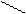 O
O