Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Характеристика виробничого процесу серійного виготовлення стерильних розчинів
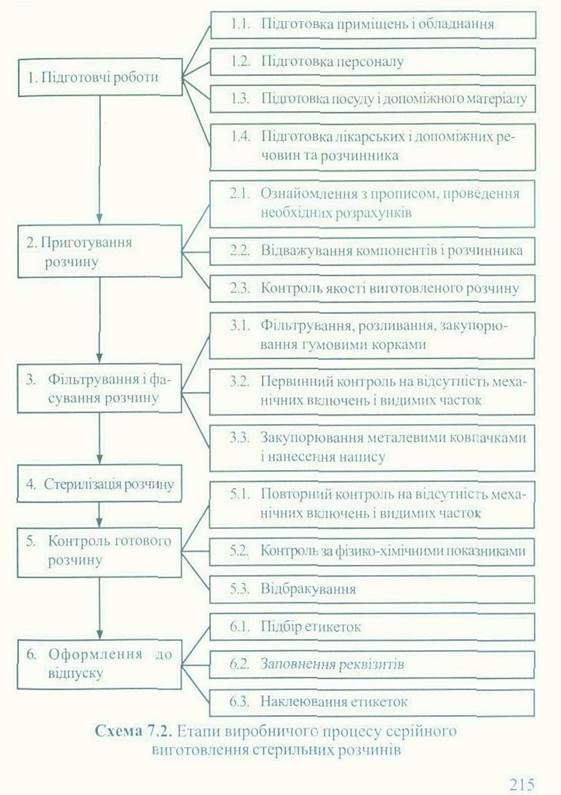
Серією лікарського засобу є визначена кількість однорідної продукції (лікарського засобу), виготовленої в умовах аптеки з певної кількості сировини відповідно до технологічної інструкції в єдиному технологічному процесі від одного завантаження в одиниці ємностного обладнання. Принциповою ознакою серії є її однорідність. На кожний лікарський засіб, який виробляється серійно, повинна бути технологічна інструкція, тобто внутрішній документ суб'єкта господарювання, що належить до категорії виробничих інструкцій, у якому визначено технологічні методи, технічні засоби, норми та нормативи виробництва лікарського засобу, методи контролю, і встановлює якісні та кількісні показники лікарського засобу, їх допустимі межі, вимоги до його упаковки, маркування, умов зберігання, терміну придатності. Виробничий процес серійного виготовлення стерильних розчинів складається з шести етапів, більшість з яких мають ще окремі технологічні операції (схема 7.2).
Перший етап - підготовчі роботи - складається з таких операцій: підготовка приміщень і обладнання, підготовка персоналу, підготовка посуду і допоміжного матеріалу, підготовка лікарських і допоміжних речовин і розчинника. Так, для виготовлення ізотонічного та гіпертонічного розчинів натрію хлориду, останній повинен прожарюватися протягом двох годин при температурі 180 °С і використовуватися щонайбільше за одну добу. Воду очищену одержують з питної води, використовувати свіжопри-готоваленою або протягом трьох діб з моменту її одержання за умови зберігання у закритих ємностях, які виготовлені з матеріалів, що не змінюють властивостей води і захищають її від сторонніх часток і мікробіологічних забруднень. Воду для ін'єкцій одержують із води питної або води очищеної у відповідності з вимогами ДФУ (діюче видання). Вода для ін'єкцій, що використовується для виготовлення парентеральних лікарських засобів, які в подальшому підлягають термічній стерилізації, повинна відповідати вимогам монографії ДФУ "Вода для ін'єкцій "іп Ьиік". Її слід використовувати свіжоприготовленою або зберігати при температурі 5-10 °С або 85-90 °С не більше 24 годин, у закритих ємностях, які виготовлені з матеріалів, що не змінюють властивостей води і захищають її від механічних, мікробіологічних та інших контамінацій.
Для приготування внутрішньовенних інфузійних лікарських засобів, ін'єкційних лікарських засобів, що не підлягають термічній стерилізації, необхідно використовувати стерильну воду для ін'єкцій. Для приготування очних крапель, що підлягають подальшій термічній стерилізації, необхідно використовувати воду, що відповідає вимогам монографії ДФУ "Вода очищена в контейнерах". Забезпечення належних умов отримання води очищеної і води для ін'єкцій "іп Ьшк." в аптеці контролюється посадовими особами органів державного контролю -Державної служби лікарських засобів і виробів медичного призначення та Державної інспекції з контролю якості лікарських засобів. Відібрані посадовими особами органів державного контролю зразки перевіряються один раз на квартал в атестованих чи акредитованих відповідним чином лабораторіях за показниками: "Вміст загального органічного вуглецю" або "Речовини, що окиснюються", "Питома електропровідність", "Загальне число життєздатних аеробних мікроорганізмів", "Бактеріальні ендотоксини" (для води для ін'єкцій "іn bulk.") та за показниками "Випробування на чистоту" відповідних монографій ДФУ (діюче видання) "Вода очищена "іп Ьиік." та "Вода для ін'єкцій "іп Ьиік.". Перевірка якості води для ін'єкцій стерильної за показниками "Випробування на чистоту" монографії ДФУ (діюче видання) "Вода для ін'єкцій стерильна" здійснюється вибірково один раз на квартал відповідним чином атестованими чи акредитованими лабораторіями. Увесь посуд, який використовується при виготовленні лікарських засобів, обов'язково миється з використанням дозволених до застосування МОЗ України мийних засобів з попереднім замочуванням, стерилізується, закупорюється і зберігається в щільно закритих шафах. Термін зберігання стерильного посуду, який використовується при виготовленні нестерильних лікарських засобів, становить не більше трьох діб. Для пакування ін'єкційних лікарських засобів використовують контейнери і корки, які відповідають вимогам ДФУ та технічної документації на них.
Параметри стерилізації, що здійснюються у процесі підготовки посуду і допоміжного матеріалу, лікарських і допоміжних речовин та розчинника, фіксують у відповідних розділах журналу реєстрації стерилізації лікарських засобів, допоміжних матеріалів, посуду тощо. Другий етап - приготування розчину; ознайомлення з прописом, проведення необхідних розрахунків, відважування, відмірювання компонентів і розчинника, контроль якості виробленого розчину. Одночасне виробництво в одному виробничому приміщенні кількох найменувань ін'єкційних, інфузійних внутрішньовенних лікарських засобів забороняється. Ін'єкційні лікарські засоби до стерилізації контролюються за показниками: ідентифікація, рН, прозорість, кольоровість розчину, механічні включення, кількісне визначення діючих, ізотонуючих, стабілізуючих речовин. Третій етап - фільтрування і фасування розчину: фільтрування, розливання, закупорювання гумовими корками, первинний контроль на відсутність механічних включень і видимих часток, закупорювання металевими ковпачками і нанесення напису.
Четвертий етап — стерилізація розчину. Стерилізація розчинів повинна здійснюватися не пізніше трьох годин від початку приготування під контролем спеціально призначеної особи (фармацевт або провізор). Стерилізація розчинів глюкози повинна здійснюватися зразу ж після їх приготування. Повторна стерилізація ін'єкційних розчинів не допускається. П'ятий етап - контроль готового розчину: повторний контроль на відсутність механічних включень і видимих часток, контроль за фізико-хімічними показниками, відбракування. Після стерилізації розчини перевіряються за показниками: ідентифікація, рН, прозорість, кольоровість розчину, механічні включення, кількісне визначення діючих речовин. Для хімічного контролю відбирається один флакон з кожної серії. Контроль ін'єкційних та внутрішньовенних інфузійних лікарських засобів на механічні включення і видимі частки проводиться відповідно до вимог ДФУ з обов'язковою перевіркою кожного флакона. Одночасно проводиться перевірка якості закупорювання флаконів (алюмінієвий ковпачок не повинен прокручуватися при перевірці вручну) та об'єм наповнення флаконів. Розчини для ін'єкцій вважають забракованими при умові: - невідповідності їх фізико-хімічним показникам; - вмісту видимих механічних включень; - нестерильності; - порушення фіксованості закупорки; - недо статності об' єму заповнення флакона. Контроль на стерильність ін'єкційних, внутрішньовенних інфузійних лікарських засобів, офтальмологічних та інших неін'єкційних лікарських засобів, до яких ставляться вимоги щодо їх стерильності, здійснюється щомісяця (вибірково). Шостий етап - оформлення до відпуску: підбір етикеток, заповнення реквізитів, наклеювання етикеток. Контроль якості стерильних лікарських засобів повинен охоплювати всі стадії їх виробництва (виготовлення). Результати контролю фіксуються в журналі реєстрації окремих стадій виробництва ін'єкційних, внутрішньовенних інфузійних та очних лікарських засобів, а також у журналі реєстрації результатів контролю лікарських засобів, вироблених (виготовлених) в аптеці, внутрішньоаптечної заготовки, етилового спирту.
|
||||||
|
Последнее изменение этой страницы: 2016-04-20; просмотров: 857; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.249.154 (0.011 с.) |