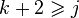Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Пределы ползучести и длительной прочности
При напряжениях ниже предела текучести в металлах наблюдается явление ползучести. Ползучесть – это непрерывная деформация под действием постоянного напряжения. При малых нагрузках и низких температурах она носит обратимый характер. Ползучесть становится проблемой при повышенных температурах (примерно начиная с 0.4-0.6Тпл) и нагрузках выше некоторой величины (но меньше предела текучести). Деформация ползучести сопровождается изменениями структуры и, соответственно механических свойств. В отличие от пластической деформации, упрочняющей металл, деформация ползучести ведет к его разупрочнению. Кроме постоянно растущей деформации и увеличения скорости ползучести в металле начинается зарождение трещин и со временем происходит его разрушение. С явлением ползучести связано понятие жаропрочности. Это способность работать под нагрузкой с допустимыми деформациями и без разрушения в условиях повышенных температур. Количественной характеристикой жаропрочности является предел ползучести (ГОСТ 3248-60) и предел длительной прочности (ГОСТ 10145-81). Предел длительной прочности это условное наибольшее напряжение, под действием которого материал при заданной температуре разрушается через заданный промежуток времени. Эта характеристика определяет способность материала противостоять разрушению при длительном воздействии температуры и нагрузки. Предел ползучести и длительная прочность понижаются с увеличением температуры и длительности выдержки. Они должны рассматриваться как предельные значения рабочего напряжения при высоких температурах. УСТАЛОСТНАЯ ПРОЧНОСТь Трещины в металлах зарождаются и развиваются не только при статических нагрузках, но и под действием циклических напряжений. Усталостная трещина зарождается в поверхностных слоях (это её отличительный признак) и с каждым циклом медленно развивается вглубь. Разрушение происходит, когда из-за уменьшения сечения действующие напряжения превысят разрушающие. Накопление повреждений означает, что чем больше циклов нагружения, тем меньше должна быть величина нагрузки, чтобы металл «работал», не разрушаясь. Процесс постепенного накопления повреждений в металле называется усталостью.
Вторая по важности характеристика выносливости - усталостная долговечность. Она определяет число циклов, которое металл может выдержать при заданном напряжении. Поскольку усталостные трещины зарождаются на поверхности, то особое значение для повышения долговечности при циклических нагрузках имеет состояние поверхности. Полировка, поверхностное упрочнение, отсутствие коррозии увеличивают величину предела выносливости.
6. Металлические сплавы, их виды и строение; твердые растворы, химические соединения механические смеси. Понятие о диаграммах состояния. Построение диаграммы состояния. Правило фаз (закон Гиббса) Металлическим сплавом называется материал, полученный сплавлением двух или более металлов или металлов с неметаллами, обладающий металлическими свойствами. Вещества, которые образуют сплав, называются компонентами. Фазой называют однородную часть сплава, характеризующуюся определенными составом и строением и отделенную от других частей сплава поверхностью раздела.
Уравнение Гиббса
Правило фаз записывается следующим образом:
где j — число фаз (например, агрегатных состояний вещества); v — число степеней свободы, то есть независимых параметров (температура, давление, концентрация компонентов), которые полностью определяют состояние системы при равновесии и которые можно менять без изменения числа и природы фаз; k — число компонентов системы — число входящих в систему индивидуальных веществ за вычетом числа химических уравнений, связывающих эти вещества. Иначе говоря, это минимальное количество веществ, из которых можно приготовить каждую фазу системы. n — число переменных, характеризующих влияние внешних условий на равновесие системы. При переменных давлении и температуре правило фаз сводится к выражению:
В случае однокомпонентной системы оно упрощается до:
Отсюда видно, например, что в однокомпонентной системе три фазы (j=3) могут сосуществовать при числе степеней свободы v, равном нулю, то есть при фиксированных давлении и температуре, что соответствует тройной точке на фазовой диаграмме. Две фазы (j=2) сосуществуют при произвольном измененнии либо давления, либо температуры, когда вторая из этих переменных не является независимой (v=1), то есть двухфазному равновесию на фазовой диаграмме соответствует линия. Если фаза одна (j=1), число степеней свободы системы равно двум, то есть температура и давление могут менятся независимо в пределах некоторой области на фазовой диаграмме — пока система не окажется на одной из линий двухфазного равновесия. Иногда правило фаз записывают следующим образом:
то есть при равновесии число фаз в системе меньше либо равно числу компонентов плюс 2. Математическая интерпретация правила фаз[ Математика позволяет описать явления природы на символическом языке различными способами. Удачная интерпретация правила фаз возможна с помощью теории графов. Уравнение j + v = k + 2 может быть рассмотрено очень наглядно, как соотношение между вершинами, рёбрами, гранями и объёмами некого графа.
7. Основные типы диаграмм состояния двойных сплавов (I-IV типов): механических смесей, неограниченных и ограниченных твердых растворов, химических соединений. Правило отрезков и правило рычага Диаграмма состояния.
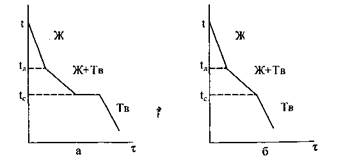
Рис. 1 – Кривые охлаждения сплавов:
Виды диаграмм состояния.
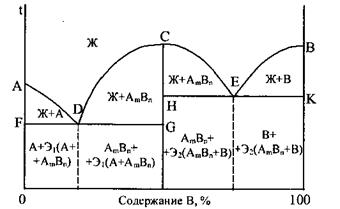
Диаграмма состояния сплавов, образующих химическое соединение (рис. 5) характеризуется наличием вертикальной линии, соответствующей соотношением компонентов в химическом соединении АВ. Эта линия делит диаграмму на две части, которые можно рассматривать как самостоятельные диаграммы сплавов, образуемых одним из компонентов с химическим соединением. На рис. 5 изображена диаграмма для случая, когда каждый из компонентов образует с химическим соединением механическую смесь.
В процессе кристаллизации изменяются и концентрация фаз (поэтому составжидкости изменяется), и количество каждой фазы (при кристаллизации количество твердой фазы увеличивается, а жидкой уменьшается). В любойточке диаграммы, когда в сплаве одновременно существуют две фазы, можно определить количество обей фаз и их концентрацию. Для этого служит так называемое правило рычага, или правило отрезков,8. Связь межу свойствами сплавов и типом диаграммы состояний (диаграммы Курнакова) Так как вид диаграммы состояния, также как и свойства сплава, зависит от того, какие соединения или какие фазы образовали компоненты сплава, то между ними должна существовать определенная связь. Эта зависимость установлена Курнаковым Н.С.
|
||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1078; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.239.46 (0.015 с.) |


 ,
,