
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изобарно – изотермический потенциал (ИИП) или энергия Гиббса ⇐ ПредыдущаяСтр 4 из 4
Большинство химических реакции протекает в изолированных системах, поэтому необходимо учитывать и ΔН, и ΔS. Чтобы их сопоставить, нужно перейти к одинаковым единицам. ΔН – энтальпийный фактор Т ΔS – энтропийный фактор Функция, связывающая оба фактора, называется энергией Гиббса или изобарно – изотермический потенциал: Δ G х.р = ΔНх.р ·103 - ТΔ S х.р. Это выражение получило название объединенного закона термодинамики. Энергия Гиббса — это та часть энергетического эффекта химической реакции‚ которую можно превратить в работу. Поэтому она называется свободной энергией. Энтропийный фактор ТΔ S превратить в работу нельзя — это та часть энергии которая рассеивается в виде тепла (связанная энергия). Изменение энергии Гиббса системы при образовании 1 моль вещества при стандартных условиях называется стандартной энергией Гиббса Δ G °298.
Δ G является функцией состояния. К ней применимо следствие из закона Гесса:
ЗАПОМНИ! Δ G – критерий самопроизвольного протекания процесса. Если Δ G <0, то самопроизвольно протекает прямая реакция, Δ G =0 – состояние химического равновесия, Δ G >0, то возможна обратная реакция, прямая самопроизвольно не пойдет. Большое отрицательное значение Δ G свидетельствует, что система обладает высокой реакционной способностью. Температура, при которой система находится в равновесии называется температурой равновесия Тр. Объединенный закон дает возможность рассчитать Травновесия
Зависимость между энергией Гиббса и const равновесия реакции имеет вид:
Если подставить коэффициент перехода от ln к lg, то ln = 2,3 lg, R = 8,31Дж/к. Тогда получим: -
R = 8,31Дж/К. Ø Кр > 1 - равновесие сдвинуто в прямую сторону. Ø Кр < 1 - равновесие сдвинуто в сторону обратной реакции. Ø Кр = 1 – состояние равновесия. Можно вывести следующие закономерности: Если ΔН < 0 и Δ S > 0, то реакция протекает при любой реальной температуре
(всегда Δ G < 0). Если ΔН < 0 и Δ S < 0, то реакция самопроизвольно протекает (т.е. Δ G < 0) при температурах ниже температуры равновесия. Если ΔН > 0 и Δ S > 0, то реакция самопроизвольно протекает (т.е. ΔG < 0) при температурах выше температуры равновесия. Если ΔН > 0 и Δ S < 0, то реакция не протекает ни при какой реальной температуре (всегда Δ G > 0). Задача. Определить Кр при Т = 400 К для реакции: N 2 O 4(Г) → 2 NO 2(Г) Решение: υ 1 2 [моль] ΔН 9.66 33.5 [кДж/моль] Δ S 304.3 240.45 [Дж/(К*моль)] Рассчитаем ΔН и Δ S в ходе этой реакции: ΔН = 2*33,5 – 9,66 = 57,34 К Дж Δ S = 2*240,45 – 304,3 = 176,6 Дж/К Для Т = 400К имеем: Δ G = ΔН – ТΔ S =57,34 * 103 -400 * 176,6 = - 13,3 к Дж
Задача. Возможно ли осуществить восстановления железа по реакции при стандартных условиях: Fe 2 O 3(т) + 3Н2(г) → 2 Fe (т) + 3Н2О(г) Решение: υ 1 3 2 3 [моль] ΔНх.р = 3*(-285,8) + 822 = -35,4 к Дж Δ S х.р = [2*2,27 + 3*70,1] – [87 + 3*130.5] = 213.8 Дж/к
Δ G >0 ⟹ данный процесс при стандартных условиях невозможен.
|
|||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 50; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.191.22 (0.008 с.) |
 эти данные приведены в таблицах.
эти данные приведены в таблицах.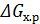 = ⅀
= ⅀ 

 p
p 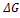 . 1000
. 1000 Кр = 101,74 = 54,3
Кр = 101,74 = 54,3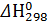 -822 0 0 -285,8 [к Дж/моль]
-822 0 0 -285,8 [к Дж/моль]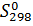 87 103,5 2,27 70,1 [Дж/(К*моль)]
87 103,5 2,27 70,1 [Дж/(К*моль)] = -35,4*103 – 298*213,8 = 28,34 к Дж
= -35,4*103 – 298*213,8 = 28,34 к Дж


