
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Процессы с изменением энтропии.
Наименьшими значениями S обладают твердые кристаллические вещества. В отличие от других термодинамических функций можно рассчитать не только изменение энтропии в ходе какого-либо процесса, но и ее абсолютную величину. Поэтому в справочниках приводится абсолютная величина энтропии S°298. Стандартной энтропией вещества S °298 называется изменение энтропии при переходе вещества от состояния при температуре абсолютного нуля (0 К) к состоянию при Т = 298 К. Для любых веществ S0298 = 0. Поэтому перед значком стандартной S не ставят значок Δ:
К энтропии, как функции состояния, применимо следствие из закона Гесса:
Δ S х.р = ⅀ υ Рассмотрим график изменения S при фазовых переходах. S
200 100 Кр ж газ 500 2000 Г
При фазовых переходах наблюдаем резкое изменение Т. При ↑Т происходит ↑ S из-за ↑ сил колебания атомов. При достижении Т = Тплавления происходит увеличение S на ΔSплавления, так как резко увеличивается хаотичность системы. Любая термодинамическая система для повышения устойчивости стремится к минимуму энергии и максимуму энтропии т.е. наиболее благоприятствуют самопроизвольному протеканию процесса такие значения термодинамических функций: Задача. Выскажите предположение о характере изменения S в следующих реакциях: а)2Н2(г) + О2(г) → 2Н2О(г) б)2 KClO 3(т) → 2 KCl (т) + 3О2(г)
Решение: а)S уменьшится, так как число молей газа в ходе реакции уменьшается б)S увеличивается, так как в ходе реакции появляется газовое вещество
На основании первого закона термодинамики нельзя сделать каких-либо выводов о направлении процесса и о состоянии равновесия. Для выяснения этих вопросов используется второй закон термодинамики. Было предложено несколько формулировок второго закона. Постулат Клаузиуса (1850): Теплота не может сама собой переходить от холодного тела к горячему, то есть невозможен процесс, единственным результатом которого был бы переход теплоты от тела с более низкой температурой к телу с более высокой температурой. Постулат Томсона (1854): теплота наиболее холодного из участвующих в процессе тел не может служить источником работы.
|
|||||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 37; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.154.151 (0.005 с.) |
 но
но 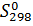


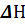 < 0, Δ S > 0.
< 0, Δ S > 0.


