Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Поддержание стационарного состояния
Взрослый здоровый организм находится в равновесии с окружающей его средой. Такое равновесие предусматривает своевременное подавление процессов роста, что представляется не менее необходимым, чем способность клеток расти и делиться, и в такой же мере жизненно необходимым. Нарушение нормальных тормозных механизмов может привести к гигантизму, ожирению или к безудержной анархии злокачественного роста. Вполне возможно, что понимание механизмов малигнизации будет достигнуто нами в будущем не в результате изучения особых причин быстрого роста и агрессивности злокачественных клеток, а благодаря исследованию причин отсутствия этих свойств у нормальных клеток. В организме взрослого, главным фактором, определяющим нормальный баланс процессов обмена веществ, является соотношение между поступлением пищи и расходом энергии. Недостаточное питание быстро приводит к обратимой мобилизации запасов энергии в организме, однако длительная алиментарная недостаточность или голодание вызывает необратимый распад тканей. Систематическое переедание также чревато развитием патологического состояния (ожирение) в результате переполнения тканевых депо. Прежде чем обсудить эти два крайних проявления дисбаланса обмена веществ, рассмотрим механизмы поддержания постоянства состава органов и тканей, а также свойства регуляторов, воздействующих на ферменты анаболизма и катаболизма. Анаболические гормоны Эти агенты усиливают способствующее росту влияние избыточного питания. Гормон роста — полипептид, секретируемый передней долей гипофиза, стимулирует биосинтез РНК и белка практически во всех клетках. Такое общее усиление накопления азотистых соединений сопровождается усиленным поглощением аминокислот из циркулирующей крови. Одним из факторов, способствующих выделению гормона роста, является повышение уровня аминокислот в крови, так что максимальное усиление анаболизма тканевых белков обеспечивается наличием большого количества предшественников. Инсулин секретируется поджелудочной железой в ответ на повышение уровня глюкозы или аминокислот в крови; он стимулирует поглощение глюкозы и аминокислот тканями. Кроме того, инсулин способствует усиленному использованию глюкозы для синтеза гликогена, липогенеза и гликолиза, одновременно ограничивая глюконеогенез в печени и блокируя липолиз в жировых депо. Этот гормон усиливает анаболизм тканевых белков, подавляя в то же самое время катаболизм аминокислот.
Тироксин, который секретируется щитовидной железой в ответ на действие тироид-стимулирующего гормона (ТСГ) передней доли гипофиза, стимулирует рост и дифференцировку тканей. Такое воздействие проявляется главным образом в усилении синтеза белка, и особенно в усилении образования митохондриальных окислительных ферментов. Таким образом, гормон щитовидной железы оказывает регуляторное влияние на поглощение кислорода и общую интенсивность обмена веществ в тканях. Специфические анаболические функции, в большей мере, присущи стероидным гормонам — эстрогенам; они образуются в женском организме (в яичниках) и стимулируют синтез РНК и белка в определенных клетках-мишенях (матка); мужские стероидные гормоны — андрогены — синтезируются в яичках и вызывают аналогичное ускорение анаболизма РНК и белка во многих тканях, в том числе в скелетных мышцах. Катаболические гормоны Многие гормоны участвуют в регуляции процессов, обеспечивающих возмещение повышенных затрат энергии при состояниях стресса или при алиментарной недостаточности. Глюкагон — полипептид, секретируемый поджелудочной железой в ответ на резкое снижение содержания глюкозы в крови, т. е. противодействует гипогликемическому эффекту инсулина. Глюкагон специфически повышает гликогенолиз в печени, в результате чего содержание глюкозы в циркулирующей крови возрастает. Кроме того, глюкагон стимулирует глюконеогенез и липолиз в печени. Жирные кислоты, освобождаемые под влиянием липазы, служат другим источником энергии и способствуют процессу глюконеогенеза. Гормоны группы катехоламина — норадреналин, выделяемый при раздражении окончаниями симпатических нервов, и адреналин, секретируемый мозговым слоем надпочечника,— по своему действию напоминают в известной мере глюкагон, но их влияние распространяется и на другие ткани, кроме печени; они активируют гликогенолиз в мышцах и печени, а также стимулируют липолиз в жировой ткани, благодаря чему повышается содержание глюкозы и жирных кислот в плазме.
Такие глюкокортикоидные стероидные гормоны, как кортизол, секретируются корой надпочечников в ответ на воздействие АКТГ (адренокортикотропного гормона) передней доли гипофиза. Кортизол противодействует многим эффектам инсулина, блокируя захват клетками глюкозы и ее превращение в жиры, а также тормозя синтез белка в периферических тканях. Одновременно стимулируется образование в печени ферментов, участвующих в катаболизме аминокислот и в глюконеогенезе. В результате этого запасы белка во внепеченочных тканях истощаются, поскольку продолжается гидролиз белка при подавленном синтезе. Естественно, что поток аминокислот устремляется от периферии к печени; при этом увеличивается как количество углерода, направляемого на образование глюкозы, так и количество азота, используемого для образования мочевины. ИСТОЩЕНИЕ ОРГАНИЗМА Под голоданием мы подразумеваем нарушение поступления в необходимые обменные процессы организма жизненно важных веществ (напрмер недостаток белков при общем избытке пищи, за счет углеводов или жиров, недостаток микроэлементов, витаминов, и др. активных веществ). Очень часто, белковое истощение может явиться следствием неправильного питания, когда незаменимые белки и жирные кислоты не поступают в организм, при поступлении пищи в достаточном количестве по калорийности, в основном, за счет углеводов. В таких случаях, можно говорить о белковом голодании, которое может сопровождаться ожирением. Можно получать все необходимые компоненты в нужных количествах, но при этом иметь белковое истощение. Обычно это связано с нарушением состава микрофлоры кишечника, которая нам поставляет пластические и энергетические материалы, витамины, питательные вещества, антибиотики и т.д. Если она не может обеспечить всасывание этих веществ, то даже при избытке незаменимых аминокислот в потребляемых продуктах, мы будем иметь их сильно выраженный недостаток в организме. Пример: Больной А. 1950 г.р. поступил в клинику с диагнозом дисбактериоз кишечника. Жалобы при поступлении на частый стул непереваренной пищей после каждого приема пищи, потерю массы тела. Болен в течение 2 лет, неоднократно сдавал кал - патогенная флора не высевалась, лечился лекарственными препаратами, улучшения кратковременные. При осмотре отмечается дефицит массы тела 21% (при росте 188см вес составил 70 кг), кожные покровы бледные, тургор кожи снижен, больной вялый адинамичный. При лечении данного больного использовали излучатель GI(s) на область кишечника в течение 15 мин + GI «СТ» 20 мин, GI(b)+KL(b) по схеме общего курса в течение 1 недели. Стул нормализовался после первого сеанса, после 5 сеанса повысилась работоспособность. Больной прошёл курс 2-х недельной терапии, наблюдение в течение года показало, что расстройства кишечника больше не возникали, больной прибавил в весе 14 кг. Классифицируя проявления алиментарной недостаточности, различают: квашиоркор, который обусловлен главным образом потреблением бедной белком пищи, и маразм — состояние, связанное с общей белково-калорийной недостаточностью. В классических случаях квашиоркор проявляется у детей в возрасте от 1 года до 3 лет и характеризуется отеками, задержкой жира (особенно в печени, которая при этом резко увеличивается), дряблостью кожи, малым количеством волос и отсутствием в них пигмента, апатией и раздражительностью. При маразме задержка в росте резко выражена уже в возрасте от 6 месяцев до 1 года; в противоположность детям с квашиоркором, которые из-за отеков часто выглядят одутловатыми и круглолицыми, дети при маразме как бы «сморщиваются» — их мышцы атрофируются, а жир в организме отсутствует. В типичных случаях маразма поражение печени, кожи и волос не наблюдаются: такой ребенок неспокоен, реактивен, но не раздражителен. Между этими двумя крайними проявлениями имеется множество промежуточных форм. Практически их трудно разграничить, но с точки зрения лечения важно установить, чего не хватало в пище ребенка — белка, калорий или того и другого.
Основной принцип, объединяющий все эти явления, базируется на идее эквивалентности энергии различных классов пищевых веществ и компонентов тканей. Когда общее поступление калорий с важнейшими видами «топлива» (углеводами и жирами) становится меньше, чем расход энергии, в организме начинается распад белков, как поступающих с пищей, так и собственных; это ведет к общему истощению, касающемуся мышц и других органов, что наблюдается при маразме. Таким образом, голодание можно рассматривать как такое состояние, при котором организм «пожирает самого себя» для удовлетворения своих энергетических потребностей. Прежде чем наступит это тяжелое, часто фатальное состояние, происходит целый ряд изменений в процессах обмена, зависящих, конечно, от условий питания в период, предшествующий голоданию. Рассмотрим процессы, которые произойдут в организме здорового, упитанного взрослого, если его внезапно лишить пищи. При этом сразу же снизится содержание глюкозы в крови, что приведет к снижению секреции инсулина и повышению секреции глюкагона поджелудочной железой и к стимуляции гликогенолиза в печени. Если пища не поступает в течение 24 ч, запасы гликогена в печени в основном истощаются; на 2-й день должны включиться иные механизмы. Так, длительная секреция глюкагона вызывает активацию гормон -чувствительной липазы, благодаря чему освобождается больше жирных кислот, окисляемых в печени. Подобно этому, АКТГ, катехоламины и другие гормоны, освобождаемые в ответ на поступающие в центры регуляции стрессорные стимулы, способствуют активации липазы жировой ткани; мобилизация образующихся жирных кислот из жировых депо обеспечивает энергией периферические ткани, печень и другие внутренние органы. В отличие от кратковременного поступления энергии за счет запасов гликогена в печени триглицериды жировой ткани могут обеспечивать организм достаточным количеством АТФ в течение нескольких недель.
По мере того как организм приспосабливается к длительному голоданию (на протяжении первых недель), резко возрастает количество кетоновых тел, образуемых печенью, поскольку преобладает окисление жирных кислот, тогда как поступление пирувата и оксалоацетата снижено, из-за чего не обеспечивается достаточный поток метаболитов через цикл лимонной кислоты. Спустя несколько недель такие органы, как сердце и, в конечном счете, мозг приспосабливаются к удовлетворению значительной доли своих энергетических потребностей за счет этих кетоновых тел. Однако, если образование кетоновых тел превосходит их использование, возникает метаболический ацидоз, который стремятся компенсировать как органы дыхания (выделение СО2), так и почки (экскреция NH4+). Одновременно по мере перехода к мобилизации и окислению жирных кислот, жировая ткань и печень постепенно расходуют участвующие в биосинтезе жирных кислот ферменты: ацетил-КоА — карбоксилазу, синтетазу жирных кислот, фермент расщепляющий цитрат. Если голодание продолжается, происходит мобилизация тканевых белков и их использование в качестве источников энергии. Как это ни парадоксально, первыми мобилизуются лабильные белки желудочно-кишечного тракта и пищеварительные ферменты поджелудочной железы, что нарушает использование того небольшого количества пищи, которое поступает в желудочно-кишечный тракт. В дальнейшем начинается распад белков внутренних органов (печени и селезенки), затем — функциональных белков мышц и, наконец, белков нервной системы. Эта последовательность использования соответствует скоростям обновления белков при описанном выше стационарном состоянии. Катаболизм аминокислот, стимулируемый усиленной секрецией глюкокортикоидов и сниженной секрецией инсулина, служит непосредственным источником АТФ для периферических тканей и обеспечивает поступление углерода для образования глюкозы в печени и почках. В первые недели голодания, несмотря на общее повышение катаболизма белка, наблюдается значительное увеличение содержания в печени таких участвующих в глюконеогенезе ферментов, как аминотрансферазы, фосфатазы, ферменты, катализирующие превращение пирувата в фосфоенолпируват. При длительном голодании, когда мозг удовлетворяет свои энергетические потребности в большей мере за счет р-оксибутирата, чем за счет глюкозы, интенсивность глюконеогенеза постепенно снижается. Одновременно с этим масса мышечной ткани, общая активность организма и, следовательно, затраты энергии также убывают. Наконец, когда все резервы жиров истощены, организм начинает расходовать даже жизненно важные белки сердца, легких, клеток крови и т. д.; затем наступает смерть от коллапса.
ОЖИРЕНИЕ Одна из трагических ироний современной цивилизации состоит в том, что если в развивающихся странах примерно одна треть населения в той или иной мере страдает от недоедания, то для населения развитых стран наиболее серьезную проблему питания представляет переедание. Оценить частоту случаев ожирения довольно трудно, так как объективных критериев, позволяющих определить жесткие границы нормы в смысле содержания жира в организме, не существует. Однако, по данным последних обследований, проведенных в США и Канаде, у одной трети взрослых жителей этих стран вес тела более чем на 20% превышает идеальный. Для этой группы людей с избыточным весом характерна значительно более высокая смертность от болезней, относящихся к группе наиболее частых причин внезапной смерти. Если учесть, что важнейшими факторами, предрасполагающими к ишемической болезни сердца, являются курение, сидячий образ жизни, гипертония, гиперлипидемия и ожирение, причем четыре последних фактора часто сочетаются друг с другом у людей с избыточным весом, то указанная опасность станет очевидной. К этим серьезнейшим медицинским проблемам присоединяются и другие удручающие спутники ожирения: одышка, боли в суставах и переломы, осуждение общества и потеря уважения к самому себе. Описаны два важнейших типа ожирения, различающихся по причинам, лежащим в их основе, и по поражаемым возрастным группам: ожирение у детей, при котором перекармливание в раннем детстве ведет к увеличению числа клеток в жировой ткани (адипозоцитов), и ожирение у взрослых, при котором либо недостаточное использование, либо избыточное потребление калорий с пищей ведет к увеличению размеров адипозоцитов, но не изменяет их числа. Наиболее коварен синдром ожирения, развивающийся в раннем детстве, не только потому, что он предрасполагает к таким заболеваниям, как респираторные инфекции в детском возрасте, но также потому, что он обычно приводит к ожирению в дальнейшем и у взрослого, поскольку многочисленные жировые клетки сохраняются в организме на протяжении всей жизни. Высказывалось предположение о значении генетического фактора в развитии ожирения у детей, поскольку частота его особенно высока среди потомков тучных людей (однако это, по-видимому, больше связанно с семейными традициями). При развивающемся у взрослых синдроме ожирения разобраться в сочетании вызывающих его причин бывает нелегко. Страдающим ожирением людям хорошо известен жестокий парадокс: суровый голод среди изобилия. По-видимому, гипоталамический центр регуляции аппетита, у этих людей «установлен на слишком высокую отметку». В других случаях страдающие ожирением люди потребляют не больше пищи, чем худощавые, но они значительно менее активны. Хотя им приходится выполнять большую дополнительную работу — «носить свой избыточный вес», однако создается впечатление, что тучные значительно менее активны физически и затрачивают меньше энергии на осуществление нормальных физиологических функций. К сожалению, механизмы энергосопряжения при ожирении функционируют слишком эффективно. Реальный прирост жиров в депо происходит в тех случаях, когда липогенез, обусловленный поступлением с пищей избытка углеводов и жиров, преобладает над мобилизацией жирных кислот и их окислением для удовлетворения потребностей периферических тканей в энергии. Липогенезу способствует избыточное питание и усиленная секреция инсулина; усиленная физическая нагрузка и повышенная секреция липолитических гормонов (катехоламины и глюкагон) стимулируют использование жиров. Поскольку все процессы в организме взаимосвязаны, было бы ошибкой концентрировать все внимание в случаях ожирения на том, что происходит в жировой ткани. Накопление жира в депо — это лишь последнее звено в цепи метаболических нарушений. Жиры, поступающие в организм с пищей, вносят непосредственный вклад в создание запасов триглицеридов в жировой ткани. Об этом свидетельствует тот факт, что состав непредельных жирных кислот жировых депо постепенно приобретает черты сходства с составом непредельных жирных кислот экзогенных жиров пищи. Однако основным фактором липогенеза при ожирении являются углеводы. Глюкоза, поступающая в кровь (в результате всасывания из кишечника) в количествах, превосходящих потребности печени или возможности процесса депонирования гликогена, прежде всего, используется для синтеза жирных кислот. Наиболее важным местом образования эндогенных, преимущественно насыщенных жирных кислот являются клетки печени. Поступающий из печени избыток глюкозы и триаглицеридов захватывают клетки жировой клетчатки, в которой происходит синтез дополнительных количеств жирных кислот. Этерификация жирных кислот, проникающих в клетки жировой клетчатки, а также жирных кислот, синтезируемых в самой жировой ткани, зависит от превращения поступающей глюкозы в акцептор — альфа-глицерофосфат. В жировой клетчатке тучных людей, усиленное превращение глюкозы в альфа-глицерофосфат сочетается с ингибированием его окисления дегидрогеназой митохондрий. В результате повышается доля глюкозы, используемой для образования глицерина, и этерификация жирных кислот начинает преобладать над выхождением свободных жирных кислот из клеток. Эффекты инсулина как бы наслаиваются на тот дисбаланс, который создает излишнее питание. У людей, страдающих ожирением, отмечается значительное повышение содержания инсулина в циркулирующей крови, а также чрезмерная реакция на поступление глюкозы в желудочно-кишечный тракт. Сочетание избыточного питания с гиперинсулинизмом не только способствует захвату глюкозы жировой клетчаткой, но и индуцирует синтез ряда ферментов (фермента, расщепляющего цитрат, ацетил-КоА — карбоксилазы и синтетазы жирных кислот) в клетках печени и жировой ткани, что ведет к стимуляции липогенеза. Кроме того, повышение концентрации инсулина ингибирует гормон-чувствительную липазу, что вызывает дальнейшее смещение нарушенного баланса в сторону отложения жиров. Лечение ожирения обычными методами — крайне трудная и неблагодарная задача, особенно если учитывать отдаленные результаты. Затратив чрезвычайные волевые усилия, можно добиться на несколько месяцев значительного снижения веса, но затем некоторое изменение привычек или эмоциональный срыв полностью изменяют ход процесса на обратный, и вес быстро восстанавливается. Этот биохимический механизм легко понять, если учесть тот факт, что адаптивное увеличение активности ферментов липогенеза происходит в течение нескольких часов после приема пищи, тогда как деадаптация требует многих недель голодания. Ощущение безнадежности усиливают частые жестокие насмешки окружающих, распространенное в обществе мнение о том, что все тучные обжоры. Для резкого снижения веса прибегали к полному голоданию под наблюдением врачей в условиях стационара, но данные, представленные в предыдущем разделе, подчеркивают опасности, связанные с этими «драконовыми» мерами. Важнейшая проблема, конечно, возникает вследствие того, что при полном голодании потеря веса может происходить в большей мере не за счет жировых депо, а за счет органов и тканей, не содержащих резервных жиров. Поскольку при ожирении жир обычно накапливается в первую очередь в ущерб мышечной ткани, такой «расход» тканей сказывается на общем состоянии. Поэтому при лечении представляется более целесообразным сократить общее поступление калорий до уровня, который был бы ниже минимально необходимого для поддержания активности организма и обеспечения достаточного количества белка, обеспечивающего синтез компонентов мышц и других, не содержащих жира тканей, а также для предотвращения развития отрицательного азотистого баланса вследствие усиленного глюконеогенеза. Уменьшение поступления в организм углеводов, безусловно, предотвращает склонность к липогенезу, который индуцируется повышением содержания глюкозы в крови и гиперинсулинизмом. Ограничение поступления углеводов в организм достигается, в частности, заменой в рационе сахарозы, которая содержится в больших количествах в современных рафинированных продуктах питания, на менее всасываемые крахмалоподобные природные углеводы. Важнейшим фактором адаптивного увеличения липогенеза является резкое повышение содержания глюкозы в крови после ежедневного обильного однократного приема пищи, привычного для склонных к ожирению людей. Следовательно, полезнее разделять ежедневный пищевой рацион на несколько небольших порций. Снижению веса тела способствует дозированная физическая нагрузка; рекомендуется комплекс упражнений, трудность которых нарастает постепенно. Во-первых, повышенный расход энергии в большей мере способствует катаболизму, чем анаболизму жиров. Во-вторых, стимуляция развития мышц обеспечивает расходование тканевых депо, ускоряя одновременно компенсаторное наращивание массы тканей, свободных от избытка жира. В-третьих, по мере того как упражнения постепенно становятся все более трудными, сопровождающее их освобождение катехоламинов усиливает липолиз, а также использование жирных кислот тканями мышц. В-четвертых, склонность к развитию сердечно-сосудистых заболеваний уменьшается по мере тренировок, повышающих силу и выносливость сердца и органов дыхания. Наконец, повышение подвижности и работоспособности позволяют человеку активно участвовать в самых разнообразных формах деятельности, что способствует появлению ощущения счастья и благополучия. Следует учитывать, что многие токсины, в частности диоксин, являются жирорастворимыми. Поэтому при резком похудании наблюдается выброс в кровь токсинов, которые до этого находились в жировой ткани в неактивном состоянии. При потере жировой массы эти токсины переходят в плазму крови и дают сильно выраженный эффект интоксикации. Из этого следует, что процесс похудания должен происходить очень медленно, адекватно возможностям организма. Для быстрого вывода токсинов и их нейтрализации рекомендуется в процессе похудания принимать курс терапии излучателями RC+ZB. ГЛЮКОКОРТИКОИДЫ В ответ на раздражение (инфекция, психоэмоциональная нагрузка, травма, прием пищи) организм отвечает выработкой различных активных веществ, - гормонов, ферментов и т.д. Глюкокортикоиды – это гормоны, вырабатываемые организмом и выполняющие противовоспалительную функцию. В норме организм сам адекватно увеличивает синтез глюкокортикоидов и переводит их из неактивного состояния в активное. Уровень колебания выброса на раздражитель достигает от 1/50 до 1/200 суточной дозы. Какие факторы влияют на содержание и выброс глюкокортикоидов? Для синтеза глюкокортикоидов необходим холестерин. Уровень его содержания в крови определяется соотношением липопротеидов высокой и низкой плотности. Недостаточное количество липопротеидов низкой плотности, способствует снижению в крови уровня холестерина, что может привести к недостаточному синтезу глюкокортикоидов. С другой стороны глюкокортикоиды могут вырабатываться в организме в достаточном количестве, но находится в неактивном, связанном с белком, состоянии. С помощью резонансных ИК-излучателей возможно привести концентрацию их активной части к норме:
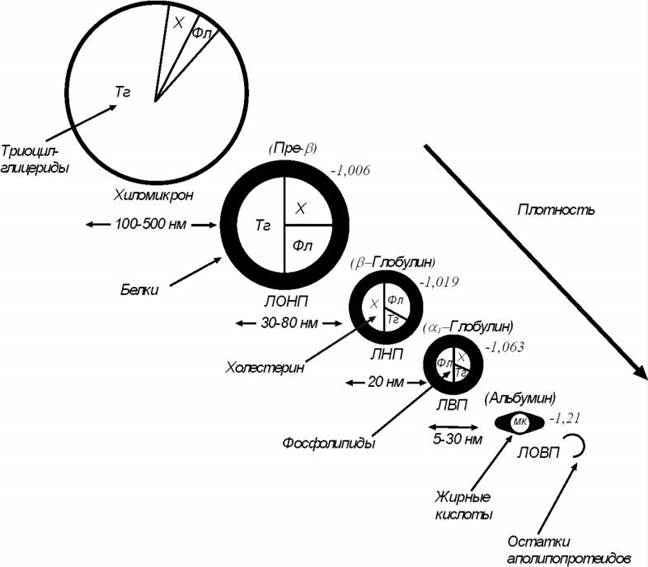
ХОЛЕСТЕРИНОВЫЙ ОБМЕН Холестерин (ХН) занимает особое место в ряду биосоединений. Он входит в состав тканей, клеток, клеточных мембран, регулируя их проницаемость, это предшественник стероидных гормонов, желчных кислот. ХН – это спирт, способный образовывать эфиры с уксусной, бензойной, стеариновой и др. кислотами. Промежуточный обмен ХН происходит в печени, причем с желчью он выделяется в чистом виде. Биосинтез холестерина протекает во всех органах и тканях, но главная роль принадлежит желчи. ХН поступает в желудочно-кишечный тракт двумя путями - с пищей и в составе кишечного сока, желчи. Всасываемая часть холестерина, так называемый коэффициент всасывания – важный физиологический показатель. Выделяется ХН через кишечник, где превращается в копрастанол. Тот ХН, который попал в организм, поступает в лимфатическую систему в составе хиломикронов и липопротеидов очень низкой плотности (ЛПОНП). Далее холестерин попадает в плазму, где его находят в липопротеидах, делящихся в зависимости от плотности на 4 класса:
ЛПОНП транспортируют в кровь триглицериды из кишечника, ЛПНП участвуют в доставке холестерина в кровь, ЛПВП выводят ХН из организма. Главный поставщик холестерина в кровь – это печень, в ней происходит его синтез; печень также является первым барьером для ЛПОНП и кишечных хиломикронов. Важно не само абсолютное содержание ХН в плазме (средняя концентрация 1,9-2,1 г/л), а соотношение его в ЛПНП и ЛПВП, так как они переносят ХН через стенки сосудов. Поэтому нарушение работы этих липопротеидов приводит к развитию различных заболеваний. Еще одна неприятность, связанная с холестерином – желчекаменная болезнь. Пересыщение желчи холестерином всегда ведет к образованию камней (чаще холестериновых) в желчном пузыре и в его протоках. В данном случае, важно не столько общее содержание ХН в желчи, сколько изменение ее фазового состава. Желчь – липидный комплекс, в который входят фосфолипиды, холестерин, желчные кислоты, у взрослых холевая кислота. В нормальном состоянии холестерин удерживается в желчи фосфолипидами и желчными кислотами. Когда нарушается работа печени, меняется соотношение компонентов желчи и в ней образуются включения в виде капель жира, эфиров холестерина, а также начинается кристаллизация холестерина. Из-за набухания липидов могут появиться жидкие кристаллы. Если выдерживать желчь в таком состоянии из нее может кристаллизоваться холестерин, т.е. застой желчи также способствует образованию камней. Гиперхолестеринемия (свыше 2,6 г/л), часто связана с атеросклерозом и поражением сердечно-сосудистой системы. Однако снижение концентрации холестерина в плазме (ниже 1,5 г/л), приводит к таким заболеваниям, как гипотиреоз, болезнь Аддисона, кахексия, астенизация нервной системы. Гипохолестеринемия может появиться при заболеваниях печени – циррозах, инфекционных гепатитах и др. Что касается гиперхолестеринемии, то она может быть первичная (семейная – связанная с генетическими факторами) и вторичная, вызванная внешними условиями (ожирение, переедание, гиподинамия и т.д.)
|
|||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 32; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.190.217.134 (0.028 с.) |