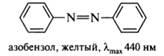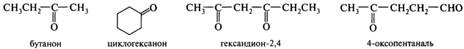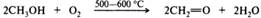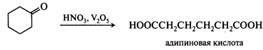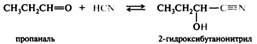Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Диазосоединения: реакции без выделения азота; реакция азосочетания, ее механизм, диазо– и азосоставляющие; использование реакции азосочетания для идентификации фенолов и ароматических аминов.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Ароматические диазосоединения. Реакции солей арилдиазония без выделения азота. Азосочетание. В результате реакции азосочетания солей арилдиазония с ароматическими аминами или фенолами образуются азосоединения. Реакция протекает по механизму электрофильного замещения, электрофилом здесь является диазокатион. Из-за большого объема диазокатиона реакция азосочетания главным образом проходит в пара-положение, а если оно занято, то диазокатион атакует орто -положение. Соль диазония (электрофильный реагент) в этой реакции называется диазокомпонентой, а фенол или амин (ароматический субстрат) — азокомпонентой:
Образующиеся в результате реакций азосочетания вещества окрашены; многие из них используются как красители и кислотно-основные индикаторы. Азосочетание с фенолами проводят в слабощелочной среде (pH 8—10). При этих значениях pH фенол превращается в феноксид-ион, анионный центр которого проявляет положительные мезомерный и индуктивный эффекты и является одним из самых сильных электронодоноров и соответственно активаторов бензольного кольца по отношению к электрофильной атаке. Указанный интервал значений pH оптимален. При более низкой щелочности раствора концентрация ионизированных молекул будет небольшой, что приведет к снижению скорости реакции, в то же время при более высоких значениях pH соль арилдиазония превращается в диазогидроксид, который уже не проявляет свойств электрофильной частицы и, следовательно, не будет вступать в реакцию азосочетания. В качестве примера сочетания в щелочной среде приведено взаимодействие диазотированной сульфаниловой кислоты с β-нафтолом, приводящее к образованию красителя кислотного оранжевого:
Азосочетание с ароматическими аминами проводят в более широком интервале значений pH (4—10). Амин в реакцию азосочетания вступает только в непротонированной форме:
В слабокислой среде амин находится в равновесии со своей протонированной формой, при этом концентрация свободного основания достаточно высока, что обеспечивает протекание реакции азосочетания:
В сильнокислой среде амин полностью протонирован, образовавшаяся аммониевая группа является сильным электроноакцептором и дезактивирует ароматическое кольцо по отношению к реакции азосочетания. Азосочетание в нейтральной и слабощелочной средах проводят с теми аминами, которые при этих условиях хорошо растворимы в воде. С некоторыми аминами азосочетание проводят в присутствии поверхностно-активных веществ, чтобы эмульгировать нерастворимый в воде амин. Так, дифениламин — очень слабое нерастворимое в воде основание, поэтому азосочетание с ним по одной из методик проводят в присутствии эмульгатора (зеленого мыла):
В процессе азосочетания может происходить электрофильное замещение сульфо- и карбоксильной групп, например:
Азосоединения: азокрасители (метиловый оранжевый), индикаторные свойства; основы теории цветности. Азсоединениями (диазенам и) называются соединения, содержащие азо-группу —N=N—, связанную с двумя углеводородными радикалами. В зависимости от строения углеводородного радикала азосоединения могут быть алифатическими, ароматическими и смешанными. Атомы азота в азогруппе находятся в sp2-гибридном состоянии с расположением неподеленных пар электронов на гибридных орбиталях. Азосоединения способны существовать в виде π-диастереомеров, из них термодинамически более устойчив E-изомер. При облучении его УФ-светом он превращается в Z-изомер, который при нагревании снова переходит в более устойчивую E-форму Индикаторные свойства. Еще более ста лет назад окраску веществ связывали с наличием в их структуре так называемых хромофорных групп, к которым относятся некоторые ненасыщенные группировки, например, двойные связи С=С, С=O, C=N, N=N, N=O, ароматические фрагменты. Изолированные хромофоры имеют полосы поглощения в электронном спектре в дальней ультрафиолетовой области (165—200 нм) и являются прозрачными в видимой области спектра. Сопряжение одного хромофора с другим вызывает сдвиг полос поглощения в сторону больших длин волн с одновременным увеличением их интенсивности. Окрашенные вещества поглощают в видимой области спектра (400—800 нм). Очевидно, что такие соединения должны иметь в своей структуре длинную цепь сопряжения. Типичным примером окрашенных веществ служат азосоединения, характеризующиеся наличием в структуре в качестве главного хромофора фрагментаазобензола. Сопряженная система азобензола включает два бензольных кольца и азогруппу:
Различные азосоединения в зависимости от длины сопряженной системы могут быть окрашены в желтый, оранжевый, красный, синий и зеленый цвета. Изменению и углублению окраски способствует наличие в структуре ауксохромов — атомов или групп атомов, вступающих в р,π- и π,π-сопряжение с π-электронной системой главного хромофора. Наиболее интенсивную окраску имеют те соединения, в которых с главным хромофором сопряжены одновременно электронодонорные и электроноакцепторные группы, находящиеся в пара- или орто-положении по отношению друг к другу. Примерами таких соединений могут служить метиловый оранжевый (гелиантин), имеющий электронодонорную диметиламиногруппу, и электроноакцепторную сульфогруппу, а также метиловый красный, конго красный и др. Многие ароматические азосоединения при действии кислот и оснований изменяют свою окраску в определенном интервале pH среды, благодаря чему используются в аналитической химии как индикаторы. При изменении pH происходит протонирование или депротонирование молекулы индикатора, что влечет за собой перераспределение электронной плотности в сопряженной системе. Например, индикатор метиловый оранжевыйв нейтральной и щелочной средах окрашен в желтый цвет. В кислой среде вследствие протонирования одного из атомов азота происходит изменение в распределении электронной плотности в сопряженной системе молекулы, являющееся причиной изменения желтой окраски на красную. Протонированная форма молекулы метилового оранжевого может быть описана двумя мезомерными структурами, одна из которых хиноидная. Полагают, что изменение окраски в основном обусловлено вкладом хиноидной структуры (выделена цветом):
Имеется большое число кислотно-основных индикаторов, относящихся к разным классам окрашенных веществ, интервалы перехода окраски которых перекрывают весь диапазон значений pH. Большую ценность представляют индикаторы с узким интервалом перехода, например нитразиновый желтый. Альдегиды и кетоны: классификация; номенклатура; химическая идентификация, спектральные характеристики. Представители: формальдегид (формалин), ацетальдегид, хлораль (хлоральгидрат), акролеин, бензальдегид, ацетон, циклогексанон, ацетофенон.
Альдегидами называются соединения, в которых карбонильная группа соединена с углеводородным ради капом и атомом водорода, а кетонами карбонильные соединения с двумя углеводородными радикалами. В альдегидах и кетонах функциональной группой является карбонильная группа >С=O, поэтому оба класса этих родственных веществ относятся к карбонильным соединениям:
В зависимости от строения углеводородных радикалов альдегиды и кетоны бывают алифатическими (насыщенными и ненасыщенными) и ароматическими. Кетоны, у которых карбонильная группа соединена с одинаковыми углеводородными радикалами, называются симметричными. Номенклатура. Родовое название альдегиды имеют соединения, у которых группа — СН=О присоединена к атому углерода. В названиях ациклических альдегидов группа —СНО, если она является старшей и находится в главной цепи, обозначается суффиксом -аль. Нумерация ведется в этом случае от нее, поэтому локант «1» опускается. Диальдегиды называют путем добавления суффикса -диаль к названию родоначальной структуры. Если группа —СНО не является старшей или находится не в главной цепи, то используют префикс формил-.
Названия циклических альдегидов, в которых группа —СНО как старшая связана с циклом, строятся добавлением суффикса -карбальдегид к названию циклической системы:
Если соответствующая альдегиду карбоновая кислота имеет тривиальное название, то из него может быть образовано и тривиальное название альдегида:
Сохраняются следующие тривиальные названия:
Родовое название кетоны имеют соединения, содержащие карбонильную группу >С=О, связанную с двумя атомами углерода (оксогруппой называется фрагмент =O). Кетоны называют, используя суффикс -он, если нет более старшей группы. В ее присутствии используется префикс оксо-.
Сохраняется тривиальное название «ацетон» для СН3СОСН3. Кетоны Ar— СО—R, в которых карбонильная группа присоединена к бензольному или нафталиновому ядру, называют, заменяя частицу -ил в названии ацильного радикала R—СО— на суффиксы -офенон и -онафтон соответственно:
Дикетоны, производимые от ароматических соединений заменой двух фрагментов — СН= на группы >С=O с последующей перегруппировкой двойных связей, называют, добавляя суффикс -хинон к названию ароматического соединения (иногда это название подвергают модификации):
Низшие алифатические альдегиды и кетоны, за исключением газообразного формальдегида, представляют собой подвижные жидкости. Первые представители (формальдегид, ацетальдегид, ацетон) хорошо растворимы в воде за счет образования с ней водородных связей или гидратных форм. По мере удлинения углеродной цепи растворимость карбонильных соединений в воде снижается. Ароматические карбонильные соединения плохо растворимы в воде.
Отдельные представители. Формальдегид — СН2О — простейший и единственный газообразный альдегид, обладает резким раздражающим запахом, хорошо растворим в воде и спиртах, хуже в эфире, бензоле. В промышленности формальдегид получают парофазным окислением метанола, железо-молибденовые катализаторы обеспечивают выходы до 92%:
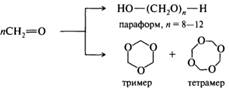
Формальдегид склонен к полимеризации, в зависимости от условий образуется линейный олигомер (параформальдегид, или параформ) или циклические тример и тетрамер. Параформ представляет собой белый порошок, при нагревании разлагается с образованием формальдегида, поэтому используется как форма хранения и транспортировки формальдегида.
При взаимодействии формальдегида с аммиаком образуется гексаметилентетрамин (уротропин). Первоначально образующийся продукт нуклеофильного присоединения аммиака к альдегиду в несколько стадий превращается в уротропин, каркасная структура которого сходна с кристаллической решеткой алмаза:
Гексаметилентетрамин используется в медицине как антисептическое средство. Основная масса производимого промышленностью формальдегида используется для производства феноло- и мочевиноформальдегидных смол. Водный 40%-й раствор формальдегида, стабилизированный добавкой 6—10% метанола, называется формалином (антисептик). Ацетальдегид — СН3СНО — низкокипящая жидкость с резким запахом, смешивается во всех отношениях с водой и большинством органических растворителей. Ацетальдегид, подобно формальдегиду, в присутствии кислот легко образует циклический тример (паральдегид) и тетрамер (метальдегид):
Метальдегид используется в качестве топлива (сухой спирт). Ацетальдегид служит сырьем для промышленного получения многих соединений алифатического ряда — уксусной кислоты, уксусного ангидрида, этилацетата, бутанола-1, хлораля. Хлораль (трихлорацетальдегид, трихлоруксусный альдегид) — CCl3CHO — бесцветная жидкость со специфическим резким запахом, растворим в органических растворителях и нерастворим в воде. Хлораль используют в производстве инсектицидов, в частности в производстве ДДТ, хлорофоса, дихлофоса. Хлоральгидрат (2,2,2-трихлорэтандиол-1,1, C(Сl)3С(ОН)2Н) обладает снотворным и седативным действием, использующихся при анестезии. Чаще хлоралгидрат используется при психическом возбуждении и как противосудорожное средство при спазмофилии,столбняке и т. п. Входит в состав зубных капель «Дента». Бензальдегид — С6Н5СНО — бесцветная жидкость с запахом горького миндаля. Пары бензальдегида обладают слезоточивым действием. Растворим в этаноле, диэтиловом эфире и других органических растворителях, практически нерастворим в воде. В природе встречается в виде гидроксинитрила C6H5CH(OH)CN (как составная часть амигдалина). Бензальдегид используют для синтеза коричной кислоты и альдегида, бензилбензоата, трифенилметановых красителей. Акролеин (акриловый альдегид) — СН2=СНСНО — простейший ненасыщенный альдегид, представляющий собой бесцветную слезоточивую жидкость с резким запахом, образуется при термическом разложении жиров (кухонный чад), растворим в воде и органических растворителях. Акриловый альдегид легко полимеризуется и окисляется, поэтому его хранят в присутствии ингибиторов радикальных реакций. Применяют акриловый альдегид для синтеза акрилонитрила, глицерина, пиридина, некоторых аминокислот. Ацетон — СН3СОСН3 — простейший кетон, бесцветная жидкость с характерным запахом, смешивается с водой и органическими растворителями. Образуется как продукт аномального расщепления углеводов у больных сахарным диабетом (ацетоновые тела). Ацетон находит широкое применение как растворитель лаков и красок, служит сырьем для синтеза уксусного ангидрида и кетена СН2=С=О. Ацетофенон (метилфенилкетон) — C6H5COCH3 — бесцветная маслянистая жидкость, обладающая сильным запахом черёмухи. Хорошо растворяется в этаноле, диэтиловом эфире, ацетоне, хлороформе, бензоле. Ацетофенон и некоторые его производные используются как душистые вещества в парфюмерии. Кроме того, ацетофенон обладает снотворным действием. Его производное — хлорацетофенон — является слезоточивым веществом. Циклогексанон — жидкость с раздражающим запахом (ацетон и мята), растворим в органических растворителях, ограниченно растворим в воде. Получают гидрированием фенола с последующим окислением или дегидрированием циклогексанола. Применяют для получения ɛ-капролактама и адипиновой кислоты, например:
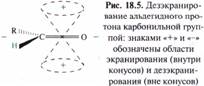
Спектральная идентификация ИК-спектроскопия. В ИК-спектрах альдегидов и кетонов имеется сильная полоса валентных колебаний группы С=О. У алифатических альдегидов максимум полосы поглощения находится около 1725 см-1, у кетонов 1715 см-1. Если карбонильная группа сопряжена с С = С или ароматической системой, максимум полосы поглощения смещается в низкочастотную область: у ароматических альдегидов — 1715-1695 см-1, у α,β-ненасышенных альдегидов — 1710-1685 см-1, у алкил-арилкетонов — около 1690 см-1, у диарилкетонов — около 1665 см-1, у α,β-ненасыщенных кетонов — ~1665 см-1. Для карбонильных групп хинонов характерна полоса поглощения при 1690—1660 см-1. Две полосы слабой интенсивности в области 2720-2690 и 2830-2810 см-1 соответствует валентным колебаниям связи С—Н альдегидов. Спектроскопия ПМР. В спектрах ПМР альдегидов наиболее характеристичными являются сигналы протона альдегидной группы в интервале 9,4-10,4 м. д. (9,72 м. д. у ацетальдегида, 9,48 м. д. у акрилового альдегида, 9,96 м. д. у бензальдегида). Нахождение этого сигнала в столь слабом поле обусловлено магнитной анизотропией карбонильной группы. Внешнее магнитное поле Н0 индуцирует в π-электронной системе связи С=О циркуляцию электронов, которая в свою очередь создает области, где протоны подвергаются соответственно экранированию и дезэкранированию.
Карбонильная группа за счет индуктивного эффекта дезэкранирует протоны у α-атомов углерода альдегидов и кетонов. Сигналы метальных протонов групп, непосредственно связанных с карбонильной группой, наблюдаются в интервале от 1,9 до 2,2 м, д. (2,07 м. д. у ацетона, 1,93 м. д. у ацетальдегида). Метиленовые группы дают сигнал в более слабом поле, например, в спектре пропионового альдегида протоны метиленовой группы дают сигнал 2,40 м. д. В спектрах ПМР хинонов протоны кольца дают сигналы в области 6,7 м. д. Электронная спектроскопия. Насыщенные и несопряженные альдегиды и кетоны имеют в УФ-спектре малоинтенсивную полосу поглощения 270—290 нм, обусловленную n→π*-переходом. Положение полосы n→π*-перехода зависит от растворителя; в полярных растворителях максимум поглощения смещается в коротковолновую область. Водородные связи, образуемые протонными растворителями (вода, спирты) с альдегидами и кетонами, понижают энергию несвязывающих электронов карбонильного атома кислорода. На возбуждение таких электронов требуется большая энергия, а значит, более жесткое излучение, с меньшей длиной волны. При подкислении растворов альдегидов и кетонов полоса n→π*-перехода сильно ослабевает или вообще исчезает. Интенсивная полоса поглощения, соответствующая π→π*-переходу, находится в области 180—195 нм и обычными спектрофотометрами не фиксируется. В сопряженных карбонильных соединениях происходит смещение максимумов поглощения обеих полос в более длинноволновую область. В электронных спектрах хинонов наиболее важная полоса имеет максимум при 400—500 нм и соответствует n→π* -синглет-синглетному переходу.
36. Альдегиды и кетоны: факторы, определяющие реакционную способность; реакции присоединения воды и спиртов, механизм, роль кислотного катализа в образовании ацеталей и полуацеталей. Химические свойства. Двойная связь С=О, подобно связи С=С, представляет собой комбинацию σ- и π-связей. Существенным отличием ее от двойной углерод-углерод- ной связи является высокая полярность. Наибольший вклад в поляризацию связи С=О вносят более поляризуемые р-электроны. Энергия связи С=О (708 кДж/моль) больше, чем связи С=С (620 кДж/моль), а ее длина (0,121 нм) меньше, чем длина связи С=С (0,134 нм). Атом углерода карбонильной группы имеет тригональную конфигурацию, и его валентные углы близки к 120°:
В молекулах карбонильных соединений имеется несколько реакционных центров: • Электрофильный центр — карбонильный атом углерода, возникновение частичного положительного заряда на котором обусловлено полярностью связи С=О. Электрофильный центр участвует в реакциях AN. • Основный центр — атом кислорода с неподеленными парами электронов. С участием основного центра осуществляется кислотный катализ в реакциях присоединения, а также в процессе енолизации. • α-СН-Кислотный центр, возникновение которого обусловлено индуктивным эффектом карбонильной группы. При участии СН-кислотного центра идут многие реакции карбонильных соединений, в частности конденсации. • Связь С—Н в альдегидной группе, разрывающаяся в реакциях окисления. • Ненасыщенные и ароматические углеводородные радикалы, подвергающиеся атаке электрофильными или нуклеофильными реагентами.
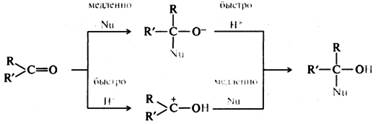
Нуклеофильное присоединение — наиболее характерная реакция карбонильных соединений. В большинстве случаев эта реакция осуществляется по одной из двух схем:
В обоих случаях медленной (скоростьопределяющей) стадией является стадия присоединения нуклеофила. Большинство реакций нуклеофильного присоединения обратимы. Чем больше частичный положительный заряд на карбонильном атоме углерода, тем легче он атакуется нуклеофильной частицей, поэтому электроноакцепторные заместители повышают реакционную способность альдегидов и В ароматических соединениях бензольное кольцо, находящееся в сопряжении с карбонильной группой, проявляет более сильное электронодонорное действие, чем алкильный радикал. За счет положительного мезомерного эффекта бензольного кольца снижается частичный положительный заряд на карбонильном атоме углерода:
Вследствие сказанного ароматические альдегиды и кетоны менее реакционноспособны, чем алифатические. Стерические факторы также оказывают определенное влияние на реакционную способность карбонильных соединений: объемные радикалы затрудняют подход нуклеофила к карбонильному атому углерода и, следовательно, снижают скорость реакций. Некоторые реакции присоединения в этих случаях вообще не осуществляются. Например, 2,2,4,4-тетраметилпентанон-З и 2,2,4-триметилпентанон-З, имеющие объемные трет-бутильные и изопропильный радикалы, не вступают во многие реакции присоединения.
По тем же причинам циклические кетоны, у которых конформационная подвижность радикалов существенно ограничена, более реакционноспособны, чем их ациклические аналоги. Например, циклопентанон значительно активнее, чем пентанон-3, в молекуле которого осуществляется свободное вращение вокруг всех углерод-углеродных связей, вследствие чего приближение нуклеофильной частицы к карбонильной группе затрудняется.
Молекулы альдегидов (кроме формальдегида) и несимметричных кетонов прохиральны, две стороны плоской части их молекул являются энантиотопными (re- и si -стороны). Атака нуклеофилом равновероятна с обеих сторон молекулы, поэтому в реакциях нуклеофильного присоединения образуются рацематы:
Реакции с кислородсодержащими нуклеофилами. Реакция с водой. Альдегиды и в значительно меньшей степени кетоны обратимо присоединяют воду, образуя гидратные формы (гем-диолы):
Положение равновесия в этой реакции зависит от реакционной способности карбонильного соединения. Формальдегид в водном растворе при 25 °С гидратирован практически на 100%, ацетальдегид и пропаналь — на 51 и 46% соответственно; в водном растворе ацетона гидратная форма практически отсутствует. Галогенированные в α-положение альдегиды и кетоны имеют высокое содержание гидратных форм в водных растворах. Трихлороацетальдегид (хлораль) образует устойчивую кристаллическую гидратную форму — хлоральгидрат, отщепить от молекулы которого воду можно только при действии концентрированной серной кислотой. Реакция со спиртами. Спирты обратимо присоединяются к альдегидам с образованием полуацеталей. В спиртовых растворах альдегидов полуацетали находятся в равновесии с карбонильными соединениями. Так, в этанольном
Полуацетали обычно не выделяют из реакционной смеси из-за их неустойчивости. Исключение составляют циклические полуацетали, образующиеся самопроизвольно из γ- и δ-гидроксиальдегидов. Например, доля циклического
Полуацетали при взаимодействии со второй молекулой спирта превращаются в ацетали:
Ацетали получают из альдегидов или кетонов в присутствии кислоты. Реакция начинается с протонирования молекулы карбонильного соединения, протонированная форма альдегида (I) легче взаимодействует с таким слабым нуклеофилом, как молекула спирта. После присоединения спирта происходит отщепление протона (возврат катализатора) от оксониевого иона и образуется полуацеталь. Дальнейшее превращение полуацеталя в ацеталь протекает только в условиях кислотного катализа и представляет собой реакцию мономолекулярного нуклеофильного замещения. Молекула полуацеталя протонируется по гидроксильной группе, которая при этом превращается в хорошую уходящую группу — молекулу воды. После отщепления воды возникает карбокатион (II), стабилизированный при участии неподеленной пары электронов атома кислорода этоксигруппы. К карбокатиону присоединяется нуклеофил (молекула спирта), затем отщепляется протон, и образуется конечный продукт.
Образование ацеталей является обратимой реакцией, поэтому ацетали способны гидролизоваться в кислой среде. К щелочному гидролизу они устойчивы, что позволяет использовать реакцию ацетализации для защиты карбонильной группы. Обычно в целях защиты получают циклические ацетали, используя в качестве реагента этиленгликоль. Образование циклических ацеталей можно использовать также для защиты 1, 2- и 1,3-диольных фрагментов молекул, что широко применяется в химии углеводов. 37. Альдегиды и кетоны: механизм АN; присоединение гидросульфита натрия, циановодорода, магнийорганических соединений, значение этих реакций. Нуклеофильное присоединение. Реакции с серосодержащими нуклеофилами. Реакция с гидросульфитом натрия. Альдегиды и кетоны при взаимодействии с гидросульфитом натрия образуют гидросульфитные производные (α-гидроксисульфонаты натрия):
В эту реакцию вступают большинство альдегидов, метилкетоны и циклические кетоны. Реакцию проводят с насыщенным раствором гидросульфита натрия, при этом выпадает в осадок кристаллическое гидросульфитное производное альдегида или кетона. Гидросульфитные производные гидролизуются в исходные соединения в кислой или щелочной среде, их образование используют в целях выделения из смеси и очистки карбонильных соединений. Реакции с углеродсодержащими нуклеофилами. В результате взаимодействия альдегидов и кетонов с углеродсодержащими нуклеофилами наращивается углеродный скелет карбонильного соединения, благодаря чему эти реакции имеют широкое применение в синтетической органической химии. Такими нуклеофилами служат циановодородная кислота, реактивы Гриньяра, различные соединения с выраженными СН-кислотными свойствами. Присоединение циановодородной кислоты. Реакция приводит к образованию гидроксинитрилов и позволяет удлинить углеродную цепь на один атом углерода:
Реакция катализируется основаниями, потому что в слабой циановодородной кислоте концентрация активных нуклеофильных частиц — цианид-ионов — очень низка. Медленной стадией является присоединение цианид-иона.
Гидроксинитрилы гидролизуются в кислой среде в α-гидроксикарбоновые кислоты:
Присоединение магнийорганических соединений. Взаимодействие альдегидов и кетонов с магнийорганическими соединениями RMgHal (реактивами Гриньяра) является одним из универсальных способов синтеза спиртов: из фомальдегида получают первичные спирты, из других альдегидов — вторичные, а из кетонов — третичные:
На первой стадии реакции, которая проводится обычно в среде безводного диэтилового эфира, происходит нуклеофильное присоединение магнийорганического соединения к альдегиду или кетону. На следующем этапе образовавшийся магниевый алкоголят гидролизуется разбавленной минеральной кислотой или, если образующийся спирт чувствителен к действию кислоты, раствором хлорида аммония. Аналогично магнийорганическим соединениям происходит присоединение литийорганических соединений. Литийорганические соединения более реакционноспособны, чем реактивы Гриньяра, поэтому их применяют в реакциях с малоактивными карбонильными соединениями. 38. Альдегиды и кетоны: реакции присоединения-отщепления – образование иминов, оксимов, гидразонов, семикарбазонов, использование этих реакций для идентификации оксосоединений. Нуклеофильное присоединение. Реакции с азотсодержащими нуклеофилами. Альдегиды и кетоны взаимодействуют с различными соединениями, содержащими аминогруппу, при этом нуклеофильное присоединение чаще всего сопровождается отщеплением воды:
Реакция катализируется как кислотами, так и основаниями, соответственно и гидролиз полученных производных может осуществляться в кислой и щелочной средах. Присоединение нуклеофила к карбонильному соединению протекает через биполярный ион (I) и приводит к образованию неустойчивого гем-аминоспирта (II), который затем подвергается дегидратации в конечный продукт. Такой ход реакций альдегидов и кетонов с соединениями, содержащими аминогруппу, обусловливает их общее название как реакций присоединения-отщепления:
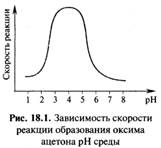
Скорость реакций присоединения-отщепления зависит от pH среды. При сравнительно высоких значениях pH медленной (скоростьопределяющей) стадией является отщепление воды от протонированной формы гем-аминоспирта (III). По мере увеличения кислотности среды концентрация катиона (III) возрастает и скорость реакции растет. При низких значениях pH медленной стадией является взаимодействие карбонильного соединения с нуклеофилом. Это связано с тем, что в сильнокислой среде нуклеофил XNH2 существует в виде неактивного аммониевого иона XNH3+. Таким образом, кривая зависимости скорости реакции от pH среды имеет колоколообразную форму, как это показано на примере реакции образования оксима ацетона (CH3)2C=NOH. Оптимум процесса в данном случае приходится на pH ~ 4.
Реакция с аминами. При взаимодействии альдегидов и кетонов с первичными аминами образуются N- замещенные имины (основания Шиффа):
Имины, полученные из алифатических аминов и алифатических карбонильных соединений, обычно малоустойчивы, быстро разлагаются или полимеризуются. Производные ароматических аминов или ароматических альдегидов более стабильны. Образование иминов происходит в ряде биохимических реакций, например, на одной из стадий зрительного цикла. Реакция с гидразинами. При взаимодействии альдегидов и кетонов с гидразином и замещенными гидразинами получаются гидразоны. Свободная аминогруппа гидразона способна вступать в реакцию со второй молекулой карбонильного соединения с образованием азина, поэтому гидразоны в большинстве случаев бывает трудно выделить.
Замещенные гидразины, особенно арилгидразины, образуют в реакциях с карбонильными соединениями устойчивые гидразоны. Арилгидразоны представляют собой хорошо кристаллизующиеся соединения с четкими температурами плавления, благодаря чему их можно использовать для идентификации карбонильных соединений (качественная реакция).
С помощью высокоэффективной жидкостной хроматографии 2,4-динитрофенилгидразонов проведено количественное определение альдегидов и кетонов, образующихся в атмосфере при фотохимическом окислении углеводородов. Реакция с гидроксиламином. При взаимодействии альдегидов и кетонов с гидроксил амином получаются соответствующие оксимы, например:
Оксимы представляют собой кристаллические вещества, однако из-за низких температур плавления они не пригодны для идентификации альдегидов или кетонов. Образование оксимов лежит в основе оксимного титрования, используемого в фармацевтическом анализе для количественного определения достаточно активных альдегидов и кетонов, например, таким методом определяют камфору (качественная реакция). Альдегид или кетон вводят в реакцию с гидрохлоридом гидроксиламина, выделившийся при этом хлороводород оттитровывают щелочью. Реакция с семикарбазидом. При взаимодействии альдегидов и кетонов с семикарбазидом получаются семикарбазоны:
Семикарбазоны — кристаллические вещества с четкими температурами плавления, и поэтому, как и гидрозоны, их используют для идентификации альдегидов и кетонов (качественная реакция). Некоторые семикарбазоны применяют в качестве лекарственных средств. Альдегиды и кетоны: реакции с участием a-СН-кислотного центра – енолизация, строение енолят-иона, кето-енольная таутомерия, галоформная реакция, иодоформная проба, альдольная и кротоновая конденсации. Реакция Канниццаро (механизм). Нуклеофильное присоединение. Реакции с углеродсодержащими нуклеофилами. С соединениями, обладающими СН-кислотными свойствами, альдегиды и кетоны способны вступать в различные реакции конденсации. Соединение, содержащее подвижный водород, в этих реакциях выступает в качестве нуклеофильного реагента и называется метиленовой компонентой, а альдегид или кетон — карбонильной компонентой. Реакции присоединения часто сопровождаются отщеплением воды. Реакции конденсации карбонильных соединений протекают в условиях кислотного и основного катализа.
где X и Y — электроноакцепторные заместители (один или два). Альдольная конденсация. Реакция протекает при действии на альдегиды или кетоны разбавленных щелочей. При этом одна молекула альдегида представляет собой карбонильную компоненту, а другая — метиленовую.
При действии основания альдегид отщепляет протон от α-СН-кислотного центра и превращается в карбанион (I), заряд в котором д
|
||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 3112; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.213.98 (0.012 с.) |