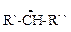Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
При проведении реакций галогенирования
Сырье, использующееся в производстве, пожаро-, взрывоопасно и токсично. Особую опасность представляют сами галогены. Величина ПДК в рабочей зоне для хлора составляет 0,001 мг/л, для брома 0,002 мг/л. Поэтому для предотвращения утечки галогенов перед проведением процесса необходимо проверять целостность и герметичность аппаратуры и трубопроводов. Следует обращать внимание на использование хлора в зимних условиях, т. к. температура кипения его составляет минус 33,6 оС. Баллоны или танки с хлором перед использованием выдерживают в помещении до достижения комнатной температуры. Нельзя их нагревать открытым пламенем. При утечке хлора возникает желто-зеленое облако, которое перемещается по направлению движения воздуха, стелющееся по полу (плотность газообразного хлора 3,21 г/л). Для нейтрализации используют водяную завесу. Все рабочие места должны быть оборудованы местной вентиляцией с повышенной кратностью обмена воздуха. На рабочих местах необходимо иметь средства индивидуальной защиты – противогазы, очки и резиновые перчатки. Производственные помещения оборудуются автоматическими датчиками определения хлора. Загрузку брома ведут в специальных боксах, снабженных усиленной приточно-вытяжной вентиляцией. Галогеноальдегиды и кетоны, а также ароматические соединения, содержащие галоген в боковой цепи, являются сильными лакриматорами. При их утечке помещение и аппаратуру обрабатывают раствором щелочи. При попадании на кожу пораженное место моют раствором соды. При поглощении галогенов щелочами нельзя использовать водный аммиак, т. к. образуются высоко взрывоопасные тригалогениды азота. Проведение процессов галогенирования требует соблюдения высокой трудовой и технологической дисциплины.
Экология Уходящие из сферы реакции газы (хлороводород и хлор) при малотоннажном производстве поглощают щелочами. В крупнотоннажном производстве их разделяют, хлор возвращают в реакцию, а HCl поглощают водой с получением товарной соляной кислоты. Кубовые остатки, полученные после ректификации или разгонки продуктов галогенирования, содержат полигалогенпроизводные, представляющие серьезную экологическую опасность. Пока единственным методом их обезвреживания является сжигание в печи в токе природного газа с распылением выше факела раствора щелочи. Но и в этом случае возможно образование диоксинов. Необходима разработка методов их квалифицированной переработки с получением полезных или безопасных веществ. Из-за чрезвычайно низкой биоразлагаемости галогенпроизводных и их высокой стойкости к окислению нельзя отходы закачивать в глубокие пласты земли. Через многие годы они могут появиться в совершенно неожиданном месте и вызвать загрязнение среды и отравление живых организмов.
В России для обеззараживания используют хлорирование воды. При утечке в питьевой водоем производных фенола, а также при появлении в воде продуктов разложения сине-зеленых водорослей («цветение воды») необходимо снижать подачу хлора в воду, т. к. хлорпроизводные имеют существенно более высокую токсичность, чем соответствующие С–Н соединения. 2.2. реакции нуклеофильного замещения
Реакции нуклеофильного замещения широко представлены в синтезе лекарственных средств. Эти процессы являются важнейшими при введении в молекулу в ряду алифатических, ароматических и гетероциклических соединений таких фармакофорных групп, как OH, OAlk, NRR΄, Hal, SH, SR и других. Кроме того, такие реакции используются в синтезе гетероциклических соединений, азометинов, гидразонов и для введения фармакофорных ацильных группировок. Некоторые синтетические возможности реакций этого типа представлены на схеме:
В данном разделе рассмотрены три темы: нуклеофильное замещение у насыщенного атома углерода, реакции нуклеофилов с соединениями, содержащими полярные кратные связи, а также нуклеофильное замещение в ароматическом и гетероциклическом рядах.
2.2.1 РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ У НАСЫЩЕННОГО АТОМА УГЛЕРОДА
Общая схема реакций, нуклеофилы, электрофилы, нуклеофугные группы. Типы реакций. Алкилирующие реагенты. Асинхронное нуклеофильное замещение, механизм реакции SN1, побочные реакции, закономерности. Синхронный механизм (SN2), закономерности, влияние растворителей на механизм процессов, уравнение Свена-Скотта, сила нуклеофила. Алкилирование аминов, реагенты, методы получения первичных, вторичных и третичных аминов, технологические аспекты, синтез многотоннажных продуктов, анальгина, аминазина, фенилэфрина и пуриновых алкалоидов. Алкилирование фенолов и СН-кислот на примере производства анизола и вератрола, получения барбитуратов, папаверина и дротаверина.
В начале данного раздела необходимо рассмотреть терминологию, которая используется при описании реакций. Нуклеофильное замещение у насыщенного атома углерода состоит в замещении нуклеофугной группы Х нуклеофилом Y: (R)3-C-X + Y - → (R)3-C-Y + X -
Атом углерода электрофила содержит электроноакцепторный заместитель Х, обладающий отрицательным индуктивным эффектом. Нуклеофил Y- – соединение, содержащее группы с целочисленным отрицательным зарядом или неподеленными парами электронов. Атака нуклеофила на насыщенный атом углерода возможна в том случае, если происходит анионоидный отрыв нуклеофугной группы. Первостепенную роль играет электроотрицательность атома Х: чем она выше, тем больше частично положительный заряд на атоме углерода электрофила. Группы, обладающие слабым индуктивным эффектом, такие как О-, -S-, -N<, могут быть замещены нуклеофилом, если их дополнительно активировать. Например, для замещения гидроксигруппы в спиртах на нуклеофил необходимо ее протонирование либо получение из спирта эфиров с серной или арилсульфокислотой – (R)3C-O-SO2-O-C(R)3, (R)3C-O-SO2-Ar. Широко используещееся получение галогеналкилов из спиртов с помощью взаимодействия с SOCl2; PCl3; PBr3; PCl5 также идет через стадию активации – образование эфиров типа: (R)3C-O-SOCl, (R)3C-O-PCl2 или (R)3C-O-PCl4. Амины являются нуклеофилами. Для замещения атома азота в алкильном остатке необходимо превратить аминогруппу в тетраалкил(арилалкил)- аммониевую, при этом существенно возрастает отрицательный индуктивный эффект (-I эффект). Однако при действии нуклеофила могут протекать и реакции элиминирования алкильного остатка. Если атом кислорода или N-R группа находятся в напряженном трехчленном цикле (в оксиранах, т. е. оксидах олефинов, или в этилениминах), то благодаря действию гетероатомов атака нуклеофила также идет в мягких условиях.
Направление атаки нуклеофила зависит от электронного характера заместителей в трехчленном цикле и от условий проведения процесса. В кетонах и производных карбоновых кислот галоген, находящийся в a-положении к карбонилу, также легко замещается нуклеофилом, поскольку карбонильная группа имеет сильный -I эффект. При наличии у атома углерода электрофила нескольких атомов галогена их замещение затруднено из-за взаимного перекрывания орбиталей атомов галогена. Как уже отмечалось в разделе 1.4.6, в реакциях этого типа большое влияние на ход процесса оказывает растворитель. Действие различных растворителей подробно будет рассмотрено в данном разделе при обсуждении механизма реакций. Типы реакций
Реакции нуклеофильного замещения имеют большое разнообразие и в общем виде они представлены в табл. 2.10.
Таблица 2.10
Из табл. 2.10 видно, что при всем разнообразии реакции можно разделить на следующие группы: синтез галогенопроизводных из спиртов; алкилирование спиртов, фенолов, аминов, цианистого и роданистого калия, меркаптопроизводных и СН-кислот. При рассмотрении методов получения лекарственных средств следует отметить большое количество препаратов, в синтезе которых используются реакции нуклеофильного замещения. В качестве примеров можно привести ряд из них – димедрол, хлорпромазин (аминазин), анальгин, папаверин, барбитураты, фенилэфрин (мезатон), в синтезе которых особенно наглядно видно применение этих реакций. Пунктирной линией выделены фрагменты молекулы, введенные с помощью реакций нуклеофильного замещения.
Препарат димедрол (дифенгидрамин), как ранее уже упоминалось, экранирует Н1-гистаминовые рецепторы и устраняет эффекты гистамина, опосредуемые через этот тип рецепторов. Действие на ЦНС обусловлено блокадой Н3-гистаминовых рецепторов. Применяют дифенгидрамин (димедрол) при различных видах аллергии. Он входит в качестве одной из компонент в средство от морской и воздушной болезни – авиоморин. Препарат хлорпромазин (аминазин, действие рассмотрено в разделе 2.1.6). Препарат анальгин (международное название – метамизол натрия) обладает анальгезирующим, жаропонижающим и противовоспалительным действием. Угнетает активность циклооксигеназы, тем самым снижает уровень свободных радикалов в организме, ингибирует перекисное окисление липидов. Препятствует проведению болевых импульсов, повышает порог болевой чувствительности, увеличивает теплоотдачу. Тонкий механизм болеутоляющего действия неизвестен. Применяют для снятия головной и зубной боли, при коликах, хорее, ревматизме и инфарктах легкого и миокарда, травмах, ожогах и т. д. Препарат папаверин (опийный алкалоид) обладает спазмолитическим и гипотензивным эффектом. Ингибирует фосфодиэстеразу, повышает в клетках концентрацию ц-АМФ и понижает уровень кальция. Применяют для снятия спазма сосудов головного мозга, при лечении стенокардии, эндатериита и колик. Является одной из компонент композиций, например папазола. Еще одной группой препаратов, в синтезе которых используются реакции нуклеофильного замещения, являются снотворные средства ряда производных барбитуровой кислоты (фенобарбитал, нембутал и др.). Они взаимодействуют с мембранами клеток, изменяя их физико-химические свойства, снижают возбудимость нейронов и подавляют сенсорные зоны головного мозга. Вызывают сон, отличающийся от физиологического. В качестве одной из компонент фенобарбитал входит в состав корвалола (валокордина). Препарат нембутал (пентотал натрия) совместно с кофеином вызывает состояние, которое называют «сывороткой правды». Применение барбитуратов несовместимо с приемом алкоголя, т. к. вызывает усиление его действия. Действие фенилэфрина описано в разделе 2.1.1. Подробный синтез препаратов приведен далее.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 440; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.223.123 (0.018 с.) |