
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции трансаминирования, ферменты, их коферментная группа. Биологическое значение реакций. Определение аминотрансфераз с диагностической целью
1. Промежуточный обмен аминокислот чаще всего начинается с отщепления α-аминогруппы от аминокислоты. Это происходит с помощью двух типов реакций: • трансаминирования; • дезаминирования. Трансаминирование - реакция переноса аминогруппы с аминокислоты (донора) на α-кетокислоту (акцептор), в результате чего образуются новая кетокислота и новая аминокислота. Реакция обратима.
Аминотрансферазы обладают субстратной специфичностью к разным аминокислотам. В тканях человека обнаружено более 10 различных аминотрансфераз. Наиболее распространенными являются: • аспартатаминотрансфераза (АСТ), по обратной реакции - глутаматоксалоацетаттрансаминаза; • аланинаминотрансфераза (АЛТ), по обратной реакции - глутаматпируваттрансаминаза. Название каждой аминотрансферазы включает названия субстратов: • донора аминогруппы (аминокислоты); • акцептора аминогруппы (α-кетокислоты). Например, фермент, катализирующий реакцию
Основными донорами аминогрупп в реакциях трансаминирования являются глутамат, аспартат и аланин. Реакции трансаминирования играют большую роль в обмене аминокислот. • Путем трансаминирования из соответствующих α-кетокислот синтезируются заменимые аминокислоты, если их в данный момент в ткани недостаточно. Таким образом происходит перераспределение аминного азота в тканях и органах. •
Трансаминирование происходит во многих тканях, но наиболее активно - в печени. 2. В клинике широко используется определение активности некоторых аминотрансфераз в сыворотке крови, особенно часто - АСТ и АЛТ. Эти ферменты являются органоспецифическими, наиболее активны в клетках печени и сердца. В норме их активность в крови мала - 5-40 ЕД/л. Существуют изоферменты АСТ: цитозольная форма (ц-АСТ) и митохондриальная (м-АСТ). В печени, миокарде и большинстве других органов м-АСТ представляет 80% массы фермента, но в сыворотке - лишь менее 12% как у здоровых людей, так и у больных. Повышение активности м-АСТ в сыворотке крови имеет место при острых поражениях печени, инфаркте миокарда, сопровождающихся некрозом тканей и разрушением клеточных мембран, при этом повышение активности м-АСТ отражает тяжесть болезни, поражение органа и прогноз. Определение активности АЛТ и АСТ применяется для диагностики заболеваний миокарда и печени, в том числе при отравлении хлорорганическими соединениями, используемыми на химических производствах (CCl4, хлороформ и др.). В этом случае активность ферментов в сыворотке крови увеличивается до 400 ед. и больше. • Особенно важное значение для диагностики имеет увеличение активности АЛТ при безжелтушных формах вирусного гепатита. • Для определения степени поражения печени и сердца определяют соотношение активностей АСТ-АЛТ в сыворотке крови - коэффициент де Ритиса, который в норме составляет 1,33+0,42. • При гепатитах активность АЛТ увеличивается в 6-8 раз по сравнению с нормой, а АСТ - в 2-4 раза (рис. 9.4). Коэффициент де Ритиса уменьшается до -0,6. Однако при циррозе печени коэффициент де Ритиса приближается к 1,0 вследствие развивающегося некроза тканей и выхода в кровь митохондриальной фракции АСТ. • При инфаркте миокарда активность АСТ увеличивается в 8-10 раз, а активность АЛТ - в 1,5-2 раза (рис. 9.5). Коэффициент де Ритиса значительно увеличивается. При стенокардии, пороках сердца, инфаркте легкого активность аминотрансфераз в крови не увеличивается, что дает возможность дифференциальной диагностики заболеваний сердца.
Особую важность имеет возможность дифференциальной диагностики тяжести заболеваний печени и сердца, а также анализ динамики течения заболевания. При инфаркте миокарда АсАТ доминирует в 95% случаев. Подъём начинается через 4-6 часов с момента приступа и к концу первой недели активность энзима нормализуется. В остром периоде ИМ увеличение уровня АсАТ является достоверным диагностическим тестом. По сравнению с активностью КФК или ЛДГ указанный фермент уступает. При дифференциальной диагностике инфаркта миокарда и поражения скелетных мышц имеет значение коэффициент КФК / АсАТ. Если он составляет около 27 (13-56), то это свидетельствует о поражении скелетной мускулатуры, и около 5 (2-9) – о патологии кардиомиоцитов. Умеренное повышение активности аминотрансфераз наблюдается у пациентов с пароксизмальной тахикардией, гипертоническими кризами; а выраженный рост данных энзимов отмечается при гангрене мышц, прогрессирующем миозите, миокардите, некрозе и травме скелетных мышц. При эмболии лёгких отмечается резкий подъём активности АлАТ и АсТ, при этом уровень КФК остаётся в пределах нормы. При инфекционном гепатите величины аминотрансфераз увеличиваются с большим постоянством в очень ранние сроки – ещё до появления желтухи. В дожелтушный период заболевания коэффициент АсАТ/АлАТ становиться значительно меньше 1. В желтушный период в течение 2-5 суток активность ферментов приходит к норме при неосложнённых формах заболевания. Поэтому аминотрансферазную пробу можно использовать в качестве критерия полноты выздоровления. Длительно продолжающееся повышение цифр трансаминаз или рост их в более поздние сроки заболевания может означать развитие массивного некроза ткани печени. Максимальный подъём величин АсАТ и АлАТ происходит при остром вирусном гепатите – более чем в 100 раз. Умеренная гиперферментемия наблюдается при циррозе печени и хроническом гепатите, в том числе и у больных, страдающих алкоголизмом, когда уровень АсАТ обычно оказывается выше, чем АлАТ. При этом возрастают цифры γ-глутамилтранспептидазы, глутаматдегидрогеназы и процентное содержание ЛДГ5 в спектре изоферментов лактатдегидрогеназы. При ревмокардите, остром панкреатите, кровоизлиянии в мозг, дифтерии, опухолевом процессе активность энзимов в сыворотке крови и трансудатах умеренно повышается.
|
||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 86; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.171.136 (0.006 с.) |
 Реакция трансаминирования происходит с участием ферментов аминотрансфераз (трансаминаз), которые локализованы в цитозоле и митохондриях клеток практически всех органов. Коферментом этих ферментов является производное витамина В6 - пиридоксальфосфат. Трансаминированию подвергаются все аминокислоты, кроме лизина, треонина и пролина.
Реакция трансаминирования происходит с участием ферментов аминотрансфераз (трансаминаз), которые локализованы в цитозоле и митохондриях клеток практически всех органов. Коферментом этих ферментов является производное витамина В6 - пиридоксальфосфат. Трансаминированию подвергаются все аминокислоты, кроме лизина, треонина и пролина. называется глутаматоксалоацетатаминотрансфераза. По субстратам обратной реакции этот фермент называется аспартатаминотрансферазой (АСТ). Название акцептора - α-кетоглутарата - из названия фермента обычно исключается, так как эта кетокислота является основным акцептором аминогрупп в организме.
называется глутаматоксалоацетатаминотрансфераза. По субстратам обратной реакции этот фермент называется аспартатаминотрансферазой (АСТ). Название акцептора - α-кетоглутарата - из названия фермента обычно исключается, так как эта кетокислота является основным акцептором аминогрупп в организме. Трансаминирование - один из начальных этапов катаболизма аминокислот. Образующиеся α-кетокислоты могут затем окисляться в цикле трикарбоновых кислот, а некоторые - использоваться для синтеза глюкозы или кетоновых тел.
Трансаминирование - один из начальных этапов катаболизма аминокислот. Образующиеся α-кетокислоты могут затем окисляться в цикле трикарбоновых кислот, а некоторые - использоваться для синтеза глюкозы или кетоновых тел.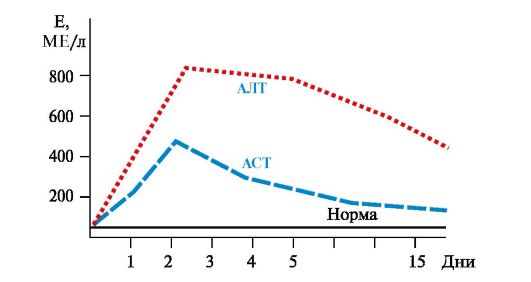 Рис. 9.4. Активность аминотрансфераз сыворотки крови при остром гепатите
Рис. 9.4. Активность аминотрансфераз сыворотки крови при остром гепатите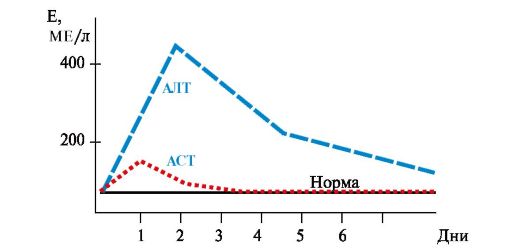 Рис. 9.5. Активность аминотрансфераз сыворотки крови при инфаркте миокарда
Рис. 9.5. Активность аминотрансфераз сыворотки крови при инфаркте миокарда


