
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Аналитическое определение меди ⇐ ПредыдущаяСтр 4 из 4
При внесении солей меди в пламя горелки, пламя окрашивается в зелёно-голубой цвет. В отсутствии других катионов (например, никеля), ионы меди можно обнаружить по характерной голубой (зелёно-голубой) окраске раствора и по переходу окраски в ярко-синий в присутствии аммиака. При пропускании через раствор, содержащий ионы меди, сероводорода наблюдается выпадение черного осадка:
Cu2+ + Н2S = CuS¯ + 2Н+
Применение меди Металлическая медь используется в электротехнике, при производстве труб, теплообменных устройств. Широко используются сплавы на основе меди – бронзы, латуни. Соединения меди применяются в качестве катализаторов.
Цинк
Цинк мягкий белый металл, на воздухе покрыт прочной оксидной пленкой. Основные минералы – сульфид и карбонат цинка. Для получения металлического цинка их обжигают:
ZnCO3
2ZnS + 3O2
Полученный оксид восстанавливают углеродом:
ZnO + С
Химические свойства цинка Цинк активный металл, сильный восстановитель, во всех соединениях проявляет степень окисления +2. Реагирует с кислородом, галогенами, серой. Цинк реагирует со многими сложными веществами: – проявляет амфотерные свойства, реагирует и с кислотами, и со щелочами, например: Zn + 2HCl = ZnCl2 + H2
Zn + 2NaOH + 2Н2O = Na2[Zn(OH)4] + H2
– цинк проявляет все свойства металла средней активности, реагируя с растворами кислотами, солей, водяным паром при высокой температуре; – как типичный d -элемент, цинк легко образует комплексные соединения, например аммиачные комплексы. Так, осадок амфотерного гидроксида цинка растворяется в избытке раствора аммиака:
Zn(OH)2 + 4NH3×Н2O = [Zn(NH3)4](OH)2 + 4Н2O
Это свойство позволяет различить амфотерные Al(OH)3 и Zn(OH)2: Al (OH)3 в растворе аммиака не растворяется.
Применение цинка
Большое количество цинка идет на производство оцинкованной стали – покрытие более активным металлом предохраняет железо от коррозии. Цинк компонент многих сплавов, например, латуни. Оксид цинка – белый пигмент для красок. В лаборатории металлический цинк применяется в качестве восстановителя.
Хром
Хром – твёрдый металл серебристого цвета. Многие соединения хрома красиво окрашены, название элемент получил от греческого слова crwma – цвет.
Основные соединения хрома – хромистый железняк (хромит) FeO·Cr2O3 и хромат свинца, минерал крокоит PbCrO4. Хром – типичный металл средней активности. Из особенных свойств нужно отметить, что хром (подобно железу и алюминию), пассивируется в холодных концентрированных серной и азотной кислотах; кроме того, хром не растворяется в растворах щелочей. Хром проявляет несколько устойчивых степеней окисления: +2, +4, +6. Большинство соединений хрома характерно окрашены, поэтому реакции с участием хрома идут с изменением окраски. Подобные реакции часто встречаются в задачах повышенной сложности. Рассмотрим соединения хрома и реакции, которые обязательно знать. Соединения хрома(II) очень неустойчивы, легко окисляются до соединений Cr+3, например при стоянии на воздухе:
4Cr(OH)2 + O2 + 2Н2O = 4Cr(OH)3
CrO и Cr(OH)2 имеют основной характер.
Соединения хрома(III) зеленого или серо-зеленого цвета. Cr(OH)3 и Cr2O3 проявляют амфотерные свойства, например:
Cr2O3 + 2NaOH = 2NaCrO2 + Н2O
В жестких условиях, соединения Cr+3 можно окислить до Cr+6: 2Сr(ОН)3 + 4NаОН (конц.) + 3Н2O2 (конц.) ® 2Na2СrO4 + 8Н2O
2CrCl3 + 16КOH + 3Br2 ® 6КBr + 6NaCl + 8H2O + 2К2CrO4
Соединения Cr(III) могут проявлять и восстановительные свойства:
Zn + 2CrCl3 ® 2CrCl2 + ZnCl2
Соединения хрома(VI)
Оксид хрома(VI) CrO3 – типичный кислотный оксид, растворяется в воде с образованием кислот:
2CrO3 + Н2O ® H2Cr2O7
CrO3 + Н2O (изб.) ® H2CrO4
В растворах щелочей CrO3 образует соли хроматы лимонно-жёлтого цвета: CrO3 + 2KOH ® K2CrO4 + H2O
В кислой среде хроматы превращаются в оранжевые дихроматы:
2K2CrO4 + H2SO4 ® K2Cr2O7 + K2SO4 + H2O
В щелочной среде снова образуются хроматы:
K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
Все соединения хрома(VI) – сильные окислители, в нейтральной среде образуются соли хрома(III), в нейтральной – Cr(OH)3, в щелочной – гидроксокомплексы, например:
K2Cr2O7 + 7H2SO4 + 6FeSO4 ® Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
2K2CrO4 + 5H2O + 3NaNO2 ® 2Cr(OH)3¯+ 3NaNO3 + 4KOH
2K2CrO4 + 8H2O+3K2S ® 2K3[Сr(ОН)6]+3S¯ + 4KOH
|
|||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 49; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.238.226 (0.012 с.) |
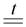 ZnO + CO2
ZnO + CO2


