
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 9. Металлы алюминий, железо, медь, цинк, хромСтр 1 из 4Следующая ⇒
Тема 9. Металлы алюминий, железо, медь, цинк, хром Алюминий
Из элементов III группы главной подгруппы, в соответствии с кодификатором, подробно рассмотрим только алюминий и его соединения. По содержанию в земной коре, алюминий занимает 1 место среди металлов (около 7,5 % по массе). Он входит в состав многих силикатов (полевые шпаты, глины), гидраты оксида алюминия образуют породы бокситы и являются основной алюминиевой рудой.
Получение алюминия Алюминий является очень активным металлом. В небольших количествах его можно получить восстановлением из солей щелочными металлами, например: 3K + AlCl3 = 3KCl + Al
Реакция оксида алюминия с углеродом приводит к образованию карбида алюминия: 2Al2O3 + 9C = Al4C3 + 6CO
В промышленности алюминий получают электролизом расплава бокситов в криолите. Криолит – гексафтороалюминат натрия Na3[AlF6] – минерал, получаемый искусственно, необходим для понижения температуры плавления оксида алюминия. Температура расплава составляет около 950°С, в расплаве присутствуют катионы Al3+, Na+ и анионы O2–, F–. При пропускании тока на катоде будет восстанавливаться менее активный металл алюминий:
Al3+ + 3 ē ® Al0
а на аноде будет окисляться кислород:
2O2– – 4 ē ® O20
Суммарное уравнение электролиза:
2Al2O3 (расплав) катод анод
Химические свойства алюминия 1. Взаимодействие с простыми веществами. На воздухе алюминий покрывается очень прочной оксидной пленкой оксида алюминия, которая защищает металл от дальнейшего окисления. Изделия из алюминия устойчивы даже при достаточно высоких температурах. Тем не менее, мелкодисперсный порошок алюминия легко реагирует со многими неметаллами: кислородом, галогенами, серой, углеродом и даже азотом:
4Аl + 3О2 = 2Аl2О3
2Аl + 3I2 = 2АlI3
2Аl + 3S = Аl2S3
2Аl + N2 = 2АlN
4Аl + 3C = Аl4C3
Три последние соединения при обработке водой подвергаются необратимому гидролизу, разлагаются:
Аl2S3 + 6H2O = 2Аl(OH)3¯ + 3H2S
АlN + 4H2O = Аl(OH)3¯ + NH3×H2O
Аl4C3 + 12H2O = 4Аl(OH)3¯ + 3CH4
2. Взаимодействие со сложными веществами. С водой. Защитная оксидная пленка делает алюминий инертным и по отношению к воде. При снятии защитной оксидной пленки (например, при обработке водным раствором щелочи), алюминий энергично реагирует с водой:
2Al + 6H2O = 2Al(OH)3 + 3H2
С оксидами металлов. Будучи очень активным металлом и имея большое сродство к кислороду, алюминий при нагревании восстанавливает менее активные металлы из оксидов (такой метод получения металлов называется алюмотермия). Так, в случае поджигания смеси порошков оксида железа(III) и алюминия (т.н. термитная смесь), развивается температура 2500–3000°С. В результате этой реакции образуется расплавленное железо:
2Al + Fe2O3 = 2Fe + Аl2О3
С кислотами. Алюминий вытесняет водород из кислотами-неокислителями. Следует помнить, что в обычных условиях, без нагревания, алюминий не реагирует с концентрированными азотной и серной кислотой из-за эффекта пассивации. При нагревании же алюминий окисляется кислотами-окислителями (см. раздел ОВР). Со щелочами. Оксид и гидроксид алюминия обладают амфотерными свойствами, поэтому алюминий взаимодействует со щелочами с выделением водорода, как в расплаве:
2Al + 6NaOH = 2Na3AlO3 + 3H2 так и в растворе:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2 Применение алюминия и его соединений Алюминий легкий и пластичный металл, отлично проводит ток, мало подвержен коррозии. Наибольшее применение металлический алюминий находит в авиастроении, судостроении, изготовлении электрических проводов, посуды, фольги. Мелкодисперсный алюминиевый порошок (алюминиевая пудра) используется в алюмотермии, пиротехнике, в качестве пигмента в красках. Оксид алюминия (минерал корунд) обладает высокой твердостью и температурой плавления. Он применяется как тугоплавкий материал, в качестве абразива, прозрачные монокристаллы Al2O3 применяются в качестве активных элементов рубиновых лазеров.
Переходные металлы В соответствии с кодификатором, рассмотрим свойства важнейших d -металлов – железа, меди, цинка и хрома.
Железо
Железо – самый распространенный тяжелый металл (обычно тяжелыми металлами называют металлы с плотностью более 5 г/см3): его содержание в земной коре составляет около 4,2 % мас., ядро Земли, предположительно, состоит из железо-никелевого сплава.
Самородное железо встречается крайне редко, этот металл входит в состав многих минералов и пород, но основными рудами железа являются: Fe3O4 или FeO×Fe2O3 а наиболее правильная запись Fe+2Fe+32O4 – двойной оксид железа(II,III), минерал магнетит, магнитный железняк, эту же формулу имеет т.н. железная окалина. Это соединение бурого цвета, обладает ферромагнитными свойствами. Fe2O3 – оксид железа(III), минерал гематит, соединение красно-коричневого цвета. FeO – оксид железа(II), минерал вюстит, соединение черного цвета. FeS – сульфид железа(II). FeS2 – дисульфид железа(II), минерал пирит.
Получение железа Металлургия железа подробно представлена в школьных учебниках, приведем основные стадии процесса. Железные руды (оксиды железа) восстанавливают в доменных печах оксидом углерода(II):
Fe2O3 + 3CO ® Fe + 3CO2
FeO + CO ® Fe + CO2
Оксид углерода(II) образуется при сгорании каменноугольного кокса, загружаемого в доменную печь, обычно в две стадии: C + O2 ® CO2
CO2 + C ® 2CO
В доменных печах получают чугун – сплав железа с углеродом, кремнием и другими примесями. Большую часть получаемого чугуна перерабатывают на сталь. В специальных печах-конверторах через расплавленный чугун пропускают газ кислород, примеси окисляются и удаляются в виде шлака (подробнее см. в школьном учебнике). По химическому составу стали делятся на углеродистые (содержание углерода может меняться в широком диапазоне – от 0,02 до 2,14 %) и легированные – с добавками других металлов, придающих стали особые свойства: коррозионную стойкость, повышенную твердость и др.).
Химические свойства железа Железо – металл средней активности. Сложность написания реакций связано с наличием у железа двух достаточно устойчивых степеней окисления +2 и +3. Рассмотрим на примерах. 1. Взаимодействие с неметаллами. С кислородом. Раскаленная железная проволока горит в кислороде с образованием железной окалины:
3Fe + 2O2 = Fe+2Fe+32O4
C галогенами. Фтор, хлор и бром – сильные окислители, железо окисляется до степени окисления +3, например:
2Fe + 3Cl2 = 2FeCl3
Отметим, что при растворении железа в соляной кислоте образуется хлорид железа(II) (в этой реакции железо окисляется менее сильным окислителем H+): Fe + 2HCl = FeCl2 + H2
С менее сильными окислителями – йодом и серой др., железо окисляется до степени окисления +2, например:
Fe + S
При высокой температуре железо реагирует с углеродом и фосфором, образуются соединения Fe3C и Fe3P. 2. Взаимодействие со сложными веществами. С водой. С водяным паром при высоких температурах протекает реакция: 3Fe + 4H2O = Fe+2Fe+32O4+ 4H2
Во влажном воздухе и в воде железо подвергается коррозии, ржавеет:
4Fe + 3O2 + 6H2O = 4Fe(OH)3
Следует отметить, что элементы триады железа – кобальт и никель – коррозии не подвержены, добавки этих металлов делают сталь «нержавеющей». С кислотами-неокислителями, с растворами солей, реагирует как типичный металл средней активности. Без нагревания железо (как и алюминий) не реагирует с концентрированными азотной и серной кислотой из-за эффекта пассивации. При нагревании легко окисляется этими кислотами (см. раздел ОВР). 3. Железо при нагревании реагирует с угарным газом с образованием карбонила железа:
Fе + 5CO = [Fе(CO)5]
4. При высоких температурах в реакциях с сильными окислителями (KClO3, KNO3) железо окисляется до степени окисления +6, образуются ферраты, например:
Fе + KClO3 + 2KОН = K2FeO4 + KCl + Н2O
Железо при нагревании реагирует с соединениями железа(III), надо знать реакции: Fе + Fe2O3
Fе + Fe2(SO4)3
Соединения железа Существуют два гидроксида железа: основание Fe(ОН)2 бледно-зеленого цвета и проявляющий слабые амфотерные свойства гидроксид Fe(ОН)3 бурого цвета. Свежеосажденный Fe(ОН)2 достаточно быстро окисляется кислородом по реакции:
2Fe(ОН)2 + 0,5 O2 + Н2O = 2Fe(ОН)3
Fe(ОН)3 проявляет амфотерность только в концентрированных растворах щелочей: Fe(ОН)3 + 3KОН = Na3[Fe(ОН)6]
При низких температурах более устойчивыми являются соединения железа(III), при высоких – железа(II), на переходе Fe+3 + ē «Fe+2 основано множество ОВР. Здесь рассмотрим некоторые наиболее сложные:
6FeSO4 + 4Н2SO4 + 2KNO3 = 3Fe2(SO4)3 + 2NO + K2SO4 + 4Н2O
4Fe(NO3)2
2FeCl3 + 3(NН4)2S = 2FeS¯ + 6NН4Cl + S¯
2FeCl3 + 2Hg = 2FeCl2 + Hg2Cl2
Медь
Медь переходный металл золотисто-красного цвета, обладает высокой тепло- и электропроводностью, пластична. Медь относится к благородным металлам (в ряду активности расположена после водорода). В природе встречается самородная медь, важнейшими минералами меди являются халькопирит CuFeS2 (медный колчедан), медный купорос CuSO4×5H2O, малахит (CuOH)2CO3.
Получение меди Из-за малой активности, медь достаточно легко восстановить из соединений. C давних пор использовалась прямая выплавка из малахита:
(CuOH)2CO3 + 2СО = 2Cu + 3СО2 + Н2O
В настоящее время медь получают, преимущественно, из халькопирита CuFeS2, причем восстановителем является сама сульфидная сера. В лаборатории медь можно легко получить из оксидов – темно-красного Cu2O или черного CuO, эти реакции часто встречаются в заданиях повышенной сложности: CuO + H2
Cu2O + СО
3CuO + 2NH3
CuO + С
Химические свойства меди В соединениях медь проявляет две степени окисления: +1 и +2. Медь слабый восстановитель, окислить ее можно только сильными окислителями. 1. Из простых веществ медь реагирует только с кислородом, галогенами, серой: Cu + O2 (избыток)
Cu + O2 (недостаток)
Cu + Cl2 = CuCl2
Cu + S
2. Медь растворяется в азотной и концентрированной серной кислоте:
3Cu + 8HNO3 (разб.) = 3Cu(NO3)2 + 2NO + 4Н2O
Cu + 4HNO3 (конц.) = Cu(NO3)2 + 2NO2 + 2Н2O
Cu + 2H2SO4 (конц.) = CuSO4 + SO2 + 2Н2O
3. Медь не растворяется в воде, в кислотах-неокислителях, но в присутствии кислорода идут реакции:
2Cu + 4HCl + O2 = 2CuCl2 + 2Н2O
2Cu + СО2 + Н2O + O2 = (CuOH)2CO3
4. Медь – d -элемент, сильный комплексообразователь. Ион Cu2+ в водном растворе существует в виде иона тетрааквамеди [Cu(Н2O)4]2+ голубого цвета, без воды ион меди бесцветный. В присутствии аммиака образуется более стойкий аммиачный комплекс [Cu(NН3)4]2+ ярко-синего цвета, например: [Cu(Н2O)4]2+ + 4NH3 = [Cu(NH3)4]2+ + 4Н2O
или в молекулярном виде (молекулы воды обычно не указывают):
CuSO4 + 4NH3 = [Cu(NH3)4]SO4 голубой ярко-синий
Аммиачный комплекс меди образуется при растворении гидроксида меди(II) и даже оксида меди(II) в растворе аммиака:
Cu(OH)2¯ + 4NH3×Н2O = [Cu(NH3)4](OH)2 + 4Н2O
CuO + 4NH3×Н2O = [Cu(NH3)4](OH)2 + 3Н2O
5. Как и железо, медь имеет две степени окисления, поэтому возможны реакции: Cu0 + Cu+2O
Cu0 + Cu+2Cl2 + 2NaCl = 2Na[Cu+1Cl2]
Последняя реакция протекает, так как образуется устойчивый комплексный ион.
Применение меди Металлическая медь используется в электротехнике, при производстве труб, теплообменных устройств. Широко используются сплавы на основе меди – бронзы, латуни. Соединения меди применяются в качестве катализаторов.
Цинк
Цинк мягкий белый металл, на воздухе покрыт прочной оксидной пленкой. Основные минералы – сульфид и карбонат цинка. Для получения металлического цинка их обжигают:
ZnCO3
2ZnS + 3O2
Полученный оксид восстанавливают углеродом:
ZnO + С
Химические свойства цинка Цинк активный металл, сильный восстановитель, во всех соединениях проявляет степень окисления +2. Реагирует с кислородом, галогенами, серой. Цинк реагирует со многими сложными веществами: – проявляет амфотерные свойства, реагирует и с кислотами, и со щелочами, например: Zn + 2HCl = ZnCl2 + H2
Zn + 2NaOH + 2Н2O = Na2[Zn(OH)4] + H2
– цинк проявляет все свойства металла средней активности, реагируя с растворами кислотами, солей, водяным паром при высокой температуре; – как типичный d -элемент, цинк легко образует комплексные соединения, например аммиачные комплексы. Так, осадок амфотерного гидроксида цинка растворяется в избытке раствора аммиака:
Zn(OH)2 + 4NH3×Н2O = [Zn(NH3)4](OH)2 + 4Н2O
Это свойство позволяет различить амфотерные Al(OH)3 и Zn(OH)2: Al (OH)3 в растворе аммиака не растворяется.
Применение цинка
Большое количество цинка идет на производство оцинкованной стали – покрытие более активным металлом предохраняет железо от коррозии. Цинк компонент многих сплавов, например, латуни. Оксид цинка – белый пигмент для красок. В лаборатории металлический цинк применяется в качестве восстановителя.
Хром
Хром – твёрдый металл серебристого цвета. Многие соединения хрома красиво окрашены, название элемент получил от греческого слова crwma – цвет.
Основные соединения хрома – хромистый железняк (хромит) FeO·Cr2O3 и хромат свинца, минерал крокоит PbCrO4. Хром – типичный металл средней активности. Из особенных свойств нужно отметить, что хром (подобно железу и алюминию), пассивируется в холодных концентрированных серной и азотной кислотах; кроме того, хром не растворяется в растворах щелочей. Хром проявляет несколько устойчивых степеней окисления: +2, +4, +6. Большинство соединений хрома характерно окрашены, поэтому реакции с участием хрома идут с изменением окраски. Подобные реакции часто встречаются в задачах повышенной сложности. Рассмотрим соединения хрома и реакции, которые обязательно знать. Соединения хрома(II) очень неустойчивы, легко окисляются до соединений Cr+3, например при стоянии на воздухе:
4Cr(OH)2 + O2 + 2Н2O = 4Cr(OH)3
CrO и Cr(OH)2 имеют основной характер.
Соединения хрома(III) зеленого или серо-зеленого цвета. Cr(OH)3 и Cr2O3 проявляют амфотерные свойства, например:
Cr2O3 + 2NaOH = 2NaCrO2 + Н2O
В жестких условиях, соединения Cr+3 можно окислить до Cr+6: 2Сr(ОН)3 + 4NаОН (конц.) + 3Н2O2 (конц.) ® 2Na2СrO4 + 8Н2O
2CrCl3 + 16КOH + 3Br2 ® 6КBr + 6NaCl + 8H2O + 2К2CrO4
Соединения Cr(III) могут проявлять и восстановительные свойства:
Zn + 2CrCl3 ® 2CrCl2 + ZnCl2
Соединения хрома(VI)
Оксид хрома(VI) CrO3 – типичный кислотный оксид, растворяется в воде с образованием кислот:
2CrO3 + Н2O ® H2Cr2O7
CrO3 + Н2O (изб.) ® H2CrO4
В растворах щелочей CrO3 образует соли хроматы лимонно-жёлтого цвета: CrO3 + 2KOH ® K2CrO4 + H2O
В кислой среде хроматы превращаются в оранжевые дихроматы:
2K2CrO4 + H2SO4 ® K2Cr2O7 + K2SO4 + H2O
В щелочной среде снова образуются хроматы:
K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
Все соединения хрома(VI) – сильные окислители, в нейтральной среде образуются соли хрома(III), в нейтральной – Cr(OH)3, в щелочной – гидроксокомплексы, например:
K2Cr2O7 + 7H2SO4 + 6FeSO4 ® Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
2K2CrO4 + 5H2O + 3NaNO2 ® 2Cr(OH)3¯+ 3NaNO3 + 4KOH
2K2CrO4 + 8H2O+3K2S ® 2K3[Сr(ОН)6]+3S¯ + 4KOH
Тема 9. Металлы алюминий, железо, медь, цинк, хром Алюминий
Из элементов III группы главной подгруппы, в соответствии с кодификатором, подробно рассмотрим только алюминий и его соединения. По содержанию в земной коре, алюминий занимает 1 место среди металлов (около 7,5 % по массе). Он входит в состав многих силикатов (полевые шпаты, глины), гидраты оксида алюминия образуют породы бокситы и являются основной алюминиевой рудой.
Получение алюминия Алюминий является очень активным металлом. В небольших количествах его можно получить восстановлением из солей щелочными металлами, например: 3K + AlCl3 = 3KCl + Al
Реакция оксида алюминия с углеродом приводит к образованию карбида алюминия: 2Al2O3 + 9C = Al4C3 + 6CO
В промышленности алюминий получают электролизом расплава бокситов в криолите. Криолит – гексафтороалюминат натрия Na3[AlF6] – минерал, получаемый искусственно, необходим для понижения температуры плавления оксида алюминия. Температура расплава составляет около 950°С, в расплаве присутствуют катионы Al3+, Na+ и анионы O2–, F–. При пропускании тока на катоде будет восстанавливаться менее активный металл алюминий:
Al3+ + 3 ē ® Al0
а на аноде будет окисляться кислород:
2O2– – 4 ē ® O20
Суммарное уравнение электролиза:
2Al2O3 (расплав) катод анод
|
|||||||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 184; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.10.107 (0.145 с.) |
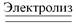 4Al + 3O2
4Al + 3O2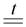 FeS
FeS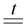 3FeO
3FeO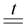 CuO
CuO


