Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Коррозия с кислородной деполяризацией
Электрохимическая коррозия - разрушение материала вследствие взаимодействия с раствором электролита, при котором окислительный и восстановительный процессы протекают не в одном акте, и сопровождается протеканием электрического тока. Электролитами являются проводники второго рода, электропроводность которых обусловлена движением в растворе положительно заряженных катионов и отрицательно заряженных анионов. Распад электролита на ионы при растворении его в воде называется диссоциацией. Диссоциация протекает только в растворителях молекулы, Схема образования которых полярные, например, в воде. Вода - это наиболее полярная жидкость. Молекулы воды являются диполями и электростатически взаимодействуют с ионами растворенного вещества, образуя гидратированные катионы и анионы, схематично представленные на (Рис.1). Это явление получило название гидратации.
Рис. 1. Схема образования гидратированных катионов и анионов Процесс гидратации сопровождается освобождением определённого количества энергии - энергии гидратации. Гидратация ионов играет большую роль в процессе коррозии, так как выделившаяся энергия способствует отрыву атома от металлической поверхности и переходу его в раствор, в чем и заключается коррозия металлов. При погружении металла в раствор электролита начинается сложное взаимодействие его с компонентами раствора. Если энергия гидратации ионов больше энергии связи в кристаллической решётке металла, то ионы металла переходят в раствор, а на поверхности остаётся эквивалентное количество электронов.
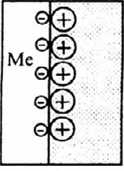
Поверхность металла приобретает отрицательный заряд и притягивает к себе положительно заряженные ионы раствора. В результате чего на границе металл - электролит образуется двойной электрический слой, схематично показанный на (Рис.2 а). Возможен и другой вариант формирования двойного электрического слоя, когда энергия гидратации меньше энергии связи в кристаллической решётке металла. В этом случае на поверхности металла будут разряжаться катионы раствора. Поверхность металла при этом приобретёт положительный заряд и притянет из раствора анионы, как показано
а) б)
Рис. 2. Схема образования двойного электрического слоя
В двойном электрическом слое возникает разность потенциалов, которая называется электродным потенциалом. Когда наступает равновесие, и процессы выхода ионов в раствор и возвращения на металл уравняются, то такой потенциал называют либо равновесным (если в растворе содержатся катионы только данного металла), либо неравновесным (если в растворе присутствуют катионы других металлов). Электрохимическая коррозия возникает вследствие работы множества короткозамкнутых гальванических элементов, образующихся из-за химической и структурной неоднородности сплава. Для примера возьмём углеродистую конструкционную сталь и поместим её в раствор кислоты. Так как энергия гидратации больше энергии связи в кристаллической решётке феррита, то с этих участков будут отрываться атомы железа и переходить в раствор в виде гидратированных ионов. При этом на поверхности останется эквивалентное количество электронов, которые зарядят поверхность феррита отрицательно. Этот процесс называется анодным процессом, а поверхность феррита - анодом. Так как в цементите энергия связи в кристаллической решётке больше энергии гидратации, то на нем произойдёт разряд катионов раствора. Цементит приобретёт положительный заряд. Избыточные электроны с ферритных участков будут переходить на цементитные, как показано на (Рис.3).
И здесь эти электроны будут захватываться, каким-либо деполяризатором, например, ионами водорода, т. е. наблюдается восстановление ионов водорода в молекулу. Этот процесс называется катодным. Наличие электронной проводимости у металла и ионной у раствора электролита позволяет анодным и катодным процессам протекать на различных участках поверхности металла. Между анодом и катодом протекает электрический ток, то есть образуется замкнутый гальванический элемент. Электрохимическая коррозия сопровождается протеканием двух явлений: поляризация и деполяризация. Р оль поляризации и деполяризации при коррозии металлов. Поляризация вызывается отставанием электродных процессов от процесса передвижения электронов в металле от анода к катоду. Если анодный процесс перехода ионов металла в раствор отстает от перетока электронов от анода к катоду, то это приводит к уменьшению отрицательного заряда на поверхности металла (анодная поляризация).
Анодная поляризация при коррозии металла может быть вызвана: · - перенапряжением ионизации металла, · - замедлением диффузии ионов металла от электрода в толщу раствора (концентрационная поляризация), · - пассивностью анода, т.е. особым состоянием металла, имеющим место при достижении определенного значения потенциала, называемого потенциалом пассивации, и связанного с образованием на поверхности анода защитных пленок. Пассивность в определенных условиях наблюдается у титана, алюминия, хрома, молибдена, магния, никеля, кобальта, железа и некоторых других металлов. Пассивность металлов зависит как от внутренних факторов (состав, структура, состояние поверхности), так и от внешних факторов (состав и концентрация электролита, температура, движение раствора, наложение внешнего тока и т.д.). Вещества, способствующие переходу металла в пассивное состояние, называются пассиваторами. К пассиваторам относятся такие окислители, как HNO3, NaNO2, K2CrO7, O2 и др. Пассивное состояние может сохраняться и после изменения внешних условий, вызвавших пассивацию. Депассивирующими факторами при коррозии металлов, нарушающими пассивное состояние металла, являются: действие некоторых восстановителей, например H2, Na2SO3 и др. некоторых ионов, например,
CI-, Br-, I-, а также повышение температуры и механическое удаление защитных слоев на пассивной поверхности металла. Катодная поляризация при коррозии металлов может быть вызвана: · - перенапряжением катодной реакции (присоединение электронов окислителем на катод происходит медленнее, чем образование электронов на аноде; электроны накапливаются у катода, сдвигая его потенциал в отрицательную сторону), · - замедленностью диффузии окислителя из объема электролита к катоду. Поляризация тормозит коррозионные процессы, и если бы этот процесс не имел бы места в реальных условиях, многие металлы потеряли бы свое техническое значение. Любые процессы, уменьшающие явление поляризации, называются процессами деполяризации, а вещества ее вызывающие- деполяризаторами. Деполяризация ускоряет коррозионные процессы.
Рис. 3 – Схема электрохимической коррозии стали в растворе кислоты
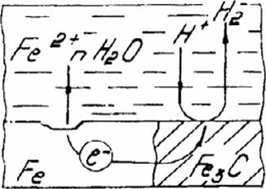
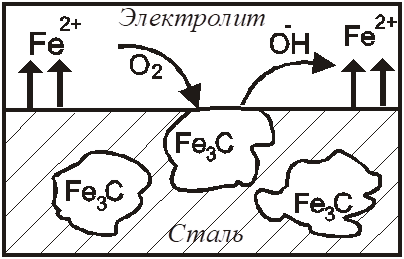
Равновесные потенциалы определяются при отсутствии тока в цепи. При прохождении электрического тока потенциалы изменяются. Изменение начальных потенциалов после замыкания цепи, приводящее к уменьшению коррозионного тока и, следовательно, скорости коррозии, называется поляризацией. Различают анодную и катодную поляризации. Анодная поляризация - смещение потенциала анодного участка в положительную сторону при протекании тока. Основной причиной анодной поляризации является анодная пассивность, т. е. образование на поверхности металла нерастворимой окисной плёнки, которая защищает металл от контакта с агрессивной средой. На анодных участках (железо) (Рис.4) происходит процесс окисления,
при этом железо переходит в виде ионов в раствор:
На катодных участках (Fe3C) - восстановление деполяризатора - растворенного кислорода:
Так протекает реакция ионизации кислорода в нейтральных или щелочных средах. В кислых средах кислородная деполяризация протекает по уравнению:
При коррозии имеют место вторичные процессы, при которых ионы железа с ионами гидроксила образуют гидроксид железа (П), который далее окисляется кислородом до гидроксида железа:
Частично теряя воду, этот гидроксид образует ржавчину переменного состава:
Рис. 4 - Схема коррозии стали с кислородной деполяризацией в нейтральной среде Катодная поляризация - смещение потенциала катодного участка в отрицательную сторону при протекании электрического тока. Катодный процесс может тормозиться вследствие либо перенапряжения катодной реакции, (избыточные электроны не успевают восстанавливать катионы или молекулы в растворе), либо концентрационной поляризации (недостаточная скорость подвода деполяризатора к катодной поверхности). Под деполяризацией понимается уменьшение поляризации металла, а, следовательно, и ускорение коррозии. Все электрохимические процессы, противодействующие причинам анодной и катодной поляризации, можно назвать, соответственно анодной и катодной деполяризацией.
Наибольший практический интерес представляет коррозия с катодной деполяризацией с участием таких деполяризаторов как водород и кислород. Водородная деполяризация термодинамически возможна в тех случаях, когда равновесный потенциал металла отрицательнее равновесного потенциала водородного электрода, измеренного в тех же условиях. Процесс разряда ионов водорода на катоде сложен и состоит из нескольких стадий: 1. Диффузия и миграция гидратированных ионов водорода к катоду. 2. Дегидратация ионов водорода. 3. Вхождение ионов водорода в состав двойного слоя. 4. Разряд ионов водорода с образованием адсорбированного атома водорода. 5. Рекомбинация адсорбированных атомов водорода в молекулу. 6. Образование и отрыв пузырьков из молекул водорода от поверхности катода. Самыми медленными являются 4-ая и 5-ая стадии. Они и лимитируют реакцию катодного процесса. Основными факторами, влияющими на скорость катодной реакции являются: природа металла, температура, концентрация ионов водорода в растворе. Кислородная деполяризация термодинамически возможна в тех случаях, когда равновесный потенциал металла отрицательнее равновесного потенциала кислородного электрода, измеренного в тех же условиях. Коррозионный процесс при кислородной деполяризации включает следующие реакции:
1. Анодный процесс (окисление металла) Me + mH2O → Men+ + mH2O + n • e (1) 2. Катодный процесс (восстановление кислорода) в нейтральных и щелочных средах протекает по реакции: O2 + 2H2O + 4e → 4OH− (2) в кислых средах по реакции: O2 + 4H+ + 4e → 2H2O. (3)
Скорость электрохимической коррозии в большинстве случаев определяется: 1. Торможением электрохимических стадий электродных реакций. 2. Транспортными затруднениями, связанными с ограниченным подводом кислорода к поверхности катода или отводом продуктов реакции.
Кислородная деполяризация протекает в две стадии: 1. Транспортировка кислорода к катоду. 2. Электрохимический процесс ионизации кислорода в прикатодном слое.
На скорость коррозии с кислородной деполяризацией влияют такие факторы как структура металла, температура, pH раствора, концентрация растворенного кислорода, скорость движения раствора. Скорость коррозии с кислородной деполяризацией при замедленной диффузии кислорода определяется уравнением
где Jдиф - скорость восстановления кислорода; D О2 - коэффициент диффузии кислорода; δ - толщина диффузионного слоя;
C O2 - концентрация кислорода у поверхности катода; n - число электронов, участвующих в реакции восстановления кислорода; F - число Фарадея; S - площадь катода. С увеличением Jдиф значение C O2 уменьшается и при C O2 < Повлиять на скорость электрохимического процесса легче всего путём изменения условий, определяющих скорость замедленной стадии. В частности, при замедленной диффузии кислорода скорость коррозии можно увеличить за счёт уменьшения толщины диффузионного слоя (путём перемешивания раствора), за счёт увеличения концентрации растворенного кислорода, за счёт увеличения площади катодных участков. Если измерить силу коррозионного тока, то по закону Фарадея можно определить весовые потери металла по формуле:
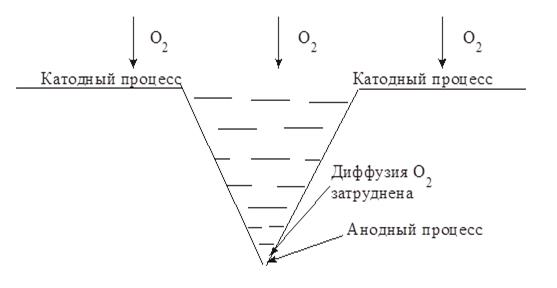
где Δ m - масса металла, г; М- молекулярная масса металла; F - число Фарадея (96 500 Кл/моль); n - валентность металла; J · τ - количество электричества (находится по площади графической зависимости, построенной в координатах сила тока (ма) - время испытания (мин). При коррозии в реальных условиях диффузия кислорода к отдельным участкам поверхности корродирующего металла может быть неодинаковой (неравномерная аэрация). В связи с этим коррозия с кислородной деполяризацией часто происходит локально, возникают так называемые аэрационные пары, при работе которых металл разрушается в местах, где диффузия затруднена, а катодный процесс коррозии осуществляется на участках с хорошей аэрацией.
Работой аэрационной пары объясняется, например, щелевая коррозия (Рис. 5.) и неравномерная коррозия подземных трубопроводов на различных участках.
Рис. 5.. Возникновение аэрационной пары при наличии щелей и трещин в корродирующем металле
Диффузия кислорода к острию щели затруднена, т.к. путь движения молекул кислорода к острию трещины длиннее, чем к ее основанию. Поэтому на ее вершине локализуется анодный процесс, катодный процесс коррозии будет протекать на поверхности металла вблизи трещины и на стенках трещины. Таким образом, при наличии щели коррозионное поражение интенсивно распространяется вглубь металла (щелевая коррозия).
|
|||||||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 693; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.128.78.30 (0.046 с.) |


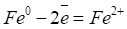

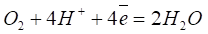
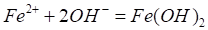
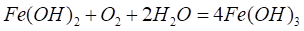
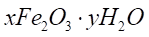
 , (4)
, (4) - концентрация кислорода в растворе;
- концентрация кислорода в растворе; г, (5)
г, (5)