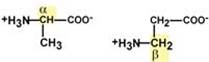Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Аминокислоты. Строение, классификация, свойства, применение как лекарственных препаратов.Стр 1 из 12Следующая ⇒
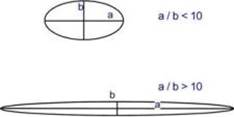
История развития представлений о структуре белков. Принципы классификации белков. Сходства и отличия белков и пептидов. (историю опускаю сознательно, но я бы назвал дату выделения первого белка, упомянул модель Поллинга и еще что-нибудь) Классификация по функции В соответствии с биологическими функциями выделяют: - структурные белки (коллаген, кератин), - ферментативные (пепсин, амилаза), - транспортные (трансферрин, альбумин, гемоглобин), - резервно-пищевые (белки яиц и злаков), - сократительные и двигательные (актин, миозин, тубулин), - защитные (иммуноглобулины, тромбин, фибриноген), - регуляторные (соматотропный гормон, адренокортикотропный гормон, инсулин). Классификация по строению Сравнение формы глобул и фибрилл зависимости от формы молекулы выделяют глобулярные и фибриллярные белки. В глобулярных белках соотношение продольной и поперечной осей составляет менее 10 и в большинстве случаев не более 3-4. Эти белки характеризуются компактной трехмерной укладкой полипептидных цепей. Например: инсулин, альбумин, глобулины плазмы крови. Фибриллярные белки имеют соотношение осей более 10. Они состоят из пучков полипептидных цепей, спиралью навитых друг на друга и связанные между собой поперечными ковалентными и водородными связями. Выполняют защитную и структурную функции. Например: кератин, миозин, коллаген.
По количеству белковых цепей в одной молекуле выделяют мономерные белки, которые имеют одну субъединицу (протомер) и полимерные белки, имеющие несколько субъединиц. Например, к мономерным белкам относятся альбумины, миоглобин, к полимерным - гемоглобин (4 субъединицы), ферменты лактатдегидрогеназа и креатинкиназа (4 и 2 субъединицы, соответственно), гексокиназа (2 субъединицы). Субъединицы в белке могут быть как одинакового, так и различного строения. По химическому составу все белки подразделяют на простые и сложные. Простые белки содержат в структуре только аминокислоты (альбумины, глобулины, гистоны, протамины). Сложные белки, кроме аминокислот, имеют небелковые компоненты: - нуклеопротеины, - фосфопротеины, - металлопротеины, - липопротеины, - хромопротеины, - гликопротеины. Основное различие между Пептидом и Белком состоит в том, что Пептид представляет собой короткую последовательность аминокислот с первичной структурой, тогда как Белок представляет собой полипептид, с гораздо большей структурой, имеющей различные уровни организации, такими как вторичная, третичная и четвертичная структура. Кроме того, пептидные связи возникают между аминокислотами в полипептидной цепи, в то время как различные полипептидные цепи белка связаны водородными связями и дисульфидными мостиками.
--- Физико-химические свойства белков. Растворимость белков в воде. Факторы устойчивости белковых растворов. Общие реакции на белки: цветные и осаждения. Использование этих реакций в медицинской практике. К физико-химическим свойствам белков относят амфотерность, растворимость, способность к денатурации, коллоидные свойства. Амфотерность Так как белки содержат кислые и основные аминокислоты, то в их составе всегда имеются свободные кислые (СОО–) и основные (NH3+) группы. Заряд белка зависит от соотношения количества кислых и основных аминокислот. Поэтому, аналогично аминокислотам, белки заряжаются положительно при уменьшении рН, и отрицательно при его увеличении. Если рН раствора соответствует изоэлектрической точке белка, то заряд белка равен 0. Если в пептиде или белке преобладают основные аминокислоты (лизин и аргинин), то при нейтральных рН заряд белка положительный, т.к. обусловлен положительным зарядом радикала этих аминокислот. Если в белке преобладают кислые аминокислоты (глутамат и аспартат), то белок кислый, при нейтральных рН заряд белка отрицательный и изоэлектрическая точка находится в кислой среде. Для большинства природных белков изоэлектрическая точка находится в диапазоне рН 4,8-5,4, что свидетельствует о преобладании в их составе глутаминовой и аспарагиновой аминокислот. Растворимость Так как большинство белков несет много заряженных групп, то в целом они водорастворимы. Растворимость объясняется: - наличием заряда и взаимоотталкиванием заряженных молекул белка, - наличием гидратной оболочки – окружение молекулы диполями воды и взаимодействие их с полярными и заряженными группами на поверхности глобулы белка. Чем больше полярных и/или заряженных аминокислот в белке, тем больше гидратная оболочка.
Устойчивость белковым растворам придают два фактора: заряд белковой молекулы и гидратная оболочка. Заряд белковой молекулы. Появление заряда на молекулах белков связано с его амфотерными свойствами (наличием кислотных и основных свойств). Группы, способные приобретать заряды, называются ионогенными. К ним относятся - СООН группы глютамата, аспартата, -NH2 группы лизина, аргинина, азот имидазольного кольца гистидина. В очень незначительной степени ионизируются -SH группы цистеина и -OH группы тирозина. Ионизация различных функциональных групп белка групп определяется рН среды. Формирование гидратной (водной) оболочки Белки обычно имеют такую пространственную укладку, при которой гидрофобные группы «прячутся» в глубине белковой молекулы, а гидрофильные находятся на поверхности молекулы. К гидрофильным группам относятся - СООН, -NH2, -SH, -ОН, пептидная связь, карбонильная группа. К гидрофильным группам притягиваются диполи Н2О, в результате чего вокруг белковой молекулы формируется защитная водная «шуба», которая препятствует склеиванию белковых молекул и осаждению их из растворов. Вода, входящая в состав гидратных оболочек, называется связанной водой. Она отличается по физическим свойствам и определяет биологическую активность биополимеров. Колориметрические методы определения, основанные на цветных реакциях белков: - методы, основанные на неспецифическом связывании красителя (простой абсорбции), достаточно чувствительны, но степень связывания красителя зависит от индивидуальных свойств белка (метод с кумасси бриллиантовым голубым). - биуретовый метод — наиболее широко применяется в настоящее время, основан на специфической реакции пептидной связи с ионами меди в щелочной среде с образованием продукта фиолетового цвета. Существуют разные модификации этого метода с целью увеличения интенсивности окраски и ее стабильности, повышения устойчивости реактива. Например, тартрат добавляют как стабилизатор, который при комплексировании с ионами меди предотвращает их осаждение в щелочной среде, KJ предотвращает спонтанное восстановление щелочного тартрата меди и осаждение оксида меди и, следовательно, повышает устойчивость реактива. Чувствительность и специфичность метода зависит от используемой длины волны: 540-580 нм, 263 нм или 310 нм. Метод считается самым специфичным и точным, так как присутствие ароматических аминокислот, фенолов, мочевой кислоты не влияет на биуретовую реакцию. - метод Лоури — основан на образовании вольфрамового синего и молибденового синего из фосфорномолибденовой и фосфорновольфрамовой солей реактива Фолина-Чикольте при взаимодействии их с ароматическими аминокислотами, в основном остатками тирозина, но определенный вклад дают триптофан, гистидин, цистеин. Максимум поглощения находится в диапазоне 745-750 нм. В составе рабочего реактива имеется биуретовый реактив, что позволяет определять также пептидные связи. К недостатку метода относится: во-первых, отрицательное влияние на развитие окраски веществ, используемых для выделения, очистки и солюбилизации белков (детергентов, компонентов буферных систем, сульфгидрильных и других восстанавливающих агентов, пуринов, глицина, сахарозы, сернокислого аммония и др); во-вторых, отсутствие линейной зависимости интенсивности окраски от количества белка-стандарта. Метод более чувствителен по сравнению с биуретовым, но специфичность его ниже, так как интенсивность окраски зависит от аминокислотного состава белка, а также от последовательности расположения аминокислот и степени экранирования функциональных групп.
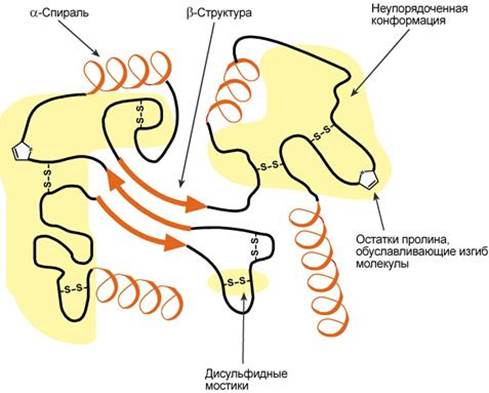
--- Третичная структура белка. Силы, стабилизирующие третичную структуру. Конформационные изменения при функционировании белков. Денатурация белка и факторы, ее вызывающие. Использование явления денатурации в медицинской практике. Третичная структура – это укладка полипептидной цепи в глобулу ("клубок"). Четкой границы между вторичной и третичной структурами провести нельзя, однако в основе третичной структуры лежат стерические взаимосвязи между аминокислотами, отстоящими далеко друг от друга в цепи. Благодаря третичной структуре происходит еще более компактное формирование цепи.
Аминокислоты принимают участие в формировании третичной структуры, образуя связи своими функциональными группами (радикалами), например: - водородные – между НО-, СООН-, NH2-группами радикалов аминокислот, - дисульфидные – между остатками цистеина, - гидрофобные – между остатками алифатических и ароматических аминокислот, - ионные – между СОО–-группами глутамата и аспартата и NH3+-группами лизина и аргинина, - псевдопептидные – между дополнительными СОО–-группами глутамата и аспартата и дополнительными NH3+-группами лизина и аргинина.
Гидрофобные взаимодействия, а также ионные и водородные связи относят к числу слабых, так как их энергия лишь ненамного превышает энергию теплового движения атомов при комнатной температуре (т.е. уже при данной температуре возможен разрыв таких связей). Поддержание характерной для белка конфор-мации возможно благодаря возникновению множества слабых связей между различными участками полипептидной цепи. Однако белки состоят из огромного числа атомов, находящихся в постоянном (броуновском) движении, что приводит к небольшим перемещениям отдельных участков полипептидной цепи, которые обычно не нарушают общую структуру белка и его функции. Следовательно, белки обладают конформационной лабильностью - склонностью к небольшим изменениям конформации за счёт разрыва одних и образования других слабых связей. Конформация белка может меняться при изменении химических и физических свойств среды, а также при взаимодействии белка с другими молекулами. При этом происходит изменение пространственной структуры не только участка, контактирующего с другой молекулой, но и конформации белка в целом.
Денатурация – необратимое осаждение белка из-за разрыва связей, стабилизирующих четвертичную, третичную, вторичную структуры белка, сопровождаемое изменением растворимости, вязкости, химической активности, снижением или полной потерей биологической функции. 1. Физическая денатурация Вызывается повышением температуры, ультрафиолетовым и микроволновым излучением, механическими воздействиями, ионизацией заряженными частицами. 2. Химическая денатурация Зависит от природы денатурирующего реагента: - кислоты и щелочи образуют водородные связи с пептидными группами, - органические растворители образуют водородные связи и вызывают дегидратацию, - алкалоиды образуют связи с полярными группами и разрывают систему водородных и ионных связей, - тяжелые металлы взаимодействуют с заряженными радикалами, нейтрализуют отрицательные заряды и разрывают систему водородных и ионных связей. --- 9. Четвертичная структура белков. Преимущества существования белков с четвертичной структурой. Кооперативные изменения конформации полипептидных цепей при функционировании белков с четвертичной структурой на примере гемоглобина. Сравнительные особенности транспорта кислорода гемоглобином и миоглобином. Если белки состоят из двух и более полипептидных цепей, связанных между собой нековалентными (не пептидными и не дисульфидными) связями, то говорят, что они обладают четвертичной структурой. Например, гемоглобин – белок эритроцитов, переносящий кислород, состоит из 4 гемсодержащих субъединиц – 2 α-субъединицы и 2 β-субъединицы в гемоглобине взрослых, 2 α-субъединицы и 2 γ-субъединицы в фетальном гемоглобине. Лактатдегидрогеназа – фермент, принимающий активное участие в окислении глюкозы в бескислородных условиях, также включает 4 субъединицы – Н (heart) и М (muscle) в разных сочетаниях: Н4, Н3М1, Н2М2, Н1М3, М4. Всего 5 изоферментов. Креатинкиназа – фермент, участвующий в регенерации АТФ при мышечном сокращении, состоит из 2 субъединиц – В (brain) и М (muscle) в разных сочетаниях: ВВ, ВМ, ММ. Всего 3 изофермента. Взаимодействие протомеров друг с другом осуществляется по принципу комплементарности, т.е. их поверхность подходит друг другу по геометрической форме и по функциональным группам аминокислот (возникновение ионных и водородных связей). Так как субъединицы в олигомерах очень тесно взаимодействуют между собой, то любое изменение конформации какой-либо одной субъединицы обязательно влечет за собой изменение других субъединиц. Этот эффект называется кооперативное взаимодействие.
Например, в легких у гемоглобина кооперативное взаимодействие субъединиц в 300 раз ускоряет присоединение кислорода к гемоглобину. В тканях отдача кислорода также ускоряется в 300 раз.
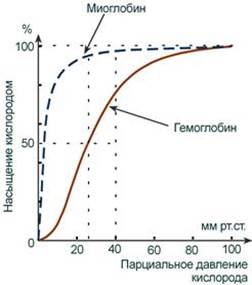
Присоединение в легких первой молекулы кислорода к одной из субъединиц гемоглобина изменяет ее конформацию. В результате она начинает влиять на следующую субъединицу, облегчая присоединение к ней кислорода. После этого они вдвоем влияют на третью субъединицу и так далее. В тканях первая молекула кислорода отделяется от своей субъединицы не очень легко, вторая уже быстрее и так далее. Миоглобин является одиночной полипептидной цепью, состоит из 153 аминокислот с молекулярной массой 17 кДа и по структуре сходен с β-цепью гемоглобина. Белок локализован в мышечной ткани. Миоглобин обладает более высоким сродством к кислороду по сравнению с гемоглобином. Это свойство обусловливает функцию миоглобина – депонирование кислорода в мышечной клетке и использование его только при значительном уменьшении парциального давления О2 в мышце (до 1-2 мм рт.ст).
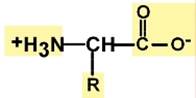
Кривые насыщения кислородом показывают отличия миоглобина и гемоглобина: - одно и то же 50%-е насыщение достигается при совершенно разных концентрациях кислорода – около 26 мм рт.ст. для гемоглобина и 5 мм рт.ст. для миоглобина, - при физиологическом парциальном давлении кислорода от 26 до 40 мм рт.ст. (в тканях) гемоглобин насыщен на 50-80%, тогда как миоглобин – почти на 100%. Таким образом, миоглобин остается оксигенированным до того момента, пока количество кислорода в клетке не снизится до предельно малых величин. Только после этого начинается отдача кислорода для реакций метаболизма. --- Витамеры Иногда витамин представлен различными химическими формами – витамерами (витамин + греч. meros – часть), т.е. соединениями с витаминной функцией, сходными по структуре. Например: - витамин E представлен группой витамеров – α-, β- и γ-токоферолами, - витамин К – менахинонами и филлохинонами, - витамин D может быть в виде эргокальциферола и холекальциферола, - витамин F включает схожие полиненасыщенные жирные кислоты. Провитамины Некоторые витамины поступают в организм в виде провитаминов. В организме провитамины превращаются в активные формы, например: - каротиноиды, в частности β-каротин, превращаются в витамин А, - пищевой эргостерол или 7-дегидрохолестерол под действием ультрафиолетовых лучей превращаются соответственно в эргокальциферол (витамин D2) и холекальциферол (витамин D3). Антивитамины Соединения, препятствующие проявлению эффектов витамина тем или иным образом, получили название антивитамины. Их подразделяют на две основные группы: - Вещества, которые инактивируют витамин путем его расщепления, разрушения или связывания его молекул в неактивные формы. Примером служит яичный белок авидин или фермент тиаминаза. - Вещества, похожие по структуре на тот или иной витамин. Эти вещества конкурентно вытесняют витамины из ферментов, препятствуют образованию их коферментных форм или участию в реакциях. Примером являются антибактериальные препараты группы сульфаниламидов (антифолаты), дикумарол (антивитамин К), изониазид (антивитамин РР). Свойства витаминов Независимо от своих свойств витамины характеризуются следующими общебиологическими свойствами: 1. В организме витамины не образуются, их биосинтез осуществляется вне организма человека, т.е. витамины должны поступать с пищей. Тех витаминов, которые синтезируются кишечной микрофлорой обычно недостаточно для покрытия потребностей организма (строго говоря, это тоже внешняя среда). Исключением является витамин РР, который может синтезироваться из триптофана, и витамин D (холекальциферол), синтезируемый из холестерола. 2. Витамины не являются пластическим материалом. Исключение – витамин F. 3. Витамины не служат источником энергии. Исключение – витамин F. 4. Витамины необходимы для всех жизненных процессов и биологически активны уже в малых количествах. 5. При поступлении в организм они оказывают влияние на биохимические процессы, протекающие в любых тканях и органах, т.е. они неспецифичны по органам. 6. В повышенных дозах могут использоваться в лечебных целях в качестве неспецифических средств: при сахарном диабете – B1, B2, B6, при простудных и инфекционных заболеваниях – витамин С, при бронхиальной астме – витамин РР, при язвах ЖКТ – витаминоподобное вещество U и никотиновая кислота, при гиперхолестеринемии – никотиновая кислота. --- Витамин B4 (холин) Биохимические и другие функции Холин играет роль в нормальном функционировании нервной системы и других клеток: - компонент фосфатидилхолина - основного фосфолипида мембран клеток, - участвует в образовании защитной миелиновой оболочки нервов, - предшественник нейромедиатора ацетилхолина. Аминокислоты. Строение, классификация, свойства, применение как лекарственных препаратов. Аминокислоты – это строительные блоки макромолекул белков. По строению они являются органическими карбоновыми кислотами, у которых, как минимум, один атом водорода замещен на аминогруппу. Таким образом, в аминокислотах обязательно присутствует карбоксильная группа (СООН), аминогруппа (NH2), асимметричный атом углерода и боковая цепь (радикал R). Строением боковой цепи аминокислоты и отличаются друг от друга. Именно радикал придает аминокислотам большое разнообразие строения и свойств.
По строению бокового радикала... ...Выделяют: - алифатические (аланин, валин, лейцин, изолейцин, пролин, глицин), - ароматические (фенилаланин, тирозин, триптофан), - серусодержащие (цистеин, метионин), - содержащие ОН-группу (серин, треонин, опять тирозин), - содержащие дополнительную СООН-группу (аспарагиновая и глутаминовая кислоты), - дополнительную NH2-группу (лизин, аргинин, гистидин, также глутамин, аспарагин).
По полярности бокового радикала Существуют неполярные аминокислоты (ароматические, алифатические) и полярные (незаряженные, отрицательно и положительно заряженные). По кислотно-основным свойствам По кислотно-основным свойствам подразделяют нейтральные (большинство), кислые (аспарагиновая и глутаминовая кислоты) и основные (лизин, аргинин, гистидин) аминокислоты. По незаменимости По необходимости для организма выделяют такие, которые не синтезируются в организме и должны поступать с пищей – незаменимые аминокислоты (лейцин, изолейцин, валин, фенилаланин, триптофан, треонин, лизин, метионин). К заменимым относят такие аминокислоты, углеродный скелет которых образуется в реакциях метаболизма и способен каким-либо образом получить аминогруппу с образованием сответствующей аминокислоты. Две аминокислоты являются условно незаменимыми (аргинин, гистидин), т.е. их синтез происходит в недостаточном количестве, особенно это касается детей. Остальные свойства В зависимости от положения аминогруппы относительно 2-го атома углерода выделяют α-, β-, γ- и другие аминокислоты.
Амфотерность Понятие амфотерность означает, что вещество сочетает в себе свойства как кислот, так и оснований. В водном растворе аминокислоты одновременно ведут себя как кислоты – доноры протонов и как основания – акцепторы протонов. Данное свойство аминокислот напрямую связано со амфотерными свойствами белков, благодаря которому они участвуют в регуляции кислотно-основного состояния крови.
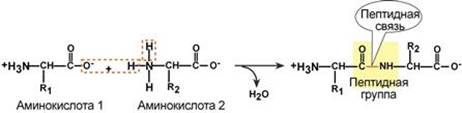
Если общий заряд аминокислоты равен 0, то это ее состояние называют изоэлектрическим. Величина рН, при которой заряд аминокислоты равен 0, называется изоэлектрической точкой (ИЭТ, pI). Значение изоэлектрической точки зависит от строения радикала аминокислоты: ИЭТ большинства аминокислот располагается в диапазоне рН от 5,5 (фенилаланин) до 6,3 (пролин), ИЭТ кислых аминокислот - для глутамата 3,2, для аспартата 2,8, ИЭТ основных аминокислот - для гистидина 7,6, для аргинина 10,8, для лизина 9,7. Пептидная связь Аминокислоты способны соединяться между собой связями, которые называются пептидными, при этом образуется полимерная молекула. Если количество аминокислот не превышает 10, то новое соединение называется пептид; если от 10 до 40 аминокислот – полипептид, если более 40 аминокислот – белок. Пептидная связь – это связь между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой аминокислоты.
---
|
|||||||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 134; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.181.81 (0.059 с.) |