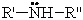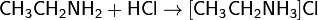Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Разде л 4 Химия и организм человекаСтр 1 из 7Следующая ⇒
Разде л 4 Химия и организм человека Тема 4.1 Химические элементы в организме человека. Основные понятия и термины по теме Макроэлементы. Микроэлементы. Ультрамикроэлементы. План изучения темы 1. Химические элементы в организме человека. 2. Проблемы безопасного использования веществ и химических реакций в повседневной жизни. 3. Моющие и чистящие средства. Средства личной гигиены и косметики. 4. Химия и пища. Краткое изложение теоретических вопросов: Химические элементы в организме человека. Для организма человека определенно установлена роль около 30 химических элементов, без которых он не может нормально существовать. Эти элементы называют жизненно необходимыми. Кроме них, имеются элементы, которые в малых количествах не сказываются на функционировании организма, но при определенном содержании являются ядами. Тело человека состоит в среднем на 60% из воды, на 34% из органических веществ, на 6% — из неорганических (для разного возраста приводимые отношения меняются). Основными химическими элементами, формирующими органические вещества, являются углерод, водород и кислород, помимо этого, в состав органических веществ входят азот, фосфор и сера. В состав неорганических веществ тела человека входят 22 обязательных химических элемента — кальций, фосфор, кислород, натрий, магний, сера, бор, хлор, калий, ванадий, марганец, железо, кобальт, никель, медь, цинк, молибден, хром, кремний, йод, фтор, селен. Данные химические элементы разделяют на макроэлементы (массовая доля элемента в организме превышает 10-2%), микроэлементы (10-3—10-5%) и ультрамикроэлементы (ниже 10-5%).
Проблемы безопасного использования веществ и химических реакций в повседневной жизни. Пищевые добавки, которые не рекомендуется употреблять: E131, E141, E215 – E218, E230-E232, E239 являются аллергенами. E121, E123 способны вызвать желудочно-кишечные расстройства, а в больших дозах – и пищевые отравления. E211, E40, E330, E442 содержат канцерогены, то есть могут провоцировать образование опухолей Качество игрушек: как не ошибиться? МЕЛКИЕ ДЕТАЛИ. Пуговицы мягкой игрушки должны быть надежно пришиты. Пуговицы с плохо обработанными краями также опасны - о них ребёнок может порезаться.
Перед покупкой косметики убедитесь, что в её составе нет ниже перечисленных опасных веществ: Толуол. Токсичный продукт. Применяется в лаках для ногтей Формальдегид. Канцероген Борная кислота. Бор является клеточным ядом, поражает желудочно-кишечный тракт, кожу, почки, центральную нервную систему Чистящие средства, - мы все к ним привыкли, они значительно облегчают нашу жизнь. Зашли в магазин и купили, - все полки заставлены, есть для любого случая – для стирки одежды, для мытья посуды, пола, сантехники. Конечно, сложно разобраться в химических терминах. Но от правильного выбора зависит наше здоровье и самочувствие. Учимся читать составы - выбираем стиральный порошок: Чего следует избегать: Анионных ПАВиз нефтехимического сырья! (не более 2-5%)! Еще они обозначаются А-ПАВ.Это самые агрессивные из поверхностно-активных веществ. ПАВ способны накапливаться в органах. Они вызывают нарушения иммунитета, аллергию, поражение мозга, печени, почек, легких, разрушают живые клетки. Косвенно можно судить о наличии А-ПАВ в стиральном порошке по интенсивности пенообразования при стирке. Чем выше пена, тем выше концентрация А-ПАВ. Кроме того ПАВ, полученные из нефтехимических источников, часто очень токсичны для водной среды и полностью не разлагаются.
Экологичная альтернатива: Хотя все ПАВ являются химически синтезированными, но в случае получения ПАВ из растительного сырья, они не оказывают агрессивного действия на организм человека и элементы окружающей среды. Отличительным показателем экологического стирального порошка является то, что в его составе присутствуют только биологически разлагаемые ПАВ или экосурфактанты, полученные на основе взаимодействия глюкозы, получаемой из риса, картофеля или пшеницы, и жирных спиртов выделенных из рапсового, кокосового или пальмового масла.
Нередко для создания экосурфактантов используют микроорганизмы: бактерии, дрожжи, грибы или компоненты мембран, присутствие которых способствует быстрому разложению ПАВ в природной среде. Фосфаты способствуют накоплению ПАВ на волокнах тканей и усиливают проникновение этих веществ через кожу, что приводит к усиленному обезжириванию кожных покровов и нарушению свойств крови. Даже 10-кратное полоскание в горячей воде полностью не освобождает от химикатов. Сильнее всего удерживают эти вещества шерстяные и хлопковые ткани (детские!). Небезопасные концентрации ПАВ сохраняются до четырех суток. Так создается очаг постоянной интоксикации внутри самого организма. Но этим не исчерпывается вредное действие фосфатов - они представляют собой большую угрозу для окружающей нас среды. Фосфаты попадают в водоемы, способствуют усиленному образованию сине-зеленых водорослей, которые приводят к отравлениям, не вынашиванию беременности, врожденным травмам, активизируют развитие раковых клеток. По данным исследований в российские реки, озера и моря попадает 300-400 тысяч тонн триполифосфата натрия в год. А всего 1 грамм триполифосфата натрия стимулирует образование 5-10 кг. водорослей! От экологической катастрофы Россию спасает то, что для роста и развития водорослей нужны свет и тепло. И все же, несмотря на холодные зимы, фосфаты накапливаются, водоросли растут. «Цветет» Волга, особенно в нижнем течении, цветут другие реки — и большие, и маленькие. На природу отрава из пачки стирального порошка действует медленно, но верно. Ведь водоросли, разлагаясь, выделяют в страшных количествах метан, аммиак, сероводород. Мы-то с вами выживем, а все, кто живет в воде? Практически во всех странах фосфаты запрещены, а у нас в России концентрация фосфатных добавок "запредельная" - до 50-60 %. Те же фирмы, которые в своих странах выпускают бесфосфатные порошки, в России, под теми же торговыми марками производят порошки с фосфатами. А уж производители отечественных порошков о вреде фосфатов и слушать не хотят т.к себестоимость бесфосфатного порошка вырастает процентов на 20. Экологичная альтернатива:Экологические стиральные порошки не содержат фосфатов, - во многих странах они просто запрещены специальными законами уже более 20 лет. Вместо фосфатов экологические производители используют натрия дисиликат, который служит для умягчения воды и повышает эффективность стирки. Этот минерал добывается естественным образом, и присутствует на планете в огромных количествах (75 % внешней земной коры состоит из силикатов). Именно поэтому экологическое производство не приводит к истощению и повреждению экосистемы. Производство и реализация стеклоомывающих жидкостей, содержащих метанол (метиловый спирт), запрещены. Но метанол гораздо дешевле аналогов, и, несмотря на все запреты и постановления, омывающие жидкости с этим соединением можно обнаружить в продаже. Допустимая разовая концентрация метанола в воздухе - 1,0 мг/м куб. Специалисты установили, что, если использовать жидкость в стоящей машине, предельно допустимая концентрация метанола в салоне превышается в 3,7 раза!
Как же обезопасить себя от вредных воздействий? Для начала - исключить слишком активное использование бытовой химии из своего «рациона», а затем тщательно разобраться с оставшимся прожиточным минимумом химикалий. К числу безопасных альтернатив токсичным бытовым товарам относятся, например, мыло, уксус, сода, нашатырь. Если же для вас такие методы неприемлемы, стоит обратить внимание на наиболее прогрессивные - и потому наименее опасные - продукты бытовой химии. Я могу дать несколько советов: • избегайте чрезмерного использования бытовой химии, содержащей хлор, аммиак, фенол, формальдегид, ацетон и т.д.; • пользуйтесь наиболее щадящими средствами (например, с пометкой "для чувствительной кожи"); • обязательно обращайте внимание на то, что написано на этикетке и в инструкции, прилагающейся к очищающим средствам; • храните средства бытовой химии в хорошо закрытых емкостях и в помещении, где обитатели дома бывают реже всего; • старайтесь применять не порошки, а гели, жидкие или гранулированные средства; • избегайте прямого контакта с агрессивными веществами: используйте хозяйственные перчатки и защитные кремы; • систематически меняйте арсенал средств бытовой химии; • ограничьте себя и своих домочадцев в использовании бытовой химии и косметических средств в аэрозольных баллончиках под давлением; • тщательно ополаскивайте или смывайте средства бытовой химии, чтобы не контактировать с оставшимися на предметах активными веществами; • чаще проветривайте помещение Химия и пища. Пища - это источник энергии. Человек не может жить без пищи. Поэтому вопросы питания всегда актуальны. Пища бывает разная: полезная и та, что может негативно сказываться на нашем здоровье. Правильное питание играет всегда положительную роль в работе нашего организма. Наша пища состоит из очень большого числа различных веществ: белков, жиров, углеводов, витаминов, минеральных веществ и др. Среди них есть такие, которые определяют энергетическую и биоло гическую ценность, участвуют в формировании структуры, вкуса, цвета и аромата пищевых продуктов. Необходимо знать важнейшие компоненты продуктов питания, чтобы представить те сложные прев ращения, которые происходят при получении пищи. Это поможет более правильно оценить качество потребляемых продуктов, осмыслен нее подходить к своему питанию, сохранить свое здоровье.Безопасность пищевых продуктов – отсутствие токсического, канцерогенного, мутагенного или любого другого неблагоприятного действии пищевых продуктов на организм человека при употреблении их в общепринятых количествах. Гарантируется установлением и соблюдением регламентируемого уровня содержания загрязнителей химического, биологического или природного происхождения.
Реакции образования коричневых продуктов.Потемнение пищевых продуктов может иметь место в реакциях окислительных или неокислительных процессов.окислительное или ферментативное потемнение – это реакция между фенольными веществами и кислородом, катализируется ферментами – пероксидазой, полифенолоксидазой – потемнение срезов яблок, бананов, груши, картофеля – не связано с углеводами.Неокислительное или неферментативное потемнение – в пищевых продуктах встречается очень часто. Связано с превращением углеводов – это явление карамелизации и меланоидинообразования. Самые вредные продукты. Жевательные конфеты, чипсы, газированные напитки, шоколадные батончики, колбасно-сосисочное разнообразие, майонез
Изучение состава продукции по этикетке и определение безопасности применения веществ. Вопросы для самоконтроля по теме: 1. Как правильно выбрать моющие и чистящие средства, средства личной гигиены и косметики? 2. Верны ли следующие суждения о правилах хранения витаминов и предназначении моющих средств? А. Хранение витаминов не требует строгого соблюдения указанных в инструкции правил. Б. Для удаления жирных пятен с поверхности посуды целесообразно использовать моющие средства, имеющие щелочную среду. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны. План изучения темы 1. Белки 2. Углеводы 3. Жиры 4. Витамины Краткое изложение теоретических вопросов: Белки Белки – это высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков аминокислот. Белки, или, как их еще называют, протеины (от греч. protos — первостепенный), являются наиболее сложными химическими соединениями, характеризующимися большой молекулярной массой. В состав всех известных белков входят углерод, водород, азот и кислород. В большинстве белков находят серу, а в некоторых белках — фосфор, железо, цинк и медь. Будучи макромолекулами, они представляют собой линейные полимеры, в которых мономерами являются аминокислоты, каждая из которых состоит из аминогруппы (-NH2), карбоксильной группы (-СООН), атома водорода и R-группы, присоединенной к атому углерода, который называют tt-углеродным атомом. Благодаря наличию аминогрупп и карбоксильных групп аминокислоты способны реагировать друг с другом и образовывать между собой ковалентные связи. В частности, аминокислоты соединяются одна с другой посредством соединения аминогруппы одной аминокислоты с карбоксильной группой другой аминокислоты. Возникающую между аминокислотами связь называют пептидной (амидной), а несколько соединений аминокислот называют пептидом. Т.к. первоначально образующийся дипептид содержит реакционноспособные аминогруппу и карбоксильную группы, то к нему способны присоединиться другие аминокислоты, образуя полипептид (белок). Обычно цепь из трех аминокислот называют трипептидом, а цепь из многих соединенных аминокислот называют полипептидной цепью. Следовательно, пептиды — это цепочки аминокислот. Белок может состоять из одной полипептидной цепи или нескольких. Например, миоглобин состоит из одной цепи, тогда как гемоглобин — из двух цепей одного типа и двух цепей другого типа.
КЛАССИФИКАЦИЯ БЕЛКОВ В соответствии с функциональным принципом различают 12 главных классов белков: 1) каталитически активные белки (ферменты); 2) белки-гормоны (хотя есть и стероидные гормоны); 3) белки-регуляторы активности генома; 4) защитные белки (антитела, белки свертывающей и антисвертывающей систем крови); 5) токсические белки; 6) транспортные белки; 7) мембранные белки; 8) сократительные белки; 9) рецепторные белки; 10) белки-ингибиторы ферментов; 11) белки вирусной оболочки; 12) белки с иными функциями. В зависимости от химического состава делят на простые и сложные белки. Простые белки построены из остатков аминокислот и при гидролизе распадаются соответственно только на свободные аминокислоты. Сложные белки – это двухкомпонентные белки, которые состоят из какого-либо простого белка и небелкового компонента, называемого простетической группой. При гидролизе сложных белков, помимо свободных аминокислот, освобождается небелковая часть или продукты ее распада. Простые белки в свою очередь делятся на основании некоторых условно выбранных критериев на ряд подгрупп: протамины, гистоны, альбумины, глобулины, проламины, глютелины и др. Углеводы Углеводы – самые распространенные на Земле органические вещества. Они содержатся в клетках всех живых организмов. Название «углеводы» произошло потому, что первые известные вещества этого класса состояли как бы из углерода и воды. Общая их формула Сn(Н2O)m. У большинства углеводов число атомов водорода в 2 раза превышает количество атомов кислорода. Позднее были найдены углеводы, не отвечающие этой общей формуле, но название «углеводы» сохранилось.
В животных клетках углеводов немного: 1–2, иногда до 5% (например, в клетках печени). Растительные клетки, напротив, богаты углеводами – там их содержание достигает 90% сухой массы. Жиры Обычно жиры представляют собой смесь разных по составу триацилглицеролов, а так же сопутствующие вещества липидной природы. Жиры получаемые из растительного сырья называются растительными жирными маслами, они богаты ненасыщенными жирными кислотами. Жиры наземных животных содержат насыщенные жирные кислоты и называются животными жирами. Особую группу составляют жиры морских млекопитающих и рыб. Насыщенные жирные кислоты – пальмитиновая, стеариновая, миристиновая и др. используются в основном как энергетический материал. Они содержатся в наибольшем количестве в животных жирах, что определяет их высокую температуру плавления и твердое состояние. Повышенное содержание насыщенных жирных кислот в рационе нежелательно, т.к. при их избытке нарушается обмен липидов, повышается уровень холестерина в крови, увеличивается риск развития атеросклероза, ожирения, желчнокаменной болезни. Растительные жиры являются обязательным компонентом пищи, источником энергетического и пластического материала для организма. Они поставляют в организм человека ряд необходимых веществ: ненасыщенные жирные кислоты, фосфолипиды, жирорастворимые витамины (А – ретинол, Е – токоферол, Д – кальциферол, К – филлохинон), стерины (холестерин) – соединения, которые определяют биологическую эффективность и пищевую ценность продуктов. Витамины Витамины – низкомолекулярные органические соединения различной химической природы, не синтезируемые (или синтезируемые в недостаточном количестве) в организме людей и большинства животных, поступающие с пищей и необходимые для каталитической активности ферментов, определяющих биохимические и физиологические процессы в живом организме. Витамины относятся к незаменимым микрокомпонентам пищи. Выделяют также группу витаминоподобных веществ, которые относятся: холин, миоинозит, витамин U, липоевую кислоту, оротовую и пангамовую (витамин В15) кислоты, витамин F. Потребность человека в витаминах зависит от его возраста, состояния здоровья, характера деятельности, времени года, содержания в пище основных микрокомпонентов питания. Витамины подразделяются на водо- и жирорастворимые. Жирорастворимые витамины – А, Д, Е, К – способны накапливаться в жировой ткани организма, повышенный прием их в результате избыточного потребления отдельных продуктов или дополнительного приема препаратов витаминов может привести к появлению симптомов токсического действия. Водорастворимые витамины – группа В, Р, РР, С и др. – повышенный прием водорастворимых витаминов ведет только к выделению их излишков из организма – в организме они не накапливаются. Однако при большой передозировке и эти витамины могут быть опасны для организма. Так, например, избыток ниацина приводит к повреждению печени. Лабораторные работы– «не предусмотрено» Практическая работа Заслушивание и обсуждение сообщений «Жизнь это способ существования белковых тел…».Закрепление торетических вопросов Задания для самостоятельного выполнения 1. Подготовка сообщений «Жизнь это способ существования белковых тел…» Форма контроля самостоятельной работы: Заслушивание, обсуждение сообщений и анализ информации на практических занятиях. Вопросы для самоконтроля по теме: 1. Какие вещества называют белками? Какие белки вам известны? 2. Какие вещества называют жирами? 3. Какие вещества называют углеводами? 4. Какие вещества называют витаминами? Какие витамины вам известны? План изучения темы 1.Классификация углеводов и их свойства Краткое изложение теоретических вопросов: Углеводы, или сахариды, по особенностям строения делятся на три группы. 1. Моносахариды (монозы, или простые сахара) – состоят из одной молекулы и представляют собой твердые кристаллические вещества, бесцветные и хорошо растворимые в воде. Почти все они обладают приятным сладким вкусом. Углеводы всем нам хорошо известны в виде обычного пищевого сахара (химически он является сахарозой) или крахмала. Углеводы делятся на простые и сложные. Из простых углеводов (моносахариды) наибольшее значение для человека имеют глюкоза, фруктоза и галактоза. К сложным углеводам относятся олигосахариды (дисахариды: сахароза, лактоза и др.) и несахароподобные углеводы - полисахариды (крахмал, гликоген, клетчатка и др.). Моносахариды и полисахариды отличаются по своему физиологическому действию на организм. Использование в пищевом рационе избытка легкоусвояемых моно- и дисахаридов способствует быстрому увеличению уровня сахара в крови, что может иметь негативное значение для больных с сахарным диабетом (СД) и ожирением. Полисахариды значительно медленнее расщепляются в тонком кишечнике. Поэтому нарастание концентрации сахара в крови происходит постепенно. В связи с этим потребление продуктов, богатых крахмалом (хлеб, крупы, картофель, макароны), более полезно. Глюкоза C6H12O6 – наиболее важный из всех моносахаридов, так как она является структурной единицей большинства пищевых ди- и полисахаридов. В процессе обмена веществ они расщепляются на отдельные молекулы моносахаридов, которые в ходе многостадийных химических реакций превращаются в другие вещества и в конечном итоге окисляются до углекислого газа и воды – используются как «топливо» для клеток. Глюкоза – необходимый компонент обмена углеводов. При снижении ее уровня в крови или высокой концентрации и невозможности использования, как это происходит при диабете, наступает сонливость, может наступить потеря сознания (гипогликемическая кома). Она содержится в плодах и ягодах и необходима для снабжения энергией и образования в печени гликогена (запасной углевод человека и животных). Глюкоза является ценным питательным продуктом. В организме она подвергается сложным биохимическим превращениям, в результате которых образуется диоксид углерода и вода, при этом выделяется энергия согласно итоговому уравнению:
C6H12O6 + 6O2 → 6H2O + 6CO2 + 2800 кДж Так как глюкоза легко усваивается организмом, её используют в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке, она входит в состав кровозаменяющих и противошоковых жидкостей. Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.), в текстильной промышленности в качестве восстановителя, в качестве исходного продукта при производстве аскорбиновой кислоты, для синтеза ряда производных сахаров и т.д. Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению. Крахмал (С6Н10О5)n - природный полимер, он накапливается в виде зерен, главным образом в клетках семян, луковиц, клубней, а также в листьях и стеблях. Крахмал - белый порошок, нерастворимый в холодной воде. В горячей воде он набухает и образует клейстер.
Крахмал - основная часть важнейших продуктов питания: муки (75 - 80%), картофеля (25%), саго и др. Энергетическая ценность около 16,8 кДж/г. Он является ценным питательным продуктом. Чтобы облегчить его усвоение, содержащие крахмал продукты подвергают действию высокой температуры, то есть картофель варят, хлеб пекут. В этих условиях происходит частичный гидролиз крахмала и образуются декстрины, растворимые в воде. Декстрины в пищеварительном тракте подвергаются дальнейшему гидролизу до глюкозы, которая усваивается организмом. Избыток глюкозы превращается в гликоген (животный крахмал). Состав гликогена такой же, как у крахмала, - (C6H10O5)n, но его молекулы более разветвленные. Особенно много гликогена содержится в печени (до 10%). В организме гликоген является резервным веществом, которое превращается в глюкозу по мере ее расходования в клетках. (С6Н10О5)n + n H2O - H2SO4, t˚C → n C6H12O6 Образовавшийся осадок сульфата кальция отфильтровывают, раствор упаривают и выделяют глюкозу. Если гидролиз крахмала не доводить до конца, то образуется смесь декстринов с глюкозой - патока, которую применяют в кондитерской промышленности. Получаемые с помощью крахмала декстрины используются в качестве клея, для загустения красок при нанесении рисунков на ткань. Крахмал применяют для накрахмаливания белья. Под горячим утюгом происходит частичный гидролиз крахмала и превращение его в декстрины. Последние образуют на ткани плотную пленку, которая придает блеск ткани и предохраняет ее от загрязнения. Крахмал и его производные применяются при производстве бумаги, текстильных изделий, в литейном и других производствах, в фармацевтической промышленности. Целлюлоза или клетчатка (С6Н10О5)n, один из самых распространённых природных полимеров; главная составная часть клеточных стенок растений, обусловливающая механическую прочность и эластичность растительных тканей. Так, содержание целлюлозы в волосках семян хлопчатника 97—98%, в стеблях лубяных растений (лён, рами, джут) 75—90%, в древесине 40—50%, камыше, злаках, подсолнечнике 30—40%. Обнаружена в организме некоторых низших беспозвоночных. Целлюлоза используется человеком с очень древних времен. Сначала применяли древесину как горючий и строительный материал; затем хлопковые, льняные и другие волокна стали использовать как текстильное сырье. Первые промышленные способы химической переработки древесины возникли в связи с развитием бумажной промышленности. Клетчатка (целлюлоза) оказывает благоприятное регулирующее действие на работу кишечника, желчевыводящих путей, препятствует застою пищи в желудочно-кишечном тракте, способствует выведению холестерина. К продуктам, богатым клетчаткой, относятся капуста, свекла, фасоль, ржаная мука,и др. Олигосахариды (полисахариды первого порядка) составляют промежуточную группу между моносахаридами и высшими полисахаридами (полисахаридами второго порядка). Они содержат от 2 до 10 моносахаридных остатков. План изучения темы 1. Классификация азотсодержащих соединений. 2. Амины 3. Аминокислоты 4. Белки. Краткое изложение теоретических вопросов: Азотсодержащие органические соединения — один из важнейших типов органических соединений. В их состав входит азот. Они содержат в молекуле связь углерод-водород и азот-углерод. В нефти содержится азотсодержащий гетероцикл-пиридин. Азот входит в состав белков,нуклеиновых кислот и некоторых липидов Классификация
Амины - органические производные аммиака, в молекулах которого один, два или все три атома водорода замещены органическими радикалами. По числу радикалов амины делятся на первичные, вторичные и третичные.
· Взаимодействие с водой. Водные растворы алифатических аминов проявляют щелочную реакцию, так как при их взаимодействии с водой образуются гидроксидыалкиламмония, аналогичные гидроксиду аммония:
· Взаимодействуя с кислотами, амины образуют алкиламмониевые соли, в большинстве случаев растворимые в воде. Например, амины присоединяют галогеноводороды:
Основные свойства анилина: а) ароматический амин – анилин имеет большое практическое значение; б) анилин C6H5NH2 – это бесцветная жидкость, которая плохо растворяется в воде; в) имеет светло-коричневую окраску при частичном окислении на воздухе; г) анилин сильно ядовит. Основные свойства у анилина проявляются слабее, чем у аммиака и аминов предельного ряда. 1. Анилин не изменяет окраски лакмуса, но при взаимодействии с кислотами образует соли. 2. Если к анилину прилить концентрированную соляную кислоту, то происходит экзотермическая реакция и после охлаждения смеси можно наблюдать образование кристаллов соли: [C6H5NH3]+Cl- – хлорид фениламмония.
3. Если на раствор хлорида фениламмония подействовать раствором щелочи, то снова выделится анилин: [С6Н5NН3]+ + Сl- + Nа+ + ОН- -> Н2О + С6Н5NН2 + Nа+ + СI-. Здесь выражено влияние ароматического радикала фенила – С6Н5. 4. В анилине C6H5NH2 бензольное ядро смещает к себе неподеленную электронную пару азота аминогруппы. При этом электронная плотность на азоте уменьшается и он слабее связывает ион водорода, а это значит, что свойства вещества как основания проявляются в меньшей степени. 5. Аминогруппа влияет на бензольное ядро. 6. Бром в водном растворе не реагирует с бензолом. Способы применения анилина: 1) анилин – один из важнейших продуктов химической промышленности; 2) он является исходным веществом для получения многочисленных анилиновых красителей; 3) анилин используется при получении лекарственных веществ, например сульфаниламидных препаратов, взрывчатых веществ, высокомолекулярных соединений и т. д. Открытие профессором Казанского университета Н.Н. Зининым (1842 г.) доступного способа получения анилина имело большое значение для развития химии и химической промышленности. 1. Промышленность органического синтеза началась с производства красителей. 2. Широкое развитие этого производства стало возможным на основе использования реакции получения анилина, известной сейчас в химии под названием реакции Зинина. Особенности реакции Зинина: 1) эта реакция заключается в восстановлении нитробензола и выражается уравнением: С6Н5-NO2 + 6Н -> С6Н5-NН2 + 2Н2О; 2) распространенным промышленным способом получения анилина является восстановление нитробензола металлами, например железом (чугунными стружками), в кислой среде; 3) восстановление нитросоединений соответствующего строения – это общий способ получения аминов. Амины являются очень токсичными веществами. Опасно как вдыхание их паров, так и контакт с кожей. Амины, например анилин, способны всасываться сквозь кожу в кровь и нарушать функции гемоглобина, что может привести к летальному исходу. Симптомами отравления крови амином являются посинение кончиков пальцев, носа, губ, одышка, учащенные дыхание и сердцебиение, потеря сознания. В случае попадания амина на незащищенные участки кожи необходимо быстро и аккуратно, не увеличивая площадь поражения, очистить пораженный участок кожи ватой, смоченной в спирте. В случае отравления вывести пострадавшего на свежий воздух, обратиться к врачу. Аминокислоты – органические бифункциональные соединения, в состав которых входят карбоксильные группы –СООН и аминогруппы -NH2. Общая формула молекул аминокислот - NH2—R—COOH, где R - двухвалентный радикал. Аминокислоты классифицируют по двум структурным признакам. 1. В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на a-, b-, g-, d-, e- и т. д.
2. По характеру углеводородного радикала различают алифатические (жирные) и ароматические аминокислоты. Приведенные выше аминокислоты относятся к жирному ряду. Примером ароматической аминокислоты может служить пара-аминобензойная кислота
Аминокислоты в зависимости от поступления в организм делятся на заменимые и незаменимые. В таблице указаны незаменимые аминокислоты, присутствие которых в белках пищи обязательно; частично заменимые аминокислоты, которые в небольших количествах синтезируются в организме; условно заменимые аминокислоты, для синтеза которых необходимы незаменимые аминокислоты и, наконец, заменимые аминокислоты, потребность в которых может быть восполнена синтезом из других веществ.
Аминокислотный состав характеризует пищевую ценность белка. Чем выше содержание незаменимых аминокислот, тем больше пищевая ценность белка. Норма белков в питании составляет примерно 100 г в сутки. Белки
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 63; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.15.1 (0.117 с.) |
 Моющие и чистящие средства. Средства личной гигиены и косметики.
Моющие и чистящие средства. Средства личной гигиены и косметики.