Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
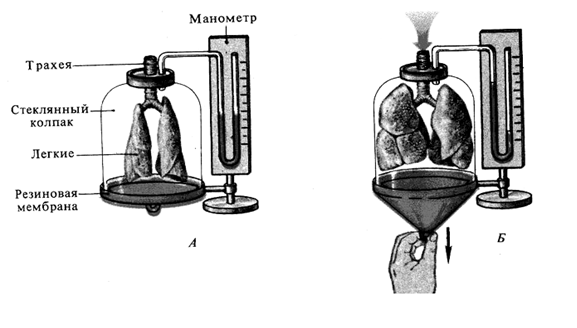
Механизм и биомеханика вдоха и выдоха. Использовать схему схему модели Дондерса. Перечислить и указать роль мышц вдоха и выдоха.Стр 1 из 18Следующая ⇒
Механизм и биомеханика вдоха и выдоха. Использовать схему схему модели Дондерса. Перечислить и указать роль мышц вдоха и выдоха. Вдох: ž Сокращение диафрагмы и наружных межреберных мышц, передние лестничные, стер.кл.маст. ž Увеличение объема грудной клетки ž Внутриплевральное давление становится более отрицательным ž Легкие растягиваются ž Внутрипульмональное давление становится более отрицательным ž Воздух входит в легкие Выдох: ž Расслабление диафрагмы и наружных межреберных мышц, сокращение внутрених межреберных мышц, ž Уменьшение объема грудной клетки ž Внутриплевральное давление становится менее отрицательным ž Легкие возвращаются в исходное положение ž Внутрипульмональное давление становится выше атмосферного Воздух выходит из легких Внешнее дыхание осуществляется благодаря изменениям объема грудной клетки и сопутствующим изменением объема легких. Объем грудной клетки увеличивается во время инспирации и уменьшается во время экспирации - обеспечение легочной вентиляции. В дыхании участвуют: 1) Дыхательные пути 2) Эластичная и растижимая легочная ткань 3) Грудная клетка Биомеханизмы, изменяющие объем грудной клетки: - поднятие и опускание ребер - движения купола диафрагмы Осуществляются инспираторными и экспираторными дыхательными мышцами. Инспираторные мышцы- диафрагма, наружные межреберные и межхрящевые мышцы. При форсированном дыхании участвуют дополнительны мышцы: трапициевилные, передние лестничные(поднимают два верхних ребра вверх) и грудино-ключично-сосцевидные. Экспираторные мышцы – внутренние межреберные и мышцы брюшной стенки. движение ребер – сокращаясь, наружные межреберные и межхрящевые мышцы в фазу инспирации поднимают ребра, в фазу выдоха ребра опускаются благодаря активнрсти внутренних межреберных мышц. Движение диафрагмы – во время спокойного вдоха купол диафрагмы опускается на 1.5-2 СМ, ПЕРИФЕРИЧЕСКАЯ МЫШЕЧНАЯ ЧАСТЬ Отходит от внутренней поверхности груд клетки(поднимая нижние 3 ребра) В постинспираторную фазу уменьшается сила сокращения мышечных волокон в диафрагме- купол поднимается вверх,благодаря эластической тяге легких и уведичению внутрибрюшного давления..
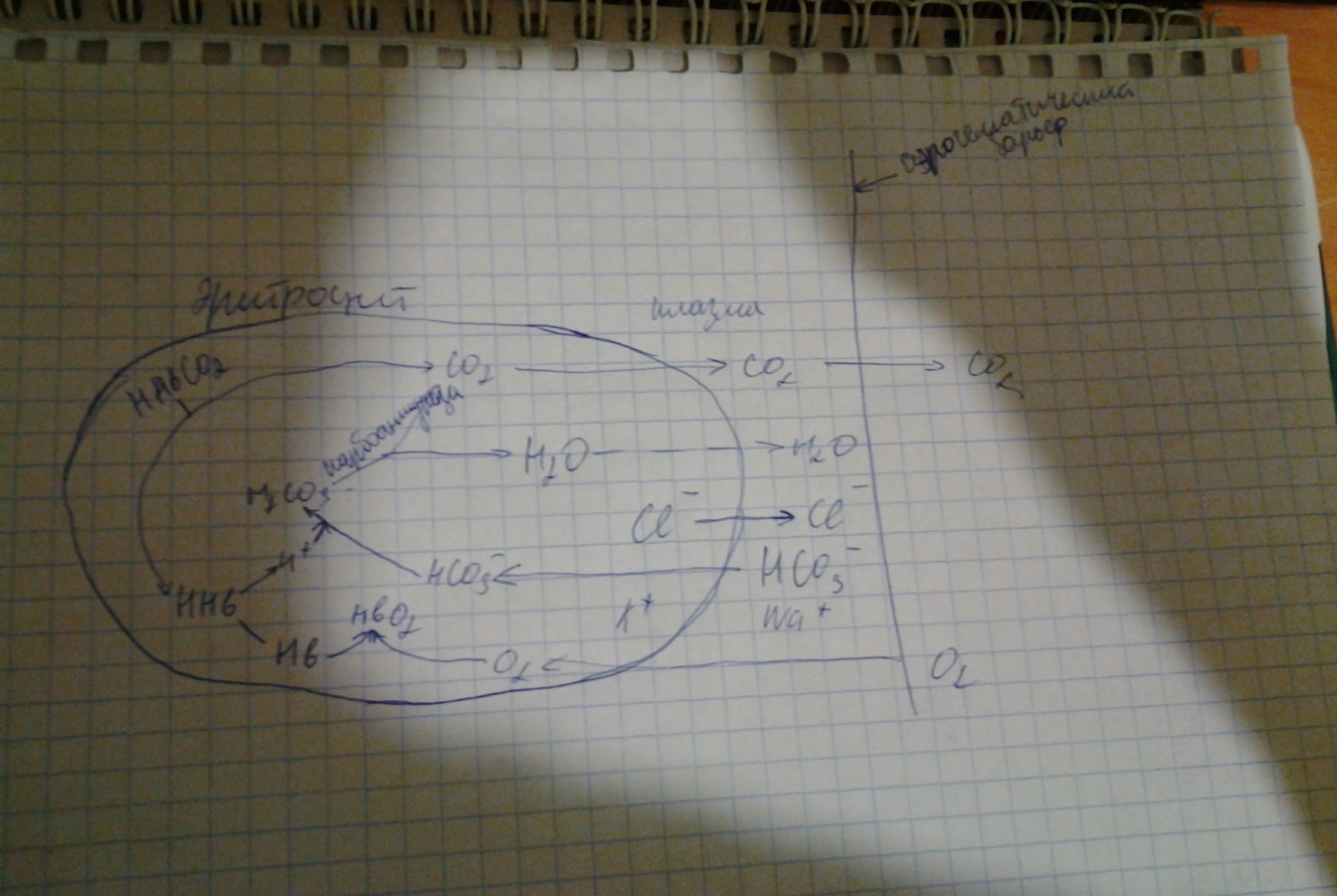
Показатели парциального давления, напряжения кислорода и углекис-лого газа в альвеолярном воздухе, артериальной и венозной крови. Меха-низм газообмена в малом круге кровообращения. Роль карбоангидразы. Газы,входящие в состав атмосферного, альвеолярного и выделяемого воздуха, имеют определенгоепорциальное давление,т.е. давление, прихдящееся на долю данного газа в смеси газов. Согласно закону Дальтона, парциальное давление газа в какой либо смеси прямо пропорционально его объемному содержанию. Альвеолярный воздух представлен смесью в основном кислорода,углекислого газа и азота. Кроме того, в альвеолярном воздухе содержаться водяные пары,которые также оказывают определеное парциальное давление, ппэтому при общем давлении смеси газов 760 мм.рт.ст. парциальное давление кислорода в альвеолярном воздухе составляет 104 мм.рт.ст., углекислого газа- 40 мм.рт.ст., а азота – 569 мм.рт.ст. парциальное давление водяных паров при темп 37 град. Составляет 47 мм.рт.мт. Напряжение кислорода в венозной крови составляет 40 мм.рт. ст. напряжение углекислого газа в венозной крови- 46 мм.рт.ст. Напряжение кислорода в артериальной крови составляет 100 мм.рт.ст. Напряжение углекислого газа в артериальной крови составляет 40мм. Рт. Ст. Механизм газообмена в легких: Газообмен килорода между кровью и легкими осуществляется за счет концентрационного градиента кислорода между этими средами(соглано закону Фика). Градиент кислорода на альвеолярно-капиллярной мембране составляет в среднем 60 мм.рт.ст.,что является одним из важнейших фактором начальной стадии диффузии этого газа из альвеол в кровь.транспорт кислорода начинается в каппилярах легких после его химического связывания с гемоглобином. Поступление углекислого газа в лезких из крови в альвеолы обеспечивается из следующих источников:1) из углекислого газа растворенного в плазме крови(5-10%);2) из гидрокарбонатов(80-90%);3) карбаминовых соединений эритроцитов(5-15%),которые способны диссоциировать. Транспорт углекислого газа из крови в альвеолы идет по концентрационному градиенту. Углекислый газ диффундирует из гидрокарбонатов плазмы крови в легкие в результате их быстрой диссоциации с помощью фермента карбоангидразы, содержащегося в эритроцитах. Весь процесс газообмпена в легких можно изообразить следующем образом:
Динамические показатели внешнего дыхания: минутный объём, минутная альвеолярная вентиляция. Определение понятий. Методы оценки. Х арактери-стика показателей в покое и при физической нагрузке. Значение в определении эффективности внешнего дыхания. Минутный объем дыхания (МОД) характеризует функцию внешнего дыхания. В спокойном состоянии воздух в трахее, бронхах, бронхиолах и в неперфузируемых альвеолах в газообмене не участвуют, так как не приходит в соприкосновение с активным легочным кровотоком — это так называемое «мертвое» пространство. Часть дыхательного объема, которая участвует в газообмене с легочной кровью, называется альвеолярным объемом. С физиологической точки зрения альвеолярная вентиляция — наиболее существенная часть наружного дыхания, так как она является тем объемом вдыхаемого за 1 мин воздуха, который обменивается газами с кровью легочных капилляров. МОД измеряется произведением ЧД на ДО. У здоровых лиц ЧД — 16—18 в минуту, а ДО колеблется в пределах 350—750 мл, у спортсменов ЧД — 8—12, а ДО — 900—1300 мл. Увеличение МОД (гипервентиляция) наблюдается вследствие возбуждения дыхательного центра, затруднения диффузии кислорода и др. В покое МОД составляет 5—6 л, при напряженной физической нагрузке может возрастать в 20—25 раз и достигать 120—150 л в 1 мин и более. Увеличение МОД находится в прямой зависимости от мощности выполняемой работы, но только до определенного момента, после которого рост нагрузки уже не сопровождается увеличением МОД. Даже при самой тяжелой нагрузке МОД никогда не превышает 70—80% уровня максимальной вентиляции. Расчет должной величины МОД основан на том, что у здоровых лиц из каждого литра провентилированного воздуха поглощается примерно 40 мл кислорода (это так называемый коэффициент использования кислорода — KИ). Его можно рассчитать по формуле: Должный МОД = должное потребление кислорода / 40 а должную величину поглощения кислорода рассчитывают по формуле: должный основной обмен (в ккал) / 7,07 где должный основной определяют по таблицам Гаррис-Бенедикта; 7,07 — число, полученное при умножении калорийной ценности 1 л кислорода (4,91 ккал) на число минут в сутках (1440 мин) и деленное на 1000. Альвеолярную вентиляцию за один дыхательный цикл можно рассчитать по формуле: VA=f*(VT-Vd), где f — частота дыхания; Vt — дыхательный объем. Объем альвеолярной вентиляции за одну минуту определяется по формуле: VA=VE-(f•Vd). В конечном счете величина альвеолярной вентиляции тем ниже, чем выше частота дыхания и меньше дыхательный объем. Величина физиологического мертвого пространства зависит от характера дыхания: оно увеличивается при углублении дыхания, так как изменяется объем бронхиального дерева, и при учащении дыхания, поскольку сокращается время, за которое должно произойти полное смешение воздуха, поступающего в респираторную зону легких. Таким образом, МОД разделяется на две неравноценные части: объем альвеолярной вентиляции (АВ) и объем вентиляции мертвого пространства. Поэтому для нормального газообмена важен не столько МОД, сколько минутный объем альвеолярной вентиляции. В покое он равен 3,0—4,0 л/мин.
Отношение альвеолярной вентиляции легких к общей (АВ/МОД) характеризует эффективность вентиляции, и у здоровых в покое оно составляет 60—75%. При физической нагрузке отношение АВ/МОД несколько увеличивается.
14 .Спирометрия. Принцип и значение метода.
Спирометрия является методом определения легочных объемов. Аппарат представляет собой воздушнуютурбинку, вращаемую струей выдыхаемого воздуха. Вращение турбинки передается стрелке прибора. Шкала градуирована в литрах. Методика. Для выполнения этой работы используется сухой спирометр. Мундштук предварительно обрабатывают дезинфицирующим раствором (например, спиртом). Перед каждым измерением перевести показания на нуль поворотом шкалы. Выдох производится в мундштук через рот. Нос при этом зажат. Исследование проводят в положении стоя. Измерение дыхательного объема (ДО). После спокойного вдоха делают спокойный выдох. Измерения повторяют несколько раз (не менее трех), вычисляют среднее значение. Величина ДОу взрослого человека в покое составляет 300-800 мл. Измерение жизненной емкости легких (ЖЕЛ). Делают максимально глубокий вдох и максимально глубокий выдох в спирометр без рывков, медленно напрягая все дыхательные мышцы, включая брюшной пресс. Повторяют 3-4 раза и берут наибольший показатель. У взрослого человека ЖЕЛ равна 3-5 литров. У мужчин на 10-15% больше, чем у женщин. Измерение резервного объема выдоха (РО выдоха). После спокойного вдоха, делают спокойный выдох в окружающее пространство и максимально глубокий выдох в спирометр. Измерение повторяют три раза, вычисляют среднее. У взрослого человека среднего роста РО выдоха равен 1000-1500 мл. Расчет величины резервного объема вдоха (РО вдоха). Пользуясь полученными данными, находят резервный объем вдоха как разность между ЖЕЛ и суммой ДО и РО выдоха. РО вдоха = ЖЕЛ – (ДО+РО выдоха). Расчет должной жизненной емкости легких (дЖЕЛ). Для оценки результатов определения ЖЕЛ необходимо определить соотношение ЖЕЛ к должной ЖЕЛ. Должная жизненная емкость рассчитывается по формуле: Для мужчин: дЖЕЛ = (27,63 – (0,112 х возраст)) х рост Для женщин: дЖЕЛ = (21,78 – (0,101 х возраст Из тетради взять Дыхательный центр охватывает практически все отделы головного мозга. В правой и левой половинах продолговатого мозга содержатся по два скопления дыхательных нейронов – дорсальное и вентральное дых ядра. Дорсальное дыхательное ядро содержит преимущественно инспираторные нейроны, аксоны которых направляются в основном к диафрагмальным ядрам шейного отдела спинного мозга. Коллатерали аксонов следуют также в вентральное дыхательное ядро, образуя возбуждающие синапсы на инспираторных нейронах.(возбуждение нейронов дыхательного ядра тормозит возбуждение экспираторных нейронов вентрального дыхательного ядра.) вентральное дых ядро протягивается от каудального края лицевого нерва до 1 шейного сегмента. Оно расположено в вентральной области продолговатого мозга. В нем содержатся ка инспираторные, так и экспираторные. Небольшое кол-во дыхательных нейронов встречается в РФ продолговатого мозга и моста. Третье компактное скопление дыхательных нейронов было обнаружено после перерезки блуждающих нервов в передней части моста, за четверохолмием.(мед парабрахиальное ядро).- пневмотаксический центр. Кора головного мозга, особенно ее префронтальные отделы, регулирует дыхание в соответствии с ее поведенческой деятельностью субъектов, при реакциях различной биологической и социальной значимости. Гипоталамус и РФ определяют участие дыхания в эмоциональных и вегетативных реакциях, а мозжечок приурочивает дыхание к движениям.
При перерезке спинного мозга на уровне верхних шейных сегментов дыхание прекращается. При перерезках по верхнему краю продолговатого мозга дыхание становится ритмическим, носудорожным(инспираторный и экспираторный компоненты). При перерезках по верхнему крою моста дыхание ритмично, с длинными паузами и задерживается на выдохе – апноэтический дыхательный центр. При перерезках по верхнему краю среднего мозга дыхание регулярное, плавное – пневмотаксических центр. Рефлекторные механизмы регуляции внешнего дыхания. Характеристика рецепторных зон, их локализация, роль в регуляции дыхания. Схема рефле-кторной реакции, возникающей при раздражении хеморецепторов каротид-ной зоны. Рефлекторная регуляция дыхания осуществляется благодаря тому, что нейроны дыхательного центра имеют связи с многочисленными механорецепторами дыхательных путей и альвеол легких и рецепторов сосудистых рефлексогенных зон. В легких человека находятся следующие типы механорецепторов: 1) ирритантные, или быстроадаптирующиеся, рецепторы слизистой оболочки дыхательных путей; 2) рецепторы растяжения гладких мышц дыхательных путей; 3) J-рецепторы. Рефлексы со слизистой оболочки полости носа. Раздражение ирритантных рецепторов слизистой оболочки полости носа, например табачным дымом, инертными частицами пыли, газообразными веществами, водой вызывает сужение бронхов, голосовой щели, брадикардию, снижение сердечного выброса, сужение просвета сосудов кожи и мышц. Защитный рефлекс проявляется у новорожденных при кратковременном погружении в воду. У них возникает остановка дыхания, препятствующая проникновению воды в верхние дыхательные пути.
Рефлексы с глотки. Механическое раздражение рецепторов слизистой оболочки задней части полости носа вызывает сильнейшее сокращение диафрагмы, наружных межреберных мышц, а следовательно, вдох, который открывает дыхательный путь через носовые ходы (аспирационный рефлекс). Этот рефлекс выражен у новорожденных. Рефлексы с гортани и трахеи. Многочисленные нервные окончания расположены между эпителиальными клетками слизистой оболочки гортани и главных бронхов. Эти рецепторы раздражаются вдыхаемыми частицами, раздражающими газами, бронхиальным секретом, инородными телами. Все это вызывает кашлевой рефлекс, проявляющийся в резком выдохе на фоне сужения гортани и сокращение гладких мышц бронхов, которое сохраняется долгое время после рефлекса. Кашлевой рефлекс является основным легочным рефлексом блуждающего нерва. Рефлексы с рецепторов бронхиол. Многочисленные миелинизированные рецепторы находятся в эпителии внутрилегочных бронхов и бронхиол. Раздражение этих рецепторов вызывает гиперпноэ, бронхоконстрикцию, сокращение гортани, гиперсекрецию слизи, но никогда не сопровождается кашлем. Рецепторы наиболее чувствительны к трем типам раздражителей: 1) табачному дыму, многочисленным инертным и раздражающим химическим веществам; 2) повреждению и механическому растяжению дыхательных путей при глубоком дыхании, а также пневмотораксе, ателектазах, действии бронхоконстрикторов; 3) легочной эмболии, легочной капиллярной гипертензии и к легочным анафилактическим феноменам. Рефлексы с J-рецепторов. В альвеолярных перегородках в контакте с капиллярами находятся особые J-рецепторы. Эти рецепторы особенно чувствительны к интерстициальному отеку, легочной венозной гипертензии, микроэмболии, раздражающим газам и ингаляционным наркотическим веществам, фенилдигуаниду (при внутривенном введении этого вещества). Стимуляция J-рецепторов вызывает вначале апноэ, затем поверхностное тахипноэ, гипотензию и брадикардию. Рефлекс Геринга — Брейера. Раздувание легких у наркотизированного животного рефлекторно тормозит вдох и вызывает выдох. Перерезка блуждающих нервов устраняет рефлекс. Нервные окончания, расположенные в бронхиальных мышцах, играют роль рецепторов растяжения легких. Их относят к медленно адаптирующимся рецепторам растяжения легких, которые иннервируются миелинизированными волокнами блуждающего нерва. Рефлекс Геринга — Брейера контролирует глубину и частоту дыхания. У человека он имеет физиологическое значение при дыхательных объемах свыше 1 л (например, при физической нагрузке). У бодрствующего взрослого человека кратковременная двусторонняя блокада блуждающих нервов с помощью местной анестезии не влияет ни на глубину, ни на частоту дыхания. У новорожденных рефлекс Геринга — Брейера четко проявляется только в первые 3—4 дня после рождения. Проприоцептивный контроль дыхания. Рецепторы суставов грудной клетки посылают импульсы в кору больших полушарий и являются единственным источником информации о движениях грудной клетки и дыхательных объемах. Межреберные мышцы, в меньшей степени диафрагма, содержат большое количество мышечных веретен. Активность этих рецепторов проявляется при пассивном растяжении мышц, изометрическом сокращении и изолированном сокращении интрафузальных мышечных волокон. Рецепторы посылают сигналы в соответствующие сегменты спинного мозга. Недостаточное укорочение инспираторных или экспираторных мышц усиливает импульсацию от мышечных веретен, которые через γ-мотонейроны повышают активность α-мотонейронов и дозируют таким образом мышечное усилие. Хеморефлексы дыхания. Рo2 и Рсо2 в артериальной крови человека и животных поддерживается на достаточно стабильном уровне, несмотря на значительные изменения потребления О2 и выделение СО2. Гипоксия и понижение рН крови (ацидоз) вызывают усиление вентиляции (гипервентиляция), а гипероксия и повышение рН крови (алкалоз) — понижение вентиляции (гиповентиляция) или апноэ. Контроль за нормальным содержанием во внутренней среде организма О2, СО2 и рН осуществляется периферическими и центральными хеморецепторами. Адекватным раздражителем для периферических хеморецепторов является уменьшение Ро2 артериальной крови, в меньшей степени увеличение Рco2 и рН, а для центральных хеморецепторов — увеличение концентрации Н+ во внеклеточной жидкости мозга. Артериальные (периферические) хеморецепторы. Периферические хеморецепторы находятся в каротидных и аортальных тельцах. Сигналы от артериальных хеморецепторов по синокаротидным и аортальным нервам первоначально поступают к нейронам ядра одиночного пучка продолговатого мозга, а затем переключаются на нейроны дыхательного центра. Ответ периферических хеморецепторов на понижение Рао2 является очень быстрым, но нелинейным. При Рао2 в пределах 80—60 мм рт.ст. (10,6—8,0 кПа) наблюдается слабое усиление вентиляции, а при Раo2 ниже 50 мм рт.ст. (6,7 кПа) возникает выраженная гипервентиляция. Рaсо2 и pН крови только потенцируют эффект гипоксии на артериальные хеморецепторы и не являются адекватными раздражителями для этого типа хеморецепторов дыхания. Реакция артериальных хеморецепторов и дыхания на гипоксию. Недостаток О2 в артериальной крови является основным раздражителем периферических хеморецепторов. Импульсная активность в афферентных волокнах синокаротидного нерва прекращается при Рао2 выше 400 мм рт.ст. (53,2 кПа). При нормоксии частота разрядов синокаротидного нерва составляет 10% от их максимальной реакции, которая наблюдается при Раo2 около 50 мм рт.ст. и ниже. Гипоксическая реакция дыхания практически отсутствует у коренных жителей высокогорья и исчезает примерно через 5 лет у жителей равнин после начала их апаптации к высокогорью (3500 м и выше). Центральные хеморецепторы. Окончательно не установлено местоположение центральных хеморецепторов. Исследователи считают, что такие хеморецепторы находятся в ростральных отделах продолговатого мозга вблизи его вентральной поверхности, а также в различных зонах дорсального дыхательного ядра. Наличие центральных хеморецепторов доказывается достаточно просто: после перерезки синокаротидных и аортальных нервов у подопытных животных исчезает чувствительность дыхательного центра к гипоксии, но полностью сохраняется реакция дыхания на гиперкапнию и ацидоз. Перерезка ствола мозга непосредственно выше продолговатого мозга не влияет на характер этой реакции. Адекватным раздражителем для центральных хеморецепторов является изменение концентрации Н* во внеклеточной жидкости мозга. Функцию регулятора пороговых сдвигов рН в области центральных хеморецепторов выполняют структуры гематоэнцефалического барьера, который отделяет кровь от внеклеточной жидкости мозга. Через этот барьер осуществляется транспорт О2, СО2 и Н+ между кровью и внеклеточной жидкостью мозга. Транспорт СО2 и Н+ из внутренней среды мозга в плазму крови через структуры гематоэнцефалического барьера регулируется с участием фермента карбоангидразы. Реакция дыхания на СО2. Гиперкапния и ацидоз стимулируют, а гипокапния и алкалоз тормозят центральные хеморецепторы. Для определения чувствительности центральных хеморецепторов к изменению рН внеклеточной жидкости мозга используют метод возвратного дыхания. Испытуемый дышит из замкнутой емкости, заполненной предварительно чистым О2. При дыхании в замкнутой системе выдыхаемый СО2 вызывает линейное увеличение концентрации СО2 и одновременно повышает концентрацию Н+ в крови, а также во внеклеточной жидкости мозга. Тест проводят в течение 4—5 мин под контролем содержания СО2 в выдыхаемом воздухе. Рецепторы растяжения легких N.vagus 3.продолговатый мозг – дыхательный центр (повышение активности постинспираторных нейронов) Мотонейроны спинного мозга Дыхательная мускулатура
Основные изменения со стороны исполнительных органов ФУС газового гомеостаза при экстренной адаптации к большой высоте в условиях низкого атмосферного давления. (показатели внешнего дыхания, сердца и сосудис-того тонуса, крови). Основным следствием понижения атм давления яв-ся гипоксия, развивающаяся вследствие низк парциального давл кислорода во вдыхаемом воздухе. На высоте 2,5-5км наступает ув вентиляции легких(стимуляция каротидных хеморец-в). Повышается арт давление и ув ЧСС àнаправлены на усиления кровоснабжения тканей О2. Ув вентиляции легуих на высоте может оказывать и отриц воздействие- оно ведет к снижению парциального давления СО2 в альвеолярном воздухе и удалении ее из крови. -à гипоксия сочетается с гипокапнией. При гипокапнии ослабевает стимуляция хеморец-в,(особ. центр) что ограничивает ув вентиляции легких. На высоту 4-5 км, развивается высотная болезнь: слабость, цианоз, снижение ЧСС, арт.давлвения. на высоте свыше 7 км – потеря сознания и нарушения кровообращения и дыхания. Длительное пребывание в условиях низк атмосферного давления сопровождается акклиматизацией: 1. Ув кол-ва эритроцитов в крови вследствие усиления эритропоэза 2. Ув содержания гемоглобина в крови и повышением кислородной емкости крови. 3. Ув вентиляции легких 4. Ускорение диссоциации оксигемоглобина в тканевых капиллярах вследствие сдвига кривой диссоциации оксигемоглобина вправо, вызванного ув содержания в эритроцитах 2,3 – глицерофосфата 5. Повышение плотности кровеносных капилляров в тканях, а также ув их длины и извилистости 6. Повешение устойчивости клеток, особенно нервных, к гипоксии.
Состояние исполнительных органов ФУС газового гомеостаза при длительной адаптации к большой высоте в условиях низкого атмосферного давления (показатели внешнего дыхания, сердца и сосудистого тонуса, крови). 1. циркуляторная акклиматизация: частота пульса сначала ув, а потом снижается. СО ек меняется, максимальный сердечный выброс снижается. 2. респираторная акклиматизация: дыхательные реакции на недостаток О2 во вдыхаемом воздухе менее выражены.однако, система дыхания становится более чувствительна к кислородной недостаточности в крови и повышению СО2(невозможна длительная задержка дыхания). 3. изменение транспорта О2 и состава крови. В начале число эритроцитов может снижаться из-за более быстрого их разрушения. Затем эритроцитоз(на высоте 4500 м увеличение числа эритроцитов на 10%). Гемоглобин до 270г/л, гематокрит 70%, рост числа ретикулоцитов. Нарастает в эритроцитах 2,3 ДФГ – сдвиг кривой диссоциации гемоглобина О2 вправо. 4. кислотно-щелочное равновесие – восстанавливается – почки выделяют больше бикарбонатов, компенсируя респираторный алкалоз. Ув буферная емкость крови за счет гемоглобина, но затем снижается потери бикарбонатов. 5. изменение мышечной ткани – с увеличением в ней плотности капилляров, что сокращает диффузию О2. Митохондрии адаптируются к недостатку О2 и аэробному метаболизму. Гипертрофия миокарда.
Гуморальная регуляция.
Нервные влияния реализуются вазомоторными ветвями почечных нервов, преимущественно симпатической природы, обеспечивающими изменение соотношения тонуса приносящих и выносящих артериол клубочков. Кроме того, симпатические влияния на юкстагломерулярные клетки через бета-адрено-рецепторы стимулируют секрецию ренина и тем самым реализуют ангиотензинный механизм регуляции фильтрации (спазм выносящих и/или приносящих артериол). Гуморальные факторы (табл. 14.1) могут как увеличивать, так и уменьшать клубочковую фильтрацию через три описанных выше механизма, причем эффекты вазопрессина реализуются через V2-peцепторы. Важнейшую роль в обеспечении постоянства СКФ играет местная ауторегуляция коркового кровотока в почке. 35.Характеристика первичной мочи. Количество, скорость образования, состав. Факторы, влияющие на эти показатели. Поскольку первичная моча (клубочковыйультрафильтрат) образуется из плазмы крови, по своему составу она близка плазме, почти полностью лишенной белков. Так, в ультрафильтрате такое же как в плазме крови количество аминокислот(0,008%), глюкозы= 3,3-5,5ммоль/л, мочевины(0,03%), креатинина(0,006%), свободных ионов и низкомолекулярных комплексов. В связи с тем, что белки-анионы не проникают через клубочковый фильтр, для сохранения мембранного равновесия Доннана (равенства произведений концентрации противоположно заряженных ионов электролитов, находящихся по обе стороны мембраны) в первичной моче оказывается на 5% больше концентрация анионов хлора и бикарбоната и, пропорционально меньше концентрация катионов натрия и калия. В первичную мочу проходит небольшое количество наиболее мелких молекул белка -менее 3% гемоглобина и 0,01% альбуминов.Основной количественной характеристикой процесса фильтрации является скорость клубочковой фильтрации (СКФ) — количество первичной мочи, образующейся за единицу времени. В норме скорость клубочковой фильтрации составляет 90—140 мл в минуту. За сутки образуется 130—200 л первичной мочи (это примерно в 4 раза больше общего количества жидкости в организме). Факторы, влияющие на эти показатели: Влияние на почки · Расширение афферентной гломерулярной артериолы, сужение эфферентной гломерулярной артериолы, расслабление мезангиальных клеток. Повышение давления в клубочковых капиллярах и увеличение скорости клубочковой фильтрации. · Удаление натрия хлорида и мочевины из интерстиция медуллярного слоя[5]. · Снижение реабсорбции натрия в дистальном извитом канальце через цГМФ-зависимое фосфорилирование эпителиальных натриевых каналов. · Ингибирование секреции ренина. · Снижение секреции альдостерона.
Понятие кислотно-основного равновесия, значение для гомеостаза. Фи-зиологические показатели рН крови. Характеристика состояний ацидоза, алкалоза. Способы регуляции при участии буферных систем и органов выделения. Кисло́тно-осно́вное равнове́сие — относительное постоянство соотношения кислота-основание внутренней среды живого организма. Также называют кисло́тно-щелочно́е равнове́сие, кислотно-щелочной баланс, равновесие кислот и оснований. Является составной частью гомеостаза. Количественно характеризуется либо концентрацией водородных ионов (протонов) в молях на 1 л, либоводородным показателем pH. Циркулирующая кровь представляет собой взвесь живых клеток в жидкой среде, химические свойства которой очень важны для их жизнедеятельности. У человека за норму принят диапазон колебаний pH крови 7,37-7,44 со средней величиной 7,4. Буферные системы крови слагаются из буферных систем плазмы и клеток крови и представлены следующими системами[1]: · бикарбона́тная бу́ферная систе́ма; · фосфа́тная бу́ферная систе́ма; · белко́вая бу́ферная систе́ма; · гемоглоби́новая бу́ферная систе́ма. · оксигемоглобиновая буферная система
Бикарбонатная мощнейшая и вместе с тем самая управляемая система внеклеточной жидкости и крови, на долю которой приходится около 10 % всей буферной ёмкости крови. Представляет собой сопряжённую кислотно-основную пару, состоящую из молекулы угольной кислоты H2CO3, являющейся источником протона, и бикарбонат-аниона HCO3−, выполняющего роль акцептора протона: H2CO3 ↔ H+ + HCO3−. Фосфатная В крови емкость фосфатной буферной системы невелика (составляет не более 1% общей буферной емкости), в связи с низким содержанием фосфатов в крови. Фосфатный буфер выполняет значительную роль в поддержании физиологических значений рН во внутриклеточных жидкостях и моче. Буфер образован неорганическими фосфатами. Роль кислоты в этой системе выполняет однозамещённый фосфат (NaH2PО4), а роль сопряженного основания — двузамещённый фосфат (Na2HPО4). При рН 7,4 соотношение [Н2РО4-/ НРО42-] равняется 1:4. Буферные свойства системы при увеличении в крови содержания водородных ионов реализуются за счет их связывания с ионами НРО42- с образованием Н2РО4- (Н+ + НРО42- → Н2РО4-), а при избытке ионов ОН- — за счет связывания их с ионами Н2Р04- (ОН- + Н2РО4- → НРО4-2 + Н2О). Фосфатная буферная система крови тесно взаимосвязана с бикарбонатной буферной системой. Белковая В сравнении с другими буферными системами имеет меньшее значение для поддержания кислотно-основного равновесия. Белки́ плазмы крови благодаря наличию кислотно-основных групп в молекулах белков (белок—H+ — кислота, источник протонов и белок− — сопряжённое основание, акцептор протонов) образуют буферную систему, наиболее эффективную в диапазоне pH 7,2—7,4[1]. Гемоглобиновая Самая мощная буферная система крови (в 9 раз мощнее бикарбонатной), на долю которой приходится 75 % всей буферной ёмкости крови.
Роль почек в регуляции кислотно-основного состояния. Почки участвуют в поддержании постоянства концентрации Н+ в крови, экскретируя кислые продукты обмена. Активная реакция мочи у человека и животных может очень резко меняться в зависимости от состояния кислотно-основного состояния организма. Концентрация Н+ при ацидозе и алкалозе различается почти в 1000 раз, при ацидозе рН может снижаться до 4,5, при алкалозе — достигать 8,0. Это способствует участию почек в стабилизации рН плазмы крови на уровне 7,36. Механизм подкисления мочи основан на секреции клетками канальцев Н+ (рис. 12.10). В апикальной плазматической мембране и цитоплазме клеток различных отделов нефрона находится фермент карбоангидраза (КА), катализирующий реакцию гидратации СО2: СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО3-.
Секреция Н+ создает условия для реабсорбции вместе с гидрокарбонатом равного количества Na+. Наряду с натрий-калиевым насосом и электрогенным натриевым насосом, обусловливающим перенос Na+ с С1- реабсорбция Na+ с гидрокарбонатом играет важную роль в поддержании натриевого баланса. Фильтрующийся из плазмы крови гидрокарбонат соединяется с секретированным клеткой Н+ и в просвете канальца превращается в СО2. Образование Н+ происходит следующим образом. Внутри клетки вследствие гидратации СО2 образуется Н2СО3 и диссоциирует на Н+ и НСО3-. В просвете канальца Н+ связываются не только с HCO3-, но и с такими соединениями, как двузамещенный фосфат (Na2HPO4), и некоторыми другими, в результате чего увеличивается экскреция титруемых кислот (ТА-) с мочой. Это способствует выделению кислот и восстановлению резерва оснований в плазме крови. Наконец, секретируемый Н+ может связываться в просвете канальца с NHз, образующимся в клетке при дезаминировании глутамина и ряда аминокислот и диффундирующим через мембрану в просвет канальца, в котором образуется ион аммония: NH3 + Н+→ NH4+ Этот процесс способствует сбережению в организме Na+ и К+, которые реабсорбируются в канальцах. Таким образом, общая экскреция кислот почкой (UH+ •V) складывается из трех компонентов — титруемых кислот (Uta∙V), аммония (UNH4∙V) и гидрокарбоната:
UH+∙ V= VTA ∙ V + UNH4 ∙ V ─ V-HCO3 ∙V
При питании мясом образуется большее количество кислот и моча становится кислой, а при потреблении растительной пищи рН сдвигается в щелочную сторону. При интенсивной физической работе из мышц в кровь поступает значительное количество молочной и фосфорной кислот и почки увеличивают выделение «кислых» продуктов с мочой.
Кислотовыделительная функция почек во многом зависит от кислотно-основного состояния организма. Так, при гиповентиляции легких происходит задержка СО2 и снижается рН крови — развивается дыхательный ацидоз, при гипервентиляции уменьшается напряжение СО2 в крови, растет рН крови — возникает состояние дыхательного алкалоза. Содержание ацетоуксусной и β-оксимасляной кислот может нарастать при не леченом сахарном диабете. В этом случае резко снижается концентрация гидрокарбоната в крови, развивается состояние метаболического ацидоза. Рвота, сопровождающаяся потерей соляной кислоты, приводит к увеличению в крови концентрации гидрокарбоната и метаболическому алкалозу. При нарушении баланса Н+ вследствие первичных изменений напряжения СО2 развивается дыхательный алкалоз или ацидоз, при изменении концентрации НСО3- наступает метаболический алкалоз или ацидоз. Наряду с почками в нормализации кислотно-основного состояния участвуют и легкие. При дыхательном ацидозе увеличиваются экскреция Н+ и реабсорбция НСО3-, при дыхательном алкалозе уменьшаются выделение Н+ и реабсорбция HCΟ3-.
Метаболический ацидоз компенсируется гипервентиляцией легких. В конечном счете почки стабилизируют концентрацию гидрокарбоната в плазме крови на уровне 26—28 ммоль/л, а рН — на уровне 7,36.
Механизм и биомеханика вдоха и выдоха. Использовать схему схему модели Дондерса. Перечислить и указать роль мышц вдоха и выдоха. Вдох: ž Сокращение диафрагмы и наружных межреберных мышц, передние лестничные, стер.кл.маст. ž Увеличение объема грудной клетки ž Внутриплевральное давление становится более отрицательным ž Легкие растягиваются ž Внутрипульмональное давление становится более отрицательным ž Воздух входит в легкие Выдох: ž Расслабление диафрагмы и наружных межреберных мышц, сокращение внутрених межреберных мышц, ž Уменьшение объема грудной клетки ž Внутриплевральное давление становится менее отрицательным ž Легкие возвращаются в исходное положение ž Внутрипульмональное давление становится выше атмосферного Воздух выходит из легких Внешнее дыхание осуществляется благодаря изменениям объема грудной клетки и сопутствующим изменением объема легких. Объем грудной клетки увеличивается во время инспирации и уменьшается во время экспирации - обеспечение легочной вентиляции. В дыхании участвуют: 1) Дыхательные пути 2) Эластичная и растижимая легочная ткань 3) Грудная клетка Биомеханизмы, изменяющие объем грудной клетки: - поднятие и опускание ребер - движения купола диафрагмы Осуществляются инспираторными и экспираторными дыхательными мышцами.
|
|||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 191; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.140.5 (0.143 с.) |