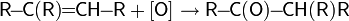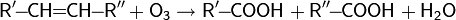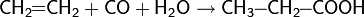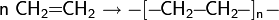Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции радикального замещения
При высоких температурах (более 400 °C) реакции радикального присоединения, носящие обратимый характер, подавляются. В этом случае становится возможным провести замещение атома водорода, находящегося в аллильном положении при сохранении двойной связи:
Реакция носит радикальный характер и протекает аналогично хлорированию алканов. Аллильное бромирование обычно проводят N-бромсукцинимидом (реакция Воля-Циглера)[36] в присутствии перекиси бензоила в среде тетрахлорметана или в бинарной смеси диметилсульфоксида и воды[34]:
Окисление Окисление алкенов может происходить в зависимости от условий и видов окислительных реагентов как с разрывом двойной связи, так и с сохранением углеродного скелета. [править] Окисление неорганическими окислителями
На первом этапе происходит присоединение оксида осмия к алкену, затем под действием воосстановителя (Zn или NaHSO3) образовавшийся комплекс переходит к диолу (Реакция Криге). Аналогично реакция идет в нейтральной или слабощелочной среде под действием KMnO4 (Реакция Вагнера)[37]:
[править] Окисление в присутствии солей палладия В присутствии солей палладия этилен окисляется до ацетальдегида[1]:
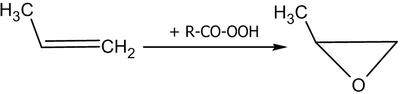
Реакция идет в кислой среде и является промышленным способом получения ацетальдегида. Аналогично образуется ацетон из пропена. [править] Эпоксидирование При действии на алкены пероксикарбоновых кислот образуются эпоксиды (реакция Прилежаева)[38]:
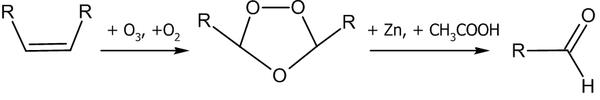
Реакция эпоксидирования используется для промышленного получения этиленоксида. Окислителем выступает кислород воздуха; процесс идет на серебряном катализаторе при 200—250 °C под давлением. Озонолиз Озонолиз алкенов обычно проводят при низких температурах (от −80 до −30 °C) в инертном растворителе (гексан, тетрахлорметан, хлороформ, этилацетат и пр.). Непосредственные продукты озонолиза не выделяют, а подвергают дальнейшему гидролизу, окислению или восстановлению[37].
На первой стадии происходит присоединение озона с образованием озонида. Далее под действием восстановителя (например: Zn + CH3COOH) озонид разлагается:
Если взять более сильный восстановитель, скажем — алюмогидрид лития, продуктом реакции будут спирты.
В данном случае разложение озонида происходит под действием окислителей (пероксид водорода, оксид серебра, пероксикислоты и пр.[37]). Реакция карбонилирования Алкены в присутствии катализатора, высокой температуры и давления присоединяют CO и H2 с образованием альдегидов[39]:
Аналогично протекает реакция CO и H2O с образованием карбоновых кислот:
Если вместо воды использовать спирт, конечным продуктом реакции будет сложный эфир[39]:
Реакции полимеризации Полимеризация алкенов может протекать как по свободнорадикальному, так и катионно-анионному механизму. По первому методу получают полиэтилен высокого давления:
Катализатором реакции выступают пероксиды. Второй метод предполагает использование в качестве катализаторов кислот (катионная полимеризация), металлорганических соединений (катализаторы Циглера-Натта, анионная полимеризация). Преимуществом метода является возможность получения стереоселективных полимеров. Вопросы для самоконтроля: 1. Номенклатура алкенов 2. Изомерия 3. Способы получения 4. Физические свойства 5. Химические свойства Рекомендуемая литература: 1. Перекалин В.В., Зонис С.А. Органическая химия. М.,1982 2. Терней А. Современная органическая химия. М.,1979 3. Петров Е.Е., Бальян Х.В., Трощенко А.Т. Органическая химия. М, 1974 4. Ю. А. Жданова «Очерки методологии органической химии», Изд. «Высшая школа»., М., 1960.
|
|||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 92; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.109.30 (0.007 с.) |





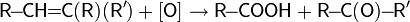 (кетон)
(кетон)