
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электрохимическая коррозия металлов
Определение. Коррозия это разрушение металлов в результате физико-химического взаимодействия их с компонентами окружающей среды. Электрохимическая коррозия наблюдается в случае электрического контакта двух различных металлов с раствором электролита (рис. 2). При этом возникают микроскопические гальванические элементы (гальванические пары).
Рис. 1. Электрохимическая коррозия магния при контакте с железом в растворе с рН < 7 (а) и рН ≥ 7 (б).
В качестве примера рассмотрим электрохимическую коррозию магния при контакте с железом (рис. 2). Определим по таблице (Приложение 1) стандартные потенциалы магния и железа
Так как стандартный потенциал магния меньше, в паре с железом он будет анодом, магний окисляется, ионы магния переходят в раствор. Поверхность железа является катодом, в кислой среде (рН < 7) протекает реакция (6) и выделяется газообразный водород, в нейтральной среде (рН ≥ 7) восстанавливается кислород согласно схеме (7). Анодный процесс. При электрохимической коррозии анодным процессом всегда является окисление металла, с меньшим стандартным потенциалом.
В результате происходит растворение металла и переход его в раствор, анод приобретает отрицательную полярность (рис. 2). Катодный процесс. Электроны, освободившиеся на аноде, перемещаются к катодному участку, имеющему больший потенциал. Электроны расходуются в процессе восстановления каких-либо ионов или молекул (деполяризация). В зависимости от состава электролита различают водородную деполяризацию при рН < 7
и кислородную деполяризацию при рН ≥ 7
Опыт 1. Электрохимическая коррозия при образовании гальванических пар Реактивы и оборудование. Гранулированный цинк (х.ч.); медная проволока; железная пластина покрытая цинком; железный стержень покрытый оловом (луженый); раствор H2SO4 2,0 н; раствор гексацианоферрата (III) калия K3[Fe(CN)6] 0,5 М. а) Взаимодействие цинка с серной кислотой в отсутствие и в присутствии меди Выполнение работы. Внести в пробирку 1/4 ее объема раствора 2 н H2SO4 и 1 гранулу цинка. Отметить выделение водорода на поверхности цинка. Прикоснуться зачищенной медной проволокой к кусочку цинка в пробирке. Отметить изменение интенсивности выделения водорода. На каком металле он выделяется?
Запись данных опыта. Зарисовать схему опыта, записать наблюдения за протеканием реакций. 1. Определить стандартные потенциалы меди и цинка (табл. П. 1) 2. Указать катод и анод; их заряды; записать уравнения катодного и анодного процессов. 3. Составить схему электрохимической коррозии при контакте цинка и меди в растворе кислоты (см. рис. 2). б) Коррозия оцинкованного и луженого железа Выполнение работы. В две пробирки налить на 1/2 их объема дистиллированной воды. В каждую добавить по 2 – 3 капли 2 н серной кислоты и гексацианоферрата (III) калия K3[Fe(CN)6]. Растворы перемешать. В первую пробирку опустить пластину оцинкованного железа, во вторую – луженого. Отметить изменение окраски растворов. Запись данных опыта. Зарисовать схему опыта, записать наблюдения за протеканием реакций. Учесть, что гексацианоферрат является индикатором наличия в растворе либо ионов Zn2+, либо Fe2+.
Сделать письменный вывод, какой из металлов окисляется при коррозии, и переходит в раствор. 1. Определить стандартные потенциалы железа, олова и цинка (табл. П. 1) 2. Указать катод и анод; их заряды; записать уравнения катодного и анодного процессов для гальванических пар жлезо-цинк и железо-олово. 3. Составить схемы электрохимической коррозии при контакте цинка и железа, а также олова и железа в растворе кислоты (см. рис. 2).
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 607; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.15.94 (0.006 с.) |
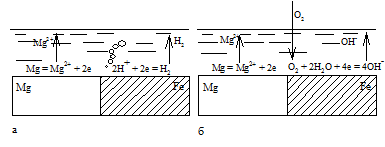
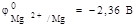 ;
; 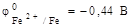 .
.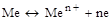
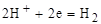
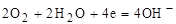
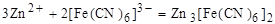 , выпадает белый осадок;
, выпадает белый осадок;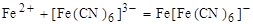 , синее окрашивание раствора.
, синее окрашивание раствора.


