
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение молярной массы растворенного вещества методом криоскопииСтр 1 из 8Следующая ⇒
ЛАБОРАТОРНЫЕ РАБОТЫ ПО КУРСУ «ХИМИЯ» Учебно-лабораторный журнал Выполнил:
Тверь 201_ Практическая работа 4 ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ РАСТВОРЕННОГО ВЕЩЕСТВА МЕТОДОМ КРИОСКОПИИ Раствором называется гомогенная система переменного состава, состоящая из двух или более компонентов (растворитель + одно или несколько растворенных веществ). Свойства растворов, которые зависят только от концентрации частиц в растворе, но не зависят от их природы, называются коллигативными. К таким свойствам относятся, в частности, понижение давления пара растворителя над раствором, повышение температуры кипения и понижение температуры кристаллизации раствора в сравнении с чистым растворителем. В данной лабораторной работе понижение температуры кристаллизации раствора по сравнению с температурой кристаллизации чистого растворителя используется для определения молярной массы неизвестного растворенного вещества.
Экспериментальная часть Реактивы: водный раствор неизвестного неэлектролита А с массовой долей растворенного вещества 30% (плотность раствора – 1,08 г/см3), дистиллированная вода, лед, поваренная соль. Оборудование: прибор для криоскопических исследований (криостат) (рис. 5.4); химический стакан для приготовления исследуемого раствора; кристаллизатор для приготовления охлаждающей смеси; две бюретки (с 30%-ным раствором вещества А и дистиллированной водой); шпатель; секундомер.
Рис. 1. Прибор для криоскопических исследований (криостат): 1 – внутренняя пробирка; 2 – пробка внутренней пробирки; 3 – термометр с ценой деления 0,1 оС; 4 – мешалка для перемешивания раствора; 5 – кольцо мешалки; 6 – наружняя пробирка; 7 – крышка; 8 – стеклянный сосуд с охлаждающей смесью; 9 – мешалка для охлаждающей смеси. (В некоторых криостатах позиции 4, 5 и 9 могут отсутствовать.)
Ход работы: 1. Приготовьте раствор для исследования. Для этого в химический стакан с помощью бюретки сначала налейте 2 мл 30%-ного раствора вещества А. Затем с помощью другой бюретки внесите в этот же стакан 8 мл дистиллированной воды. (Значения объемов a и b указывает преподаватель.) Полученный раствор тщательно перемешайте. 2. В кристаллизаторе приготовьте охлаждающую смесь из льда и соли. Заполните ею стеклянный сосуд криостата.
3. Внутреннюю пробирку криостата до ~ ½ ее объема заполните приготовленным раствором вещества А. Не пытайтесь залить в пробирку весь приготовленный раствор! Убедитесь, что при погружении пробирки в криостат раствор в ней будет полностью окружен охлаждающей смесью. 4. Поместите пробирку с раствором в охлаждающую смесь и фиксируйте изменение температуры в пробирке через каждые 15 секунд. Осторожно перемешивайте раствор в пробирке мешалкой или (если ее нет) термометром. Старайтесь не повредить термометр! 5. Полученные экспериментальные данные занесите в таблицу (табл. 1). Таблица 1 Зависимость температуры раствора от продолжительности охлаждения
Продолжайте измерение температуры до тех пор, пока она не достигнет значения –10 оС. По окончании опыта выньте внутреннюю пробирку из криостата, поместите ее под струю теплой водопроводной воды и дождитесь, пока кристаллы расплавятся. Затем раствор из пробирки можно вылить. 6. По данным таблицы постройте график зависимости температуры раствора от времени его охлаждения t = f(τ) в пределах изменения температур от +5 до –10 оС (точки, выходящие за эти границы, на график не наносите). 7. По графику определите температуру кристаллизации раствора t кр(р-ра). Вычислите понижение температуры кристаллизации раствора в сравнении с чистым растворителем ∆ Т кр. 8. Вычислите массу растворенного вещества и массу растворителя в приготовленном растворе: m в-ва = V р-ра А · ρ р-ра · ω (А); m в-ва = a · 1,08 · 0,3 = … г; m воды = V р-ра А · ρ р-ра · (1 – ω (А)) + V воды · ρ воды; m воды = а · 1,08 · (1 – 0,3) + b · 1 = … г. 9. По формуле (6) рассчитайте молярную массу неизвестного неэлектролита А. 10. Узнайте у преподавателя справочное значение М (А) и вычислите относительную ошибку эксперимента: Контрольные вопросы для защиты работы 1. От чего зависят температуры кипения и кристаллизации раствора? 2. Каков физический смысл криоскопической и эбуллиоскопической постоянных?
3. Как можно использовать данные по определению температуры кристаллизации раствора для определения молярной массы растворенного вещества? 4. Каким образом можно использовать данные по определению температуры кристаллизации раствора для обнаружения диссоциации электролитов в водных растворах? 5. В каком из следующих 0,1-моляльных растворов: а) HNO3; б) NaCl; в) C6H12O6; г) CuSO4; д) BaCl2 – изменение температуры кристаллизации будет наибольшим?
Примеры контрольных задач по теме лабораторной работы 1. Раствор, содержащий 2,5 г C6H5OH в 91 г бензола, начинает кристаллизоваться при 3,8 оС. Вычислите криоскопическую постоянную бензола, зная, что чистый бензол кристаллизуется при 5,5 оС. 2. Определите молярную массу спирта, если известно, что раствор, содержащий 0,874 г спирта в 100 г воды, начинает кристаллизоваться при температуре –0,354 оС. 3. При какой температуре замерзает антифриз, состоящий из 9 л воды и 2 л метилового спирта СН3ОН (плотность 0,8 г/см3)? Лабораторная работа №5 ДИССОЦИАЦИЯ ЭЛЕКТРОЛИТОВ Гидроксид Натрия |
| ||||||||||||||||||||||||
|
Гидроксид Алюминия |
| |||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||
Сколько электронов находится на внешнем электронном уровне ионов Mg2+, АI2+ и атома кремния в степени окисления +IV? В прямой или обратной зависимости находится усиление кислотных свойств гидроксидов от увеличения заряда ионов (степени окисления атомов), гидроксиды которых рассматриваются?
Радиусы ионов Mg2+, Аl3+ и атома кремния в степени окисления +IV соответственно равны (по Полингу) 0,065; 0,050 и 0,041 нм. Как влияет изменение радиусов ионов на характер химических свойств гидроксидов?
Составить вторую таблицу, относящуюся к диссоциации гидроксидов магния, никеля и цинка, когда ионы элементов имеют одинаковые заряды и близкие радиусы.
| Ион | Радиус иона, нм | Внешняя электронная оболочка иона | Химические свойства гидроксида | Схема полной диссоциации |
| Mg2+ | 0,065 | |||
| Ni2+ | 0,069 | |||
| Zn2+ | 0,071 |
Какое влияние оказывает внешняя оболочка ионов на характер диссоциации гидроксидов, если известно, что Mg(OH)2 - более сильное основание, чем Ni(OH)2?
Сделать общий вывод о влиянии радиуса, заряда и внешней электронной оболочки ионов на характер диссоциации гидроксидов.
При написании схем диссоциации амфотерных гидроксидов учесть, что в щелочных водных растворах они переходят в комплексные гидроксоионы. Например, схема диссоциации амфотерного гидроксида цинка записывается следующим образом:
2ОН- + [Zn(H2O)4]2+ ↔ Zn (ОН)2+ 4H2O ↔ [Zn (ОН)4]2– + 2Н3O+ + 2H2O
в кислой в щелочной
среде среде
Написать уравнения растворения Zn(ОН)2 и Аl(ОН)3 в кислоте и щелочи.
Реакции ионного обмена
а) Получение сульфида свинца из сульфата свинца
Выполнение опыта. В пробирку внести 2 капли раствора нитрата свинца и прибавить туда же 3 капли раствора сульфата натрия.
Осадок какого цвета образовался? Написать ионной уравнение реакции.
Дать осадку отстояться и кусочком фильтровальной бумаги, свернутым трубочкой, отобрать жидкую фазу. К осадку добавить 3-4 капли сульфида аммония и перемешать осадок стеклянной палочкой.
|
|
Как изменился цвет осадка? Какое вещество образовалось?
Запись результатов опыта. Описать наблюдаемые явления. Ответить на поставленные вопросы. Написать выражения произведений растворимости полученных малорастворимых солей и их числовые значения (см. Приложение, табл. Х.Х). Объяснить переход одного осадка в другой.
б) Гидролиз солей. Реакция среды в растворах различных солей.
В шесть пробирок налить на 1/3 объема дистиллированной воды, добавить 2-3 капли раствора лакмуса. Одну пробирку оставить в качестве контрольной. В остальные внести по одному микрошпателю кристаллов следующих солей: в первую – ацетата натрия, во вторую – хлорида алюминия, в третью – карбоната натрия, в четвертую – сульфита натрия, в пятую – хлорида калия. Растворы перемешать стеклянной палочкой, которую надо промывать дистиллированной водой при смене одной пробирки на другую.
По окраске лакмуса сделать вывод о реакции среды в растворе каждой соли.
НАПРАВЛЕНИЕ ПРОТЕКАНИЯ ОВР
Активность окислителя или восстановителя оценивают при помощи величины электродного потенциала полуреакции φ, который можно измерить или рассчитать (подробнее об этом в следующей лекции). В справочниках приводят величины стандартных электродных потенциалов полуреакций (при 298 К и активности окисленной и восстановленной формы 1 моль/дмз). Сравним два типичных окислителя MnO4─ и Cr2O72─ по величинам их стандартных потенциалов:
MnO4─ + 8 H+ + 5 ē ↔ Mn+2 + 4 H2O, φо= 1,5 В;
Cr2O72─ + 14 H+ + 6 ē ↔ 2 Cr3+ + 7 H2O; φо = 1,3 В.
Поскольку потенциал первой полуреакции выше, то MnO4 ─ является более сильным окислителем, чем Cr2O72 ─ .
ОВР может протекать самопроизвольно, если ее ЭДС, т.е. разность потенциалов полуреакций восстановления и окисления, положительна:
Е = φвос - φок > 0.
Величина ЭДС связана с термодинамическими функциями:
Δ G = - nFE; nFE = RT lnK,
где n-число электронов, принимаемых окислителем; К - константа
равновесия обратимой ОВР, F - постоянная Фарадея.
Для участника ОВР окислительно-восстановительный эквивалент рассчитывают по формуле Э = 1/n, тогда mэ = М/n.
Задача. Возможно ли окисление ионов Cl- и I- при помощи ионов Fe3+?
В справочнике находим потенциалы полуреакций:
Fe3+ + ē ↔ Fe2+, φо = 0,77 В;
2 Cl─ - 2 ē ↔ Cl2, φо = 1,36 В;
2 I─ - 2 ē ↔ I2, φо = 0,54 В.
Составляем уравнения предполагаемых ОВР и рассчитываем их ЭДС:
|
|
1) 2 Cl─ + 2 Fe3+ = Cl2 + 2 Fe2+, Е1 = 0,77 - 1,36 = - 0,59 В;
2) 2 I ─ + 2 Fe 3+ = I 2 + 2 Fe 2+, Е2 = 0,77 - 0,54 = + 0,24 В.
Первая реакция невозможна, а 2-я протекает самопроизвольно.
Примеры уравнений ОВР:
FeS2 + HNO3 → Fe2(SO4)3 + H2SO4 + NO...

 2 1 FeS2 + 8 H2O - 15 ē = Fe3+ + 2 SO42─ + 16 H+
2 1 FeS2 + 8 H2O - 15 ē = Fe3+ + 2 SO42─ + 16 H+
10 5 NO3─ + 4 H+ + 3 ē = NO + 2 H2O.
2 FeS2 + 10 HNO3 = Fe2(SO4)3 + H2SO4 + 10 NO + 4 H2O.
При выборе продуктов восстановления для ОВР с участием HNO3 полезно руководствоваться схемой:
HNO3 → NO2 → НNO2 → NO → N2O → N2 → NH3 (NH4NO3) рост активности восстановителя уменьшение [HNO3] и Т →
Взаимодействие алюминия с разбавленной азотной кислотой:
Al + HNO3 → Al(NO3)3 + NH4NO3 +...
 8 Al ─ 3 ē = Al3+
8 Al ─ 3 ē = Al3+
3 NO3─ + 10 H+ + 8 ē = NH4+ + 3 H2O.
8 Al + 30 HNO3 6 = 8 Al(NO3)3 + 3 NH4NO3 + 9 H2O.
Здесь HNO3 расходуется не только на окисление, но и на солеобразование.
Окисление сахарозы кислым раствором перманганата калия:
C12H22O11 + KMnO4 + H2SO4 → MnSO4 + CO2 + H2O...
 5 C12H22O11 + 13 H2O - 48 ē = 12 CO2 + 48 H+
5 C12H22O11 + 13 H2O - 48 ē = 12 CO2 + 48 H+
48 MnO4─ + 8 H+ +5 ē = Mn+2 + 4 H2O,
5C12H22O11 + 48KMnO4 + 72H2SO4 = 48MnSO4 + 60CO2 + 127H2O + 24K2SO4.
Взаимодействие MoS2 со щелочным раствором NaClO
 MoS2 + NaClO + NaOH → Na2MoO4 + NaCl + Na2SO4...
1 MoS2 + 24 OH─ - 18 ē = MoO42─ + 2 SO42─
9 ClO─ + H2O + 2 ē = Cl─ + 2 OH─
MoS2 + 9NaClO + 6NaOH + 9H2O = Na2MoO4 + 9NaCl + 2Na2SO4. MoS2 + NaClO + NaOH → Na2MoO4 + NaCl + Na2SO4...
1 MoS2 + 24 OH─ - 18 ē = MoO42─ + 2 SO42─
9 ClO─ + H2O + 2 ē = Cl─ + 2 OH─
MoS2 + 9NaClO + 6NaOH + 9H2O = Na2MoO4 + 9NaCl + 2Na2SO4.
|
Лабораторная работа №6
|
|
ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Лабораторная работа №6а
«Электрохимические процессы»
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Глинка Н.Л. Общая химия: Учеб. пособие для вузов. – 23-е изд. – Л.: Химия, 1984. – 704 с.
2. Фролов В.В. Химия: Учеб. пособие для машиностроит. спец. вузов. – 3-е изд. – М.: Высш. шк., 1986. – 543 с.
3. Васильева З.Г., Грановская А.А., Таперова А.А. Лабораторные работы по общей и неорганической химии: Учеб. пособие для вузов. – 2-е изд. – Л.: Химия, 1986. – 288 с.
4. Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. – М.: Химия, 1993. – 592 с.
5. Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ. – М.: Химия, 1997. – 480 с.
6. Неорганическая химия. Химия элементов: Учебник в 2-х тт. / Ю.Д. Третьяков, Л.И. Мартыненко, А.Н. Григорьев, А.Ю. Цивадзе. – М.: Изд-во МГУ, Академкнига, 2007.
ПРИЛОЖЕНИЕ
Таблица П. 1
Стандартные электродные потенциалы
| Ме | Электродная реакция | 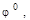 В В
| Ме | Электродная реакция |  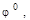 В В
|
| Li | Li+ + e «Li | – 3,04 | Cr | Cr3+ +3e «Cr | – 0,74 |
| Rb | Rb+ + e «Rb | – 2,99 | Fe | Fe2+ +2e «Fe | – 0,44 |
| Cs | Cs+ + e «Cs | – 2,93 | Cd | Cd2+ +2e «Cd | – 0,40 |
| K | K+ + e «K | – 2,92 | In | In3+ +3e «In | – 0,34 |
| Ba | Ba2+ + 2e «Ba | – 2,90 | Tl | Tl+ +e «Tl | – 0,33 |
| Sr | Sr2+ + 2e «Sr | – 2,89 | Co | Co2+ +2e «Co | – 0,28 |
| Ca | Ca2+ + 2e «Ca | – 2,87 | Ni | Ni2+ +2e «Ni | – 0,25 |
| Na | Na+ + e «Na | – 2,71 | Sn | Sn2+ +2e «Sn | – 0,14 |
| La | La3+ + 3e «La | – 2,52 | Pb | Pb2+ +2e «Pb | – 0,13 |
| Mg | Mg2+ + 2e «Mg | – 2,36 | H | 2H+ +2e «H2 | 0,00 |
| Th | Th4+ + 4e «Th | – 1,90 | Ge | Ge2+ +2e «Ge | + 0,01 |
| Be | Be2+ + 2e «Be | – 1,85 | Cu | Cu2+ +2e «Cu | + 0,34 |
| U | U3+ + 3e «U | – 1,79 | Ag | Ag+ +e «Ag | + 0,80 |
| Al | Al3+ + 3e «Al | – 1,66 | Pd | Pd2+ +2e «Pd | + 0,83 |
| Ti | Ti3+ + 3e «Ti | – 1,63 | Hg | Hg2+ +2e «Hg | + 0,85 |
| Zr | Zr4+ + 4e «Zr | – 1,53 | Pt | Pt2+ +2e «Pt | + 1,20 |
| Mn | Mn2+ + 2e «Mn | – 1,18 | Au | Au3+ +3e «Au | + 1,68 |
| Zn | Zn2+ + 2e «Zn | – 0,76 | Pu | Pu3+ +3e «Pu | + 2,03 |
ЛАБОРАТОРНЫЕ РАБОТЫ
ПО КУРСУ «ХИМИЯ»
Учебно-лабораторный журнал
Выполнил:
Тверь 201_
Практическая работа 4
ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ РАСТВОРЕННОГО ВЕЩЕСТВА МЕТОДОМ КРИОСКОПИИ
Раствором называется гомогенная система переменного состава, состоящая из двух или более компонентов (растворитель + одно или несколько растворенных веществ).
Свойства растворов, которые зависят только от концентрации частиц в растворе, но не зависят от их природы, называются коллигативными. К таким свойствам относятся, в частности, понижение давления пара растворителя над раствором, повышение температуры кипения и понижение температуры кристаллизации раствора в сравнении с чистым растворителем.
В данной лабораторной работе понижение температуры кристаллизации раствора по сравнению с температурой кристаллизации чистого растворителя используется для определения молярной массы неизвестного растворенного вещества.
Экспериментальная часть
Реактивы:
водный раствор неизвестного неэлектролита А с массовой долей растворенного вещества 30% (плотность раствора – 1,08 г/см3), дистиллированная вода, лед, поваренная соль.
Оборудование:
прибор для криоскопических исследований (криостат) (рис. 5.4); химический стакан для приготовления исследуемого раствора; кристаллизатор для приготовления охлаждающей смеси; две бюретки (с 30%-ным раствором вещества А и дистиллированной водой); шпатель; секундомер.

Рис. 1. Прибор для криоскопических исследований (криостат):
1 – внутренняя пробирка; 2 – пробка внутренней пробирки; 3 – термометр с ценой деления 0,1 оС; 4 – мешалка для перемешивания раствора; 5 – кольцо мешалки; 6 – наружняя пробирка; 7 – крышка; 8 – стеклянный сосуд с охлаждающей смесью; 9 – мешалка для охлаждающей смеси.
(В некоторых криостатах позиции 4, 5 и 9 могут отсутствовать.)
Ход работы:
1. Приготовьте раствор для исследования. Для этого в химический стакан с помощью бюретки сначала налейте 2 мл 30%-ного раствора вещества А. Затем с помощью другой бюретки внесите в этот же стакан 8 мл дистиллированной воды. (Значения объемов a и b указывает преподаватель.) Полученный раствор тщательно перемешайте.
2. В кристаллизаторе приготовьте охлаждающую смесь из льда и соли. Заполните ею стеклянный сосуд криостата.
3. Внутреннюю пробирку криостата до ~ ½ ее объема заполните приготовленным раствором вещества А. Не пытайтесь залить в пробирку весь приготовленный раствор! Убедитесь, что при погружении пробирки в криостат раствор в ней будет полностью окружен охлаждающей смесью.
4. Поместите пробирку с раствором в охлаждающую смесь и фиксируйте изменение температуры в пробирке через каждые 15 секунд. Осторожно перемешивайте раствор в пробирке мешалкой или (если ее нет) термометром. Старайтесь не повредить термометр!
5. Полученные экспериментальные данные занесите в таблицу (табл. 1).
Таблица 1
Зависимость температуры раствора от продолжительности охлаждения
| τ, с | 15 | 30 | 45 | 60 | 75 | 90 | 105 | 120 |
| t, oС | +5 | 0 | -1,8 | -1,5 | -1,5 | -1,5 | -2,0 | -10 |
Продолжайте измерение температуры до тех пор, пока она не достигнет значения –10 оС. По окончании опыта выньте внутреннюю пробирку из криостата, поместите ее под струю теплой водопроводной воды и дождитесь, пока кристаллы расплавятся. Затем раствор из пробирки можно вылить.
6. По данным таблицы постройте график зависимости температуры раствора от времени его охлаждения t = f(τ) в пределах изменения температур от +5 до –10 оС (точки, выходящие за эти границы, на график не наносите).
7. По графику определите температуру кристаллизации раствора t кр(р-ра). Вычислите понижение температуры кристаллизации раствора в сравнении с чистым растворителем ∆ Т кр.
8. Вычислите массу растворенного вещества и массу растворителя в приготовленном растворе:
m в-ва = V р-ра А · ρ р-ра · ω (А);
m в-ва = a · 1,08 · 0,3 = … г;
m воды = V р-ра А · ρ р-ра · (1 – ω (А)) + V воды · ρ воды;
m воды = а · 1,08 · (1 – 0,3) + b · 1 = … г.
 (5.7)
(5.7)


