
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Правила техники безопасности:. 1.Правила работы с реактивами.
1.Правила работы с реактивами. 2.Правила работы с химической посудой.
Методические указания к выполнению лабораторной работы: Для определения нормальности и титра кислоты необходимо оттитровать кислоту раствором буры. Чтобы определить точку эквивалентности, при титровании необходимо воспользоваться индикаторами. Индикаторами называются вещества, изменяющие свою окраску при изменении реакции среды. Индикаторы в большинстве случаев слабые органические кислоты или основания. Химическая реакция: Na2B4O7 + 7H2O = 2NaOH + 4H3ВO3 2NaOH + 2HCl = 2NaCl + 2H2O Na2B4O7 + 2HCl +5H2O = 2NaCl + 4H3ВO3
Ход работы: 1. В подготовленную бюретку наливаем раствор соляной кислоты: заполняем кончик бюретки и доводим до нуля. 2. В коническую колбу пипеткой отмеряем точный объем, приготовленного раствора буры, несколько капель метилоранжа. Раствор окрасится в желтый цвет. 3. Титруем раствор буры до появления оранжево-розового окрашивания от одной капли раствора. Титрование производим со «свидетелем». 4. Титрование повторяем до получения близких результатов различающихся между собой не более чем на 0,1 мл. 5. Результаты титрования записываем в таблицу. | ||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | |||||||||||||||||||||||
| Разраб. | Лит. | Лист | Листов | ||||||||||||||||||||||||
| Пров. | |||||||||||||||||||||||||||
| Н. контр. | |||||||||||||||||||||||||||
| Утв. | |||||||||||||||||||||||||||
6. По среднему арифметическому находим объем. В Vсреднее брать близкое по значению величины: Vср.(HCl) = За счет накопления ортоборной кислоты РН меньше 7. Данные титрования заносим в таблицу 1: Таблица 1
Расчет: По данным титрования рассчитываем нормальность соляной кислоты (2), титр (3) и поправочный коэффициент (4).
1)
3)THCl = Контрольные вопросы
1. Что называется титрованием? 2. Какая необходима посуда при титровании? 3. Как заполняются бюретки, пипетки, какие требования необходимо соблюдать? 4. Как выбирается индикатор для работы для работы при титровании?
5. Для чего применяется индикатор? В чем суть теории индикаторов? 6. Что называется скачком титрования, какой предел титрования растворов? 7. Химическая реакция, протекающая при титровании раствора HCl бурой. 8. Почему данный метод титрования называется методом нейтрализации? 9. Какая формула связывает любой процесс титрования? 10. Какой закон положен в основу количественного анализа? 11. Расчетные формулы нормальности, титра, фактора пересчета. 12. Что такое РН раствора и какова его роль при титровании по данному методу. 13. Дайте описание работы по условию титра раствора 0,1н HCl. 14. Техника безопасности при выполнении этой работы. 15. Суть прямого титрования. Как определяется метод титрования? | |||||||||||||||||||||||||||
| Лист | |||||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | |||||||||||||||||||||||
|
Лабораторная работа № 19
|
|||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 85; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.219.217 (0.006 с.) |
|||||||||||||||||||||||||||
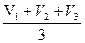
 2) NHCl =
2) NHCl = 
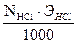 4) KHCl =
4) KHCl = 



