
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теоретические основы метода ИК-спетроскопииСтр 1 из 9Следующая ⇒
Оглавление
Введение В связи с расширением медицинской и фармацевтической промышленности, внедрение в неё компьютерных и машинных технологий, науке необходимы новые и точные методы анализа биологических компонентов. Большое значение в любых лабораторных химических исследованиях занимают методы аналитической химии, в которых немалую роль в анализе и идентификации биологически активных веществ играют физико-химические методы, а в частности спектроскопические. Спектроскопия – один из наиболее часто применяемых методов в физике и аналитической химии. Спектроскопия – это раздел физики, посвященный изучению спектров электромагнитного излучения, включающий в себя методы количественного и качественного анализа, основанные на взаимодействии света с живой и неживой материей [1]. По изменению интенсивности потока электромагнитного излучения становится возможным обнаружить органические вещества сложной структуры, что особенно необходимо при изучении биологически активных компонентов живого организма. Само электромагнитное излучение, применяемое в приборах спектроскопии, представляет собой волны, распространяющееся с огромной скоростью в свободном пространстве, и характеризуется длиной волны и частотой. По областям применения спектроскопия бывает: ИК-спектроскопия, УФ-спектроскопия, атомно-абсорбционная, атомно-эмиссионная и т.д.. В данной работе мы остановимся только на применении методов ИК-спектроскопии к анализу биологически-активных веществ. Цель: узнать о методе инфракрасной спектроскопии, о том, что представляет собой устройство прибора спектрометра и каково его применение, а анализе биологически-активных веществ. Задачи: 1. Теоретические основы метода ИК-спектроскопии 2. структуру, строение и некоторые свойства биологически активных соединений и методы их исследования 3. Узнать спектры поглощения некоторых органических веществ 4. Определение функциональных групп соединений C=O, OH. NH2 Приготовка образцов ГЛАВА 1 Теоретические основы метода ИК-спетроскопии
Область инфракрасного излучения охватывает довольно-таки большой диапазон с λ от 1 мкм до 1 мм. Всю ИК-область можно поделить на три части: ближнюю, среднюю и дальнюю. Инфракрасная область, была открыта в 1800 г У. Гершелем, и легла в основу одного из методов спектроскопии. А применение самого метода для идентификации веществ органической и неорганической природы началось к началу ХХ века.
Благодаря тому, что ИК-спектры дают наиболее точные и легко расширяемые данные по сравнению с УФ-спектрами, метод ИК-спектроскопии на сегодняшний день является одним из самых востребованных. А благодаря модернизации современного оборудования Ик-спектроскопия может применяться не только для обнаружения вещества, но и для количественного определения состава смеси. Одним из наиболее важных определений в данном методе является понятие спектра. Спектр – это порядок энергии электромагнитных колебаний, получаемый при переходе атомов (молекул) из основного состояния в возбуждённое. Однако, та часть спектра, которая воспринимается человеческим глазом, довольно-таки небольшая. Атомы в молекуле находятся в непрерывном колебании, а сама молекула в постоянном вращении. В результате поглощения электромагнитного кванта (ΔE=E2-E1) возможно возбуждение молекулы и переход её с энергетического уровня с меньшей энергией (E1) на уровень с большей энергией (E2). (рис. 1)
Рис. 1. Энергетические состояния молекулы. Следовательно, при поглощении ИК-спектра происходит изменение колебательно-вращательного состояния, и становится возможным увидеть эти изменения на спектре вещества. Каждому соединению принадлежит свойственные только ему полосы поглощения, определённой интенсивности. Как не бывает двух людей с одинаковыми отпечатками пальце, так и не найдётся в природе двух веществ с идентичными спектральными линиями. Метод позволяет качественно оценить наличие функциональных групп, строение молекулы и кратность связи по данным спектра. По интенсивности пиков в спектре вещества становится возможным распознать структуру вещества и отнести его к необходимому классу биологически активных соединений. На сегодняшний день существуют специальные данные, в которых указано, как готовить пробу, регистрировать и расшифровывать спектры. Сущность определение вещества заключается в сравнении спектра, полученного с помощью спектрографа, и эталонного спектра. А для того чтобы снизить погрешность из-за различных условий приготовления проб, очень важно стандартизировать условия регистрации.
Если в спектре не найдено характеристических полос, как в эталоне, то значит это разные соединения. Если же этих полос наоборот слишком много это может говорить, как об загрязнении пробы, так и о том, что это другое вещество. ИК-спектр органических веществ находится в диапазоне 400-4000 см-1, но диапазон лабораторных исследований обычно находится в пределе 100-3500 см-1. Специфичность ИК–спектров заключается в том, что поглощение излучения зависит не только от всей молекулы в целом и наличия в ней определенных групп атомов, но и даже от отдельных связей между атомами. [2] Анализ спектров
В основном любой ИК-спектр состоит из 2 зон: · Выше 1500 см-1, где находятся полосы поглощения функциональных групп · Ниже 1500 см-1 – зона отпечатков пальцев, где располагается бесчисленное количество полос поглощения и описывает молекулу, как целое. На рис. 4 показан ИК-спектр органического соединения с подписанными волновыми числами и соответствующими им функциональными группами.
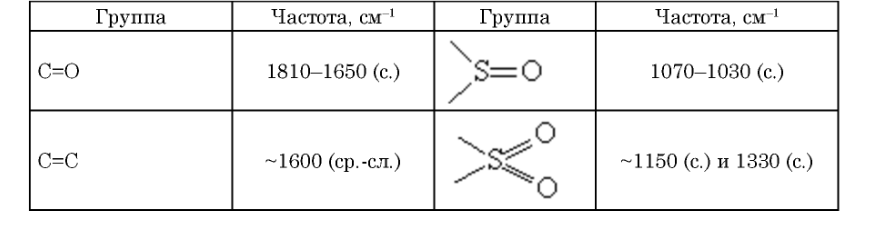
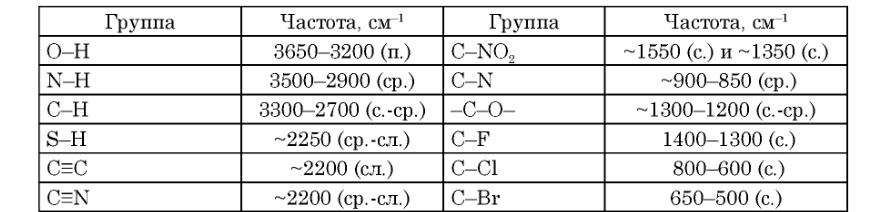
Рис. 4. ИК-спектр органического соединения. Для окончательной расшифровки ИК-спектров пользуются характерностью нормальных частот. То есть существуют такие вещества, которые имеют сходные соединения атомов между собой, поэтому частоты колебаний этих молекул близки. Такие частоты получили название характеристические, а полосы поглощения характеристические полосы. Поэтому анализ спектрограмм во многом сводится к поиску характеристических частот. В таблице 1 изображены частоты часто встречающихся полярных групп атомов. [6]
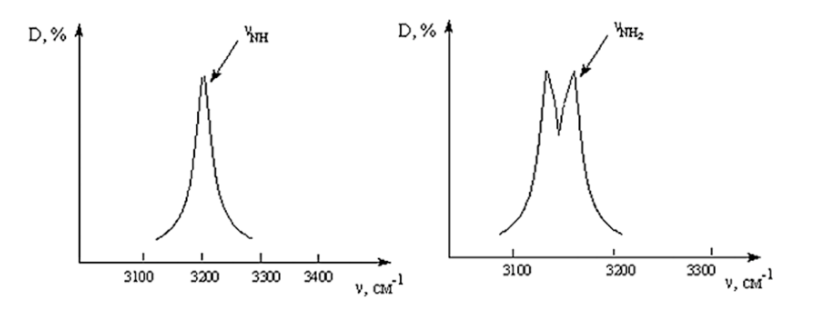
Рис.5. Сигналы ОН группы Часто встречаемые частоты располагаются около возле пика 3600 см-1 – это гидроксогруппы, не образующие водородные связи. Ассоциативные же ОН группы образуют более пологие пики, смещённые влево на 200-400 см-1. · Аминогруппы (рис. 6): Их колебания располагаются чуть левее ОН группы (3100-3200 см-1). Первичные амины показывают два пика (симметричные колебания), а вторичные один (асимметричные колебания).
Принцип ИК-спектроскопии
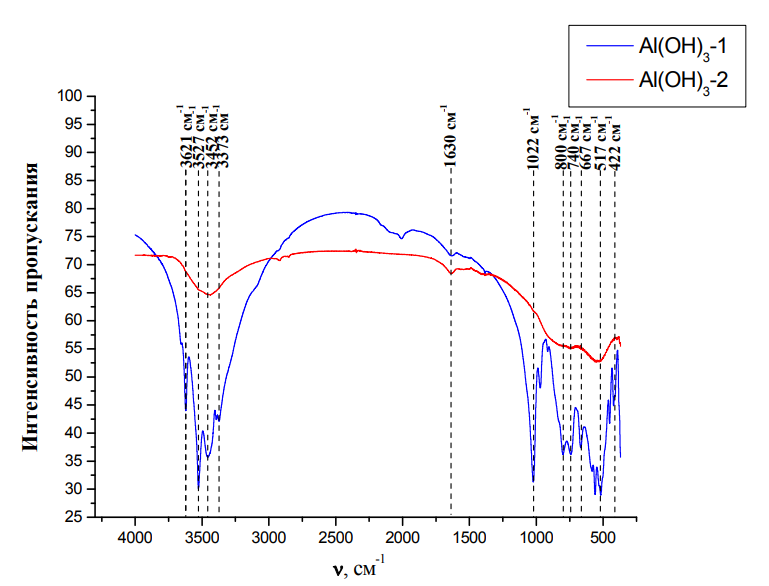
Рис. 6. Сигналы N Н2 и NH групп · Кратные связи. Их интенсивность в спектре зависит от полярности связи. Сильно полярные групп (С=О, S=О, N=О) имеют ярко выраженную интенсивность полос и поэтому их можно с лёгкостью распознать. Слабо полярные связи, состоящие из одних атомов (С=С), имеют неинтенсивные полосы и сложнее определяются в спектре. Очень интенсивные полосы можно встретить на карбоксильных и карбонильных группах. Типичные для νC=О частоты 1700–1750 см–1 у амидов, α, β-непредельных и ароматических карбонильных соединений снижаются до 1630–1660 см–1, а у α-галогензамещенных сложных эфиров, лактонов, виниловых эфиров и ангидридов – наоборот, увеличиваются до 1780–1820 см–1. [6] Рассмотрим спектр Al(OH)3 на рис. 7 (красная линия обозначает тот же образец, после термогравиметрического анализа). В спектре Al(OН)3 – 1 в области валентных колебаний связи водорода с кислородом можно увидеть интенсивные пики. Первый из них при 3621 см-1 показывает атомы, не связанные водородной связью, а второй (около 3400 см-1) указывает на наличие такой связи. Маленькое углубление при 1630 см-1 характеризует деформационные колебания H2О. 1022 – 740 см-1 показывает наличие гидроксогрупп. Следующий промежуток 557-422 см-1 представляет связь Аl-О.
После гравиметрической обработки при температуре до 1100 °С все пики сильно сглаживаются, хотя и не пропадают совсем, что говорит о прежнем нахождении гидроксогрупп.
Рис. 7. Ик-спектр Al (ОН)3 до и после температурной обработки.
Табл. 2. Полосы поглощения различных растворителей
Рис. 8. Зависимость интенсивности поглощения от толщины кюветы. Значит, чем шире стенки кюветы, тем более расплывчатые и пологие пики можно увидеть. Другим фактором является концентрация раствора. При увеличении концентрации уменьшается пропускание. Таким образом, для получения более достоверных результатов необходимо обращать внимание на: природу растворителя, толщину кювет и концентрацию раствора. [7] Принцип Ик-спектроскопии
В промежутке длин волн от 2,5 до 50 мкм (средней ИК-области) происходит возбуждение колебательного движения молекул. Они колеблются с характерными резонансными частотами, размер которых констатируется атомной массой. Частота этих колебаний составляет 109 в секунду. Причём, чем больше атомов находится в молекуле, тем большее число колебаний может происходить. Форма колебаний является особой для каждой молекулы и определяется её строением. В том случае, когда частота излучения совпадает с частотой колебания молекулы, происходит передача энергии от источника к веществу. Таким образом, при проникновении инфракрасного излучения через образец какие-то частоты поглощаются, а какие-то так и проходят через вещество. Поглощаемые частоты совпадают с резонансными, а пропускаемые нет. Если молекула поглощает ИК-спектр, она колеблется более усиленно, из-за увеличения энергии. Через некоторое время она сообщает эту энергию остальным молекулам, что приводит к нагреванию образца.
Также возбуждение молекулы зависит и от дипольного момента. Инфракрасное излучение поглощается в том случае, если происходит взаимодействие дипольного момента молекулы с колеблющимся вектором электромагнитного поля. Это подтверждает активность колебаний при которых изменяется дипольный момент и не активность тех колебаний, которые не изменяют дипольного момента. Молекулы, не обладающие дипольным моментом, не вызывают возбуждение колебаний. Из-за этого становится невозможным получить спектры солей с ионными и ковалентными неполярными связями, металлов и благородных газов. [8] ГЛАВА 2 Рис. 9. Схема устройства диспергирующего спектрометра Источник света расщепляются на два новых луча, благодаря отражению от зеркал. Каждый из лучей имеет одинаковую интенсивность. Первый проходит через кювету с анализируемым веществом, а второй через кювету сравнения, а благодаря прерывателю каждый луч направляется то на одну кювету, то на другую. Отличительной особенностью диспергирующего ИК-спектрометра является наличие монохроматора. Как правило, в качестве монохроматора используются дифракционные решётки, т.е. такие оптические приборы, которые представляют собой множество мелких щелей и непроницаемых промежутков. Как понятно из названия, принцип работы дифракционных решёток основан на явлении дифракции. Детектор представляет собой термопару и бломер. Термопара превращает энергию излучения в тепловую. Бломер – это металл, который меняет своё сопротивление в зависимости от температуры. [9] Спектрометры бывают двух типов: · Однолучевые · Двухлучевые – свет распадается на два пучка. В современных аналитических лабораториях наиболее часто используются двухлучевые ИК-спектрометры. В приборах такого образца есть возможность сразу получать кривую пропускания изучаемого образца. Однолучевой же спектрометр требует снятия двух спектрограмм. Помимо основного спектра поглощения в однолучевом спектрометре необходимо снимать и фоновый спектр, рассчитывать интенсивность по закону Бугера – Ламберта – Бера и строят спектральную кривую – всё это приносит неудобства при интерпретации данных. Применение таких приборов осложняется и поглощением анализируемым веществом паров воды и углекислого газа воздуха. Однако в современных анализа всё чаще применяются недиспергирующие прибор – Фурье-спектрометры. Если диспергирующие устройства основывались на явлении дифракции, то недиспергирующие на явлении интерференции. По этой причине в Фурье-спектрометры вместо монохроматоров входят интерферометры. Различают интерферометры Фабри-Перо, Жамена, Майкельсона, Рэлея Интерферометр Фабри-Перо (рис. 10)
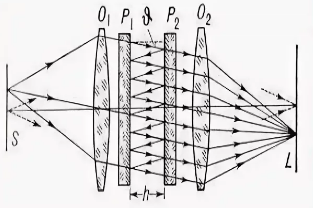
Рис. 10. Схема интерферометра Фабри-Перо Луч излучения от источника S проходит через объектив О1 и бессчётное количество раз отражается от зеркал Р1 м Р2, в результате чего волны становятся когерентными с разностью хода равной 2nh · cosθ, где h – это интервал между Р1 и Р2. Таким образом, на объективе О2 формируется интерференционная картинка в виде колец.
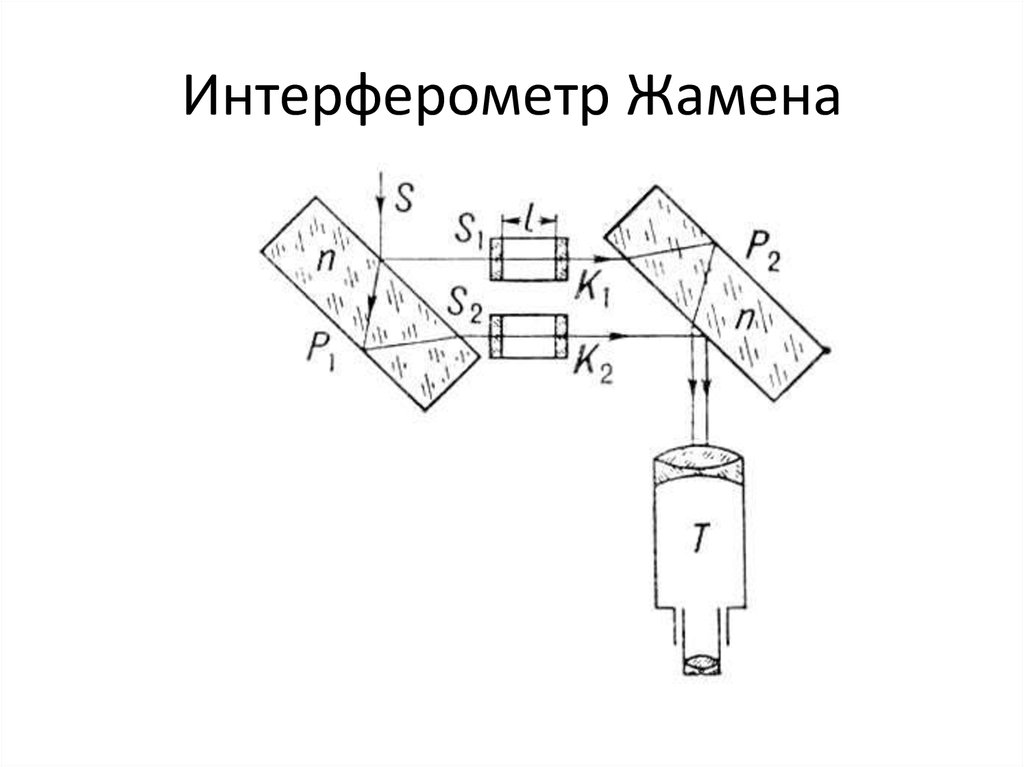
Отличительной особенностью интерферометра Фабри-Перо является его высокая разрешающая способность. Интерферометр Жамена (Рис. 11)
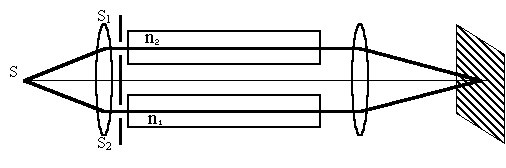
Рис. 11. Схема интерферометра Жамена Луч света S падает на зеркальную пластину Р1 и отражается уже в виде двух лучей S1 и S2, каждый из которых проходит через кювету с анализируемым газом и газом сравнения соответственно. Теперь эти пучки света отражаются от такой же пластины Р2, развёрнутой параллельно Р1. В результате 2 равных по интенсивности пучка проходят через линзу и попадают в зрительную трубу Т, где возникает интерференционная картинка, представляющая собой равные полосы. Достоинством этого прибора является способность измерять в жидком и газовом агрегатном состоянии. Интерферометр Рэлея (Рис. 12) Получение интерференционной картинки таким прибором почти схожа с опытом Юнга.
Рис. 12. Схема интерферометра Рэлея. Свет падает из щели от точечного источника S и проходит через линзу и диафрагму, где исходная волна расходится на 2 плоских пучка, каждый из которых проходит через кюветку с исходным образцом и кювету сравнения. Лучи фокусируются другой линзой на экран, где отображается интерференционная картинка. Рассмотрим схему наиболее известного интерферометра Майкельсона. (рис. 13)
Рис. 13. Интерферометр Майкельсона. Луч 1 от источника излучения попадает на диагонально расположенное полупрозрачное зеркало (светоделитель), затем частично отражается (2), частично проходит сквозь преграду (2’). Луч 2 отражается теперь от другого зеркала М1(3), проходит светоделитель (4) и поступает на фотоприёмник. Аналогично ведёт себя и луч 2’ – отражается от зеркала М2 (3’), затем от светоотделителя (4’) и опять же попадает на фотоприёмник, который регистрирует интерферограмму. То есть сущность интерферометра Мйкельсона в том, что пучок в процессе многократного отражения разлагается на две части, каждая из которых попадает на приёмник. Если лучи окажутся когерентными (волны, имеющие постоянную разность фаз, форму и одинаковую длину), то будет зафиксирована интерференция. Для того чтобы поддерживать нужную разность фаз необходимо передвигать зеркала (Рис. 6 жёлтая стрелка). [10]
Рис. 14. Схема спектрометра с интерферометром Майкельсона. Источник излучения 1 проходит через прерыватель 2, разделяется на два пучка в светоотделите 4. Один из лучей попадает на зеркало 3 интерферирует и отражается от зеркала 5. Линзы 6 фокусируют излучение, прошедшее через кювету 7, на приёмнике 8, который выдаёт график спектра поглощения изучаемого соединения. Несмотря на, казалось бы, сложные преобразования современная техника позволят быстро обрабатывать информацию при помощи компьютерных технологий.
Рис. 15. Интерферограмма К отличительным достоинствам этой техники можно отнести быстроту использования, высокую чувствительность, разрешение и точность измерений. Фурье-спектроскопия более выгодна в энергетическом плане, из-за того, что на приёмник постоянно попадает вся область излучения, а не только её узкая часть, проходящая через монохроматор. Таким образом, в Фурье-спектрометре в каждый момент времени возможно получать полную информацию обо всём составе вещества, а в диспергирующимх устройствах только о той части соединения, на которую попадает излучения, прошедшее через щель в дифракционной решётке. [11]
Рис. 16 Внешний вид спектрометра Nicolet 6700. 1 – выдвижная дверца, 2 – индикаторы состояния, 3 – кнопки для сбора данных, 4 – отсек для светоделителя и дессиканта; 5 –порт для внешнего источника; 6 – вход для внешнего луча; 7 – кюветный отсек; 8 – отделение детектора; 9 – отверстия для заполнения детектора. Чтобы начать работу с прибором необходимо включить его в сеть и подождать 15 минут (а ещё лучше час) пока он разогреется (как правило, для более точных значений, спектрометр не выключают). После включения спектрометра подключают компьютер (следует обратить внимание, что во время выключения идут в обратном направлении – сначала завершает работу компьютер, потом спектрометр). Затем наливают в кювету до метки исследуемое вещество, стараясь не запачкать пальцами стекло, открывают выдвижную дверцу 1 (Рис. 8), и ставят кювету. Рис 17. Внутренне устройство ИК-спектрометра B – источник; D 1 - зеркало осветителя; D 2 - зеркало конденсора; E – кювета; D – монохроматор; F1 - входная щель; F2 - выходная щель; G – приёмник; H - усилитель; I – регистратор. Источником ИК-излучения обычно служит стержень из карбида кремния -глобар, который нагревается свыше тысячи градусов Цельсия, а также штифт Нернста, состоящий из оксидов лантаноидов. Однако в более новых версиях прибора на смену старым источникам пришли лазеры. Источник света проходит через кювету с анализируемым веществом и через раствор сравнения. После прохождения излучения через кювету оно попадает на монохроматор, который представляет собой оптическую систему прибора. Главная его функция – направлять источник излучения по необходимому пути при помощи задания необходимого диапазона раскрытия щели и изменения положения зеркала. Внутри монохроматора располагается зеркало Литтрова и призма. Свет отражается от зеркала и проходит через призму, что способствует его лучшей фокусировке. Оптическая часть прибора должна хорошо пропускать инфракрасные лучи, поэтому изготавливается из соответствующего материала. Это соли галогенидов щелочных и щелочноземельных металлов (CaF2, KBr, CsI, LiF, NaCl). Для интервала 4000-1700 см-1 применяются призмы из LiF. Нижу 1700 см-1 LiF непрозрачен, а выше 4000 см-1 дисперсия его меньше, чем у стекла. Призма из NaCl может быть использована в диапазоне 4000 – 660 см-1. Призмы из KBr применяются в области от 400 до 650 см-1, а призмы из CsI - в области 400-180 см-1 [12]. Различают два типа приёмников: тепловые (бломеры и теплопары) и фотоэлектронные. Первые используют для средней ИК-области, а вторые в более высокой. Таким образом, выбирать приёмник следует, исходя из исследуемого материала. В качестве регистрирующего устройства во многих современных устройствах используют компьютер, оснащенный специальной программой. Рис. 19. Схема спектрометра ИКС-22 Такая оптическая система, в которой одно и то же зеркало выступает как в роли коллиматора, так и объектива получила название автоколлимационной. Как правило, в спектрометрах применяются зеркальные, а не линзовые, что вызвано не только простотой их изготовления, но и тем, что они не обладают хроматической аберрацией. [14] Глава 3 3.1 Пробоподготовка
Способ пробоподготовки выбирают в соответствии с агрегатным состоянием вещества. Сложнее всего снимать спектры из мелкокристаллических сыпучих веществ, т.к. свет неупорядоченно отражается от каждой песчинки, частично преломляется и рассеивается. Чтобы снизить вероятность появления таких нежелательных искажений, свободные полости заполняют жидкостью со схожим показателем преломления. Эти жидкости получили название иммерсионные. Вещества в жидком агрегатном состоянии наносят в виде тонкой плёнки толщиной от 0,005 до 0,1 мм на прозрачные в данной области пластины из хлорида натрия или бромида калия. Также можно снимать спектры и из растворов в узких областях. Для такого метода обычно берутся кюветы из нерастворимых в воде материалов. Из твёрдых веществ делают коллоидный раствор в вазелиновом масле, используемый, как иммерсионное вещество. Твёрдые соединение тщательно перемешивают в ступке, а затем добавляют несколько капель иммерсионной жидкости. Получившуюся суспензию выкладывают на пластины из хлорида натрия или бромида калия и плотно сжимают (следят, чтобы внутри не образовывались пузырьки воздуха). Другим способом исследования твёрдого образца является его прессовка с галогенидом щелочного металла. В результате получается небольшая полупрозрачная таблетка. Такой метод отличается удобством хранения исследуемого вещества и отсутствием мешающих полос поглощения. Однако есть вероятность реакции между таблеткой и атмосферными газами, что приводит к засорению исходного продукта, а в следствии неточным показаниям. Поэтому такой метод лучше применять с нерастворимыми в обычных растворителях веществами, либо образцами имеющим прочную кристаллическую решётку. Глава 4 Витамины
Витамины – низкомолекулярные органические соединения различной химической природы, необходимые для осуществления важнейших процессов, протекающих в живом организме. [15] При этом витамины не участвуют в пластическом и энергетическом обмене. Ещё с древних времён людям было известно, что отсутствие определённых продуктов вызывает заболевания. Однако до 1880 г. никто не предполагал, что в пищевых продуктах содержатся маленькие компоненты, оказывающие большое влияние на организм. Своё название витамины получили от латинского слова vita – жизнь. В настоящее время известно более 30 таких соединений. [16] Для нормального развития человеку необходимо ежедневное поступление 100-120 мг витаминов. На сегодняшний день принято обозначать витамины латинскими буквами: A, B, C, D и т.д.. Классифицируются они на растворимые в воде (B1, B2, B3, B6, B12, H, C, P), растворимые в жирах (A, D, E, K), витаминоподобные вещества (B15, U, ПАБК). [17] Необходимость изучения витаминов вызвана тем, что они влияют практически на все сферы жизни: · Улучшают сопротивляемость заболеваниям · Поддерживают развитие (особенно подрастающего организма) · Способствует усвоению микро- и макроэлементов · Регулируют обмен веществ Ферменты Ферменты – это органические катализаторы белковой природы, которые ускоряют реакции, необходимые для функционирования живых организмов. [18] Благодаря их действию скорости многих реакций проходят в миллион раз быстрее, чем в отсутствие ферментов. Действуя, как катализаторы, они уменьшают энергию активации (энергия необходимая для протекания реакции между веществами), тем самым позволяют взаимодействовать многим важным соединениям. Таким образом, становятся возможны реакции, без дополнительных затрат и повышения температуры. Изначально считалось, что ферменты это небольшие вещества, сорбированные на белках, однако позднее выяснили, что они по своей природе являются белками и делятся на анаболические и катаболические. Первые применяются для синтеза органических веществ, вторые для распада. Как и все белки, ферменты образуют компактные структуры – глобулы. Несмотря на то, что ферменты проявляют свойства присущие всем белкам, они также имеют и специфические особенности: зависимость от интервала температур и pH. Многие ферменты работают только при нормальной температуре человеческого тела. Поэтому во время болезни превышение отметки 37° замедляет обменные процессы, связанные с действием ферментов, и ведёт к гибели. В основном, ферменты проявляют своё действие при pH 7. Изменение этого значения приводит к нарушению соотношения катионильных и анионильных групп. В сильнощелочной и сильнокислой среде ферменты теряют свою активность. На рис. 20 показана активность некоторых ферментов в разных средах.
Рис 20. Зависимость активности ферментов от pH среды. 1 – пепсин, 2 – амилаза, 3 – химотриисин. Имея большой запас ферментов, в клетке возможны реакции распада полимерные веществ до их мономеров: жиров до глицерина и жирных кислот, полисахарид до моносахарид, белков до аминокислот. Огромное значение имело открытие в конце прошлого века рибозим (каталитических РНК), т.к. они могут обеспечивать воспроизведение РНК без деятельности белков-ферментов. В настоящее время открыто более 2000 различных ферментов, которые разделены на 6 классов: · Оксидоредуктазы (цитохромы) – катализируют ОВР · Трансферазы – обеспчивают перенос функциональной группы от одного вещества к другому · Гидролазы (эстеразы и пептидазы) – обеспечивают разрыв связей в молекуле путём гидролиза · Лиазы – предназначены для разрыва связей С-С, С-О, С-N · Изомеразы – обеспечивают изомерные превращения · Лигазы – помогают образовать высокоэнергичные связи [19] Необходимость изучения ферментов вызвана невозможностью в их отсутствие протекания реакций живого организма, следовательно и его существования, а также их применением в пищевой промышленности (в пивоварении, сыроварении) и лекарственных препаратах. Гормоны
Гормон – это вещество органической природы, которое вырабатывается специализированными клетками желез внутренней секреции, поступает в кровь или лимфу и взаимодействует с клетками мишенями, оказывая влияние на метаболический процессы в них. [20] Гормоны являются биорегуляторами, т.е. помогают синхронизировать функции всех органов. Они осуществляют гуморальную регуляцию по принципу обратной связи, т.е. не только гормоны действуют на систему органов, но и само состояние организма влияет на работу желёз. Например, уменьшение C6H12O6 снижает секрецию гормона инсулина поджелудочной железой. Таким образом, именно гормоны поддерживают гомеостаз – постоянство внутренней среды организма. [21] Гормоны также оказывают влияние на синтез генетической информации, в частности действует на образование соответствующей мРНК, которая служит матрицей для формирования новых ферментов. Таким образом, любое заболевания желез внутренней секреции, вызывает сбой в выработке гормонов, что ведёт к неправильному обмену веществ и нарушению синтеза ферментов. По своей химической природе гормоны можно разделить на 3 группы: · Белковые (инсулин, соматропин) – содержат в своём составе большое количество аминокислот · Производные аминокислот (тироксин, адреналин) – содержат в своём составе аминогруппу. ·
· Пептидные (окситоцин, глюкокан, тиреокальцитоин) - представляют собой цепочку соединённых пептидными связями аминокислот Известно, что действие раздражителей возбуждает клетки-рецепторы. Импульсы от них поступают в гипоталамус, где синтезируются первые биологически активные гормоноподобные вещества, они не поступают в кровь, а идут в гипофиз, где выделяются тропные гормоны. Они переносятся через кровь в соответствующие железы внутренней секреции, где вырабатываются сами гормоны. Стоит заметить, что каждые рецептор отвечает за передачу импульса к месту синтеза своего определённого гормона. Например, рецепторы белковых и пептидных гормонов находятся на наружной части клетке, а стероидных во внутренней. [22] Необходимость изучать гормоны вызвана их большой биологической важностью, т.к. они: · Регулируют метаболизма · Регулируют развитие · Обеспечивают адаптацию к окружающей среде · Обеспечивают гомеостаз Также необходимо помнить, что избыток или недостаток гормонов, как и витаминов, приводит к заболеваниям. Рис. 21. ИК-спектр алифатического спирта
· Асимметрические валентные колебания эфирно группы имеют большую интенсивную полосу в области 1150 – 1085 см-1. · У альдегидов и кетонов в области 1725 см-1 находится интенсивная полоса валентных колебаний С=О. Если карбонильная группа сопряжена со связью С=С или ароматической системой, максимум полосы поглощения смещается в низкочастотную область: у ароматических альдегидов от 1715 до 1695 см-1, у алкиларилкетонов 1690 см-1, диарилкетонов 1665 см-1. (Рис. 22)
а)
б) Рис. 22. Ик-спектр а) алифатического, б) ароматического альдегида ·
Рис. 23. ИК-спектр карбоновых кислот. · Нахождение колебаний в спектре аминогруппы определяется агрегатным состоянием вещества, а также наличием водородной связи. В ИК-спектре аминов есть два острых пика при 3500 и 3400 см-1 (Рис. 24), а у вторичных только один. Полосы поглощения алифатических аминов отстают на 300 см-1. Как и гидроксильной группы, при образовании водородной связи, пики амино группы чуть-чуть смещаются в низкочастотную область, однако менее резко, чем у первых. Деформационные колебания это группы находятся при 1650 – 1500 см-1 и 950 – 650 см-1. Полосы поглощения первичных аминов ближе к первому числу, а вторичных к последнему.
Рис. 24. ИК-спектр ароматического амина. · Нитросоединения определяются по двум большим полосами в интервале 1565 – 1545 см-1 и 1385 – 1360 см-1. В ароматических соединениях преимущественно виден пик С-N связи при 870 – 840 см-1. [23]. Рис. 25. ИК-спектр аскорбиновой кислоты в вазелиновом масле
Табл. 3. Частоты полос поглощения аскорбиновой кислоты, снятые в трёх различных городах
1. www.dic.academic.ru/dic.nsf/enc_colier/5689/СПЕКТРОСКОПИЯ 2. Л. С. Сизова. Аналитическая химия. Оптические методы анализа: учебное пособие для студентов вузов. Кемерово 2006. 96 с. [Электронный ресурс] URL: http://biblioclub.ru/index.php?page=book_view_red&book_id=141307&page_id=95 3. Л. Ф. Попова. Инструментальные методы анализа. Практикум по аналитической химии. Архангельск, САФУ, 2004. 206 с [Электронный ресурс] URL: http://biblioclub.ru/index.php?page=book_view_red&book_id=436184 4. Л. Ф. Попова. Инструментальные методы анализа. Практикум по аналитической химии. Архангельск, САФУ, 2004. 206 с [Электронный ресурс] URL: http://biblioclub.ru/index.php?page=book_view_red&book_id=436184 5. Л. С. Сизова. Аналитическая химия. Оптические методы анализа: учебное пособие для студентов вузов. Кемерово 2006. 97 с. [Электронный ресурс] URL: http://biblioclub.ru/index.php?page=book_view_red&book_id=141307&page_id=95 6. Луков, В.В. Физические методы исследования в химии: учебное пособие / В.В. Луков, И.Н. Щербаков. – Ростов-на-Дону: Южный федеральный университет, 2016. – 216 с.: схем., табл., ил. – Режим доступа: по подписке. – URL: http://biblioclub.ru/index.php?page=book&id=461932 (дата обращения: 24.04.2020). – Библиогр. в кн. – ISBN 978-5-9275-2023-7. – Текст: электронный. 71 с. 7. Кириллова, Е.А. Методы спектрального анализа: учебное пособие / Е.А. Кириллова, В.С. Маряхина. – Оренбург: Оренбургский государственный университет, 2013. – 105 с.: табл. – Режим доступа: по подписке. – URL: http://biblioclub.ru/index.php?page=book&id=258856 (дата обращения: 29.04.2020). – Текст: электронный. 32 c. 8. Бёккер, Ю. Спектроскопия: монография / Ю. Бёккер; пер. Л.Н. Казанцева. – Москва: РИЦ Техносфера, 2009. – 528 с. – (Мир химии). – Режим доступа: по подписке. – URL: http://biblioclub.ru/index.php?page=book&id=88994 (дата обращения: 21.04.2020). – ISBN 978-5-94836-220-5. – Текст: электронный. 142 с. 9. https://studopedia.ru/4_17771_izmerenie-analiticheskogo-signala.html 10. Ефимова А. И. Московский государственный университет имени М. В. Ломоносова. Общий физический практикум. Инфракрасная спектроскопия. – URL: https://docviewer.yandex.ru/view/0/?page=1&*=iL3HKUIKnhxbmCJELj3511pMaNN7InVybCI6Imh0dHA6Ly92ZWdhLnBoeXMubXN1LnJ1L2ZpbGVzL3ByYWN0XzExL2lrLnBkZiIsInRpdGxlIjoiaWsucGRmIiwibm9pZnJhbWUiOnRydWUsInVpZCI6IjAiLCJ0cyI6MTU4NzY0NTMxOTA4NywieXUiOiI5MTM1NTk5ODEzNDU3OTg2MzQiLCJzZXJwUGFyYW1zIjoibGFuZz1ydSZ0bT0xNTg3NjQ1MzEwJnRsZD1ydSZuYW1lPWlrLnBkZiZ0ZXh0PSVEMCVCRiVEMSU4MCVEMCVCOCVEMCVCRCVEMSU4NiVEMCVCOCVEMCVCRislRDElODAlRDAlQjAlRDAlQjElRDAlQkUlRDElODIlRDElOEIrJUQxJTgxJUQwJUJGJUQwJUI1JUQwJUJBJUQxJTgyJUQxJTgwJUQwJUJFJUQwJUJDJUQwJUI1JUQxJTgyJUQxJTgwJUQwJUIwKyVEMCVCOCVEMCVCQSVEMSU4MSsyMislRDAlQkIlRDAlQkUlRDAlQkMlRDAlQkUmdXJsPWh0dHAlM0EvL3ZlZ2EucGh5cy5tc3UucnUvZmlsZXMvcHJhY3RfMTEvaWsucGRmJmxyPTE1Jm1pbWU9cGRmJmwxMG49cnUmc2lnbj01OTMxOTM2N2MwNTVhMzY4ZTFmOGNlMDVjZTgyZDVlZSZrZXlubz0wIn0%3D&lang=ru (дата обращения 23. 04. 2020) 8-9 с. 11. https://studwood.ru/1923012/matematika_himiya_fizika/printsipy_ustroystva_deystviya_spektrometrov
12. В. И. Васильева, О. Ф. Стоянова, И. В. Шкутина, С. И. Карпов, В. Ф. Селеменев, В. Н. Семёнов. Спектральные методы анализа. Практическое руководство. Санкт-Петербург, Москва, Краснодар 2014. 231 с. [Электронный ресурс] URL: https://e.lanbook.com/reader/book/50168/#231
13. И. В. Колесник, Н. А. Саполетова. Инфракрасная спектроскопия. Методическая разработка МГУ им. М. В. Ломоносова. Моск
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 328; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.171.121 (0.149 с.) |


 Стоит помнить, что ИК-спектры одного и того же вещества могут различаться в зависимости от растворителя. Это происходит из-за смещения электронной плотности. В таблице 2 приведены полосы поглощения наиболее часто встречающихся растворителей.
Стоит помнить, что ИК-спектры одного и того же вещества могут различаться в зависимости от растворителя. Это происходит из-за смещения электронной плотности. В таблице 2 приведены полосы поглощения наиболее часто встречающихся растворителей.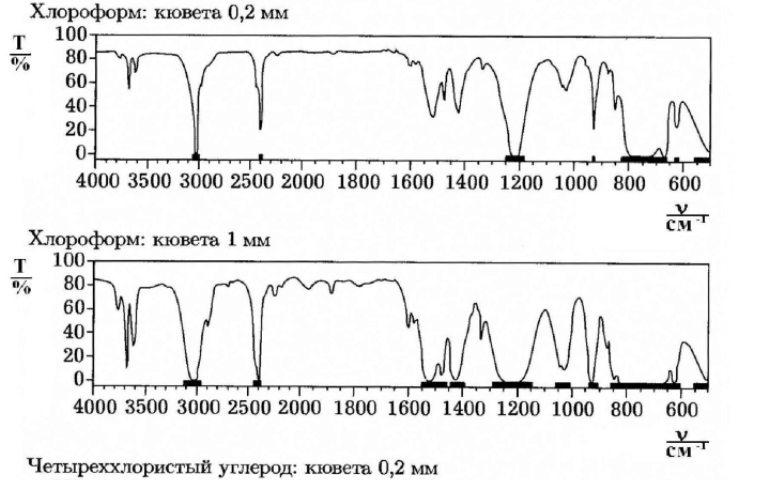 Помимо природы веществ существуют и другие факторы, влияющие на достоверность исследования. Так, например, качество результатов зависит от толщины кюветы. (Рис. 8)
Помимо природы веществ существуют и другие факторы, влияющие на достоверность исследования. Так, например, качество результатов зависит от толщины кюветы. (Рис. 8)
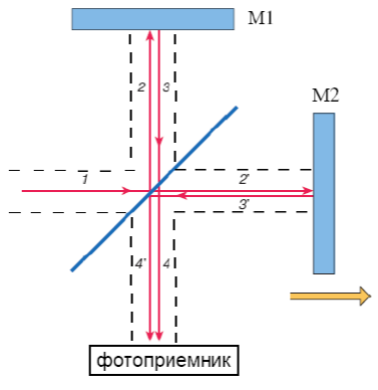
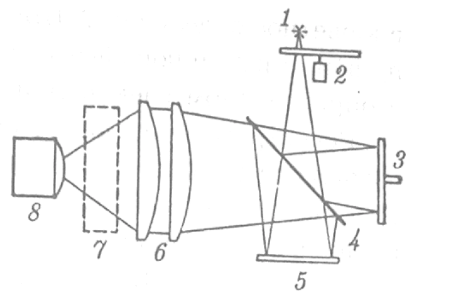 На рисунке 14 представлена схема наиболее встречающегося спектрометра с интерферометром Майкельсона.
На рисунке 14 представлена схема наиболее встречающегося спектрометра с интерферометром Майкельсона.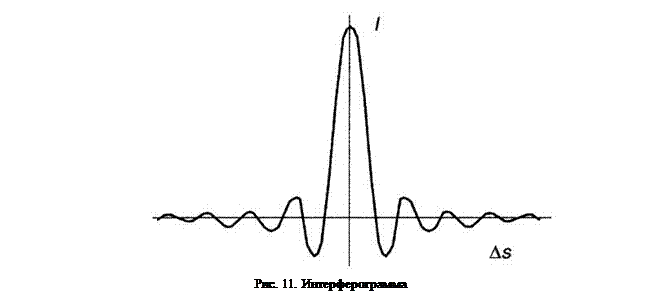 Результирующая интерферограмма выглядит, как зависимость сигнала от разности хода пучков. (Рис. 15). Фурье-преобразование показывает конечный спектр поглощения анализируемого вещества.
Результирующая интерферограмма выглядит, как зависимость сигнала от разности хода пучков. (Рис. 15). Фурье-преобразование показывает конечный спектр поглощения анализируемого вещества.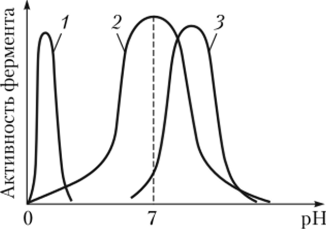
 Стероидные (кортикостерон, андростандиол, тестестерон, эстрадиол, прогестерон). Являются производными стерана
Стероидные (кортикостерон, андростандиол, тестестерон, эстрадиол, прогестерон). Являются производными стерана

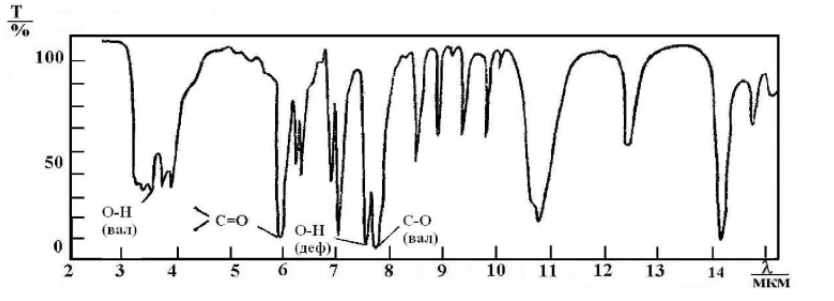 Карбоксильные группы вызывают валентные колебания в области 1900 – 1600 см-1, но на частоту этих колебаний оказывают влияние водородные связи, поэтому карбоновую кислоту также можно отличить по пикам ОН группы. (Рис. 23)
Карбоксильные группы вызывают валентные колебания в области 1900 – 1600 см-1, но на частоту этих колебаний оказывают влияние водородные связи, поэтому карбоновую кислоту также можно отличить по пикам ОН группы. (Рис. 23)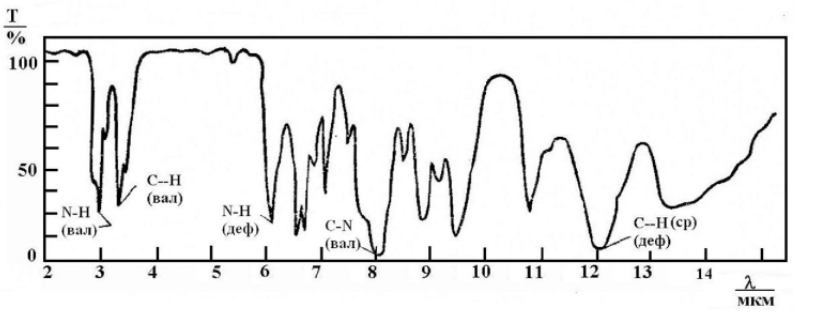
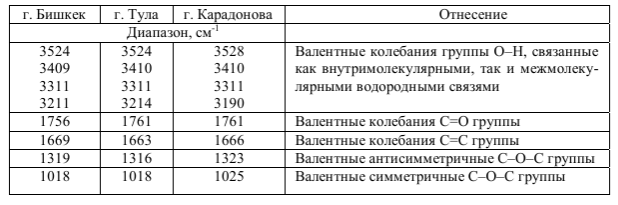 Плато в области 2800 – 3000 см-1 совпадает с валентными колебаниями С-Н. Полосы поглощения вазелинового масла приходятся на 1460 и 1374 см-1. Полосы поглощения соответствующие остальным атомам сведены в таблицу 3. [24]
Плато в области 2800 – 3000 см-1 совпадает с валентными колебаниями С-Н. Полосы поглощения вазелинового масла приходятся на 1460 и 1374 см-1. Полосы поглощения соответствующие остальным атомам сведены в таблицу 3. [24]


