
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методика расчета адиабатической температуры горения
1. Составляем уравнение реакции горения вещества в воздухе (см. правила составления реакции горения в разделе 2). По уравнению реакции находим число моль исходного вещества и выделяющихся продуктов реакции горения. 2. Определяем по табл. 3 приложения 2 значения стандартных теплот образования горючего вещества и продуктов горения. Теплоты образования простых веществ (N2, О2) равны нулю. 3. Используя следствие закона Гесса, рассчитываем низшую теплоту сгорания вещества Qн = S(ni× 4. Рассчитываем количество вещества избытка воздуха по формуле: nв,изб= 4,76 × b × (a - 1), моль. 5. Рассчитываем общее количество вещества продуктов горения: Snпг = 6. Рассчитываем среднее значение энтальпии 1 моль продуктов горения по формуле:
7.Определяем в первом приближении температуру горения, используя данные табл. 4 приложения 2, используя следующие суждения. В продуктах горения наибольшее количество составляет азот, поэтому принимаем, что именно ему соответствует расчётное среднее значение энтальпии (∆Нср). По табл. 4 в колонке азота находим ближайшую к ∆Нср величину и выписываем соответствующее ей значение температуры. В продуктах горения кроме азота присутствуют СО2 и Н2О, что понижает температуру (~ на 100 К). Уменьшаем выбранную температуру на 100 К. Это будет первое приближение температуры горения, при которой ведём расчёт энтальпии продуктов горения. Для этого последовательно находим в табл. 4 мольную энтальпию каждого из продуктов горения и умножаем ее на число моль соответствующего продукта горения. Затем суммируем полученные энтальпии всех продуктов реакции горения. Сравниваем полученное значение с низшей теплотой сгорания вещества. Если суммарное значение энтальпии продуктов горения превышает значение низшей теплоты сгорания вещества, то выбираем второе приближение температуры горения, понижая первую выбранную температуру на 100 К, и повторяем расчёт. Снова сравниваем полученное значение с низшей теплотой сгорания вещества. Таким образом, необходимо найти два значения энтальпии продуктов горения вещества, одно из которых больше значения низшей теплоты сгорания, а другое – меньше. Разница между соответствующими этим энтальпиям температурами не должна превышать 100 К.
Температуру горения находим методом линейной интерполяции.
Задача Рассчитать по следствию закона Гесса низшую теплоту сгорания и адиабатическую температуру горения диэтилового эфира, если коэффициент избытка воздуха составляет 1,3. Дано: С4Н10О – диэтиловый эфир a=1,3 Найти: Qн, Тг? Решение: 1. Составляем уравнение реакции горения диэтилового эфира в воздухе (см. правила составления реакции горения из раздела 2). С4Н10О + 6(О2 + 3,76N2) ® 4СО2 + 5Н2О + 6×3,76N2 b = 6 Таким образом, по уравнению реакции находим, что при сгорании 1 моль диэтилового эфира выделяется 4 моль углекислого газа и 5 моль воды:
2. По табл. 3 приложения 2 определяем значения стандартных теплот образования горючего вещества и продуктов горения:
3. Используя следствие закона Гесса, рассчитываем низшую теплоту сгорания диэтилового эфира, ∆Н0сгор.= S(n× ∆Н0сгор.= ∆Н0сгор.= = 4 × (-393,51) + (5 × -241,84) – 1 ∙ 273,2 = - 2510,95 (кДж/моль); Qн = -∆Н0сгор.= 2510,95кДж/моль 4. Рассчитываем количество моль избытка воздуха. nв.изб= 4,76 × b × (a - 1) = 4,76 × 6 × (1,3 - 1) = 8,57 (моль) 5. Рассчитываем общее количество вещества продуктов горения. Snпг = 6. Рассчитываем среднее значение энтальпии 1 моль продуктов горения.
7. Рассчитываем температуру горения, используя данные табл. 4 приложения 2. В продуктах горения наибольшее количество составляет N2 (6∙3,76 = 22,56 моль), поэтому принимаем, что именно ему соответствует расчётное среднее значение энтальпии (62,55 кДж/моль). По таблице в колонке азота находим ближайшее к 62,55 кДж/моль значение, равное 63,143 кДж/моль. Ему соответствует температура горения 2173 К. Так как в продуктах горения кроме азота присутствуют СО2 и Н2О, то понижаем температуру ~ на 100 К и выбираем температуру 2073 К, при которой ведём расчёт. Находим в табл. 4 приложения 2 мольные энтальпии каждого продукта горения и умножаем их на соответствующее количество вещества. Тг,1 = 2073 К
S
Сравниваем полученное значение с низшей теплотой сгорания диэтилового эфира: Qн = 2510,04 кДж/моль < S В процессе горения суммарное значение энтальпии продуктов горения не может превышать значение низшей теплоты сгорания диэтилового эфира. Поэтому понижаем температуру еще на 100 К и повторяем расчёт. Тесты для самоконтроля
1. В зависимости от механизма распространения зоны химической реакции горения по горючей смеси выделяют следующие режимы горения: a. дефлаграционное и детонационное; b. ламинарное и турбулентное; c. диффузионное и кинетическое.
2. Какие из ниже перечисленных продуктов горения являются продуктами полного сгорания: a. СО2; b. N Н3; c. Н Cl; d. Н2О; e. СО.
3. Укажите, какие из представленных ниже уравнений реакции горения веществ являются верными: a. С2Н5 N + 6,25 О2 + 6,25 ´ 3,76 N 2 ® 7СО2 + 2,5 Н2О + 6,25 ´ 3,76 N 2; b. С2Н3 Cl + 2,5 О2 + 2,5 ´ 3,76 N 2 ® 2СО2 + Н2О + HCl +2,5 ´ 3,76 N 2; c. С4Н10О + 6 О2 + 6 ´ 3,76 N 2 ® 4СО2 + 5 Н2О + 6 ´ 3,76 N 2.
4. Как называются вещества, состав которых можно выразить химической формулой? a. простые вещества; b. индивидуальные химические соединения; c. сложные вещества.
5. Горение паров, поднимающихся со свободной поверхности жидкости, является: a. гетерогенным; b. гомогенным.
6. Если коэффициент горючести бутанола равен 24, то это вещество: a. трудногорючее; b. горючее; c. не горючее.
7. По газодинамическому состоянию компонентов горючей смеси горение подразделяется на: a. полное и неполное; b. ламинарное и турбулентное; c. гомогенное и гетерогенное. 8. Для возникновения горения необходимы следующие условия: a. наличие горючего вещества, окислителя и флегматизатора; b. наличие источника зажигания и горючего вещества; c. наличие горючего вещества, источника зажигания и окислителя.
9. Какие из ниже перечисленных факторов влияют на температуру горения: a. полнота сгорания; b. величина избытка воздуха; c. объем сосуда; d. начальная температура горючего вещества и воздуха; e. скорость химической реакции.
10. С помощью какого прибора определяется температура горения? a. прибор МакHИИ; b. прибор Маккея; c. СТС-2; d. ОППИР-017; e. ПВHЭ. 11. Какая температура называется температурой внутреннего пожара: a. максимальная температура дыма в помещении, где происходит пожар; b. минимальная температура дыма в помещении, где происходит пожар; c. средняя температура зоны горения в помещении, где происходит пожар; d. максимальная температура зоны горения в помещении, где происходит пожар; e. средняя температура дыма в помещении, где происходит пожар.
12. Какая температура называется температурой наружного пожара: a. температура дыма; b. температура пламени; c. температура продуктов горения; d. температура окислителя; e. температура горючего вещества. 13. Коэффициент горючести вещества равен 1. Данное вещество является: a. горючим; b. негорючим; c. трудногорючим. 14. Какие различают температуры горения? a. оптическую, теоретическую, действительную; b. тепловую, теоретическую, действительную; c. калориметрическую, теоретическую, действительную; d. отопительную, теоретическую, действительную;
e. цепную, теоретическую, действительную.
15. Как называется коэффициент "К". a. коэффициент дымообразования; b. коэффициент горючести; c. коэффициент теплопроводности; d. коэффициент теплопередачи; e. стехиометрический коэффициент.
|
|||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 339; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.163.58 (0.023 с.) |
 )пг- S(nj×
)пг- S(nj× 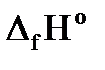 )г.в, кДж/моль.
)г.в, кДж/моль. , моль.
, моль.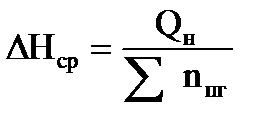 , кДж/моль
, кДж/моль ,
,  ,
, 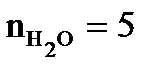
 = 273,31 кДж/моль;
= 273,31 кДж/моль;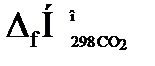 = -393,51 кДж/моль;
= -393,51 кДж/моль; = -241,84 кДж/моль
= -241,84 кДж/моль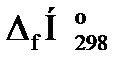 )п.г- S(n×
)п.г- S(n×  )г.в, кДж/моль;
)г.в, кДж/моль;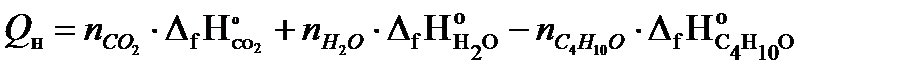 , кДж/моль;
, кДж/моль;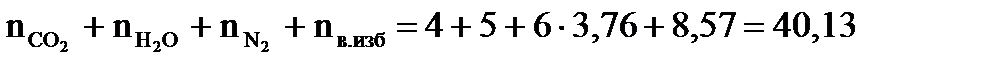 (моль)
(моль) , кДж/моль;
, кДж/моль; = 62,55 (кДж/моль)
= 62,55 (кДж/моль) = 4 × 96,58 = 386,32 (кДж/моль)
= 4 × 96,58 = 386,32 (кДж/моль) = 5 × 77,6 = 388 (кДж/моль)
= 5 × 77,6 = 388 (кДж/моль) = 22,56 × 59,54 = 1343,22 (кДж/моль)
= 22,56 × 59,54 = 1343,22 (кДж/моль) = 8,57 × 60 = 514,2 (кДж/моль)
= 8,57 × 60 = 514,2 (кДж/моль) = 2631,74 кДж/моль
= 2631,74 кДж/моль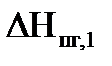 = 2631,74 кДж/моль.
= 2631,74 кДж/моль.


