Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
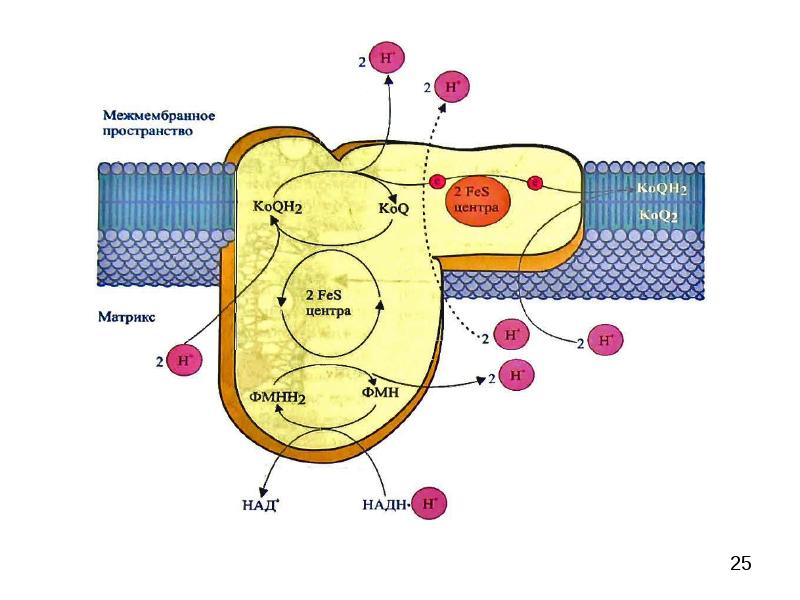
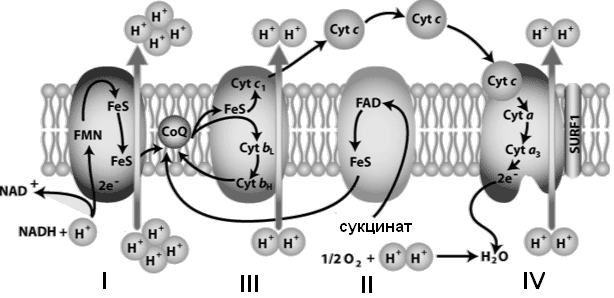
Строение внутренней мембраны митохондрий ⇐ ПредыдущаяСтр 4 из 4
(цепь переноса электронов)
-0,42В 2Н+ S Н 2 + НАД+ → НАД Н•Н+ + S
Железо-серный белок
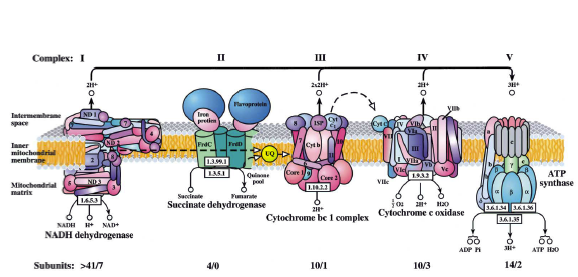
Названия дыхательных комплексов:
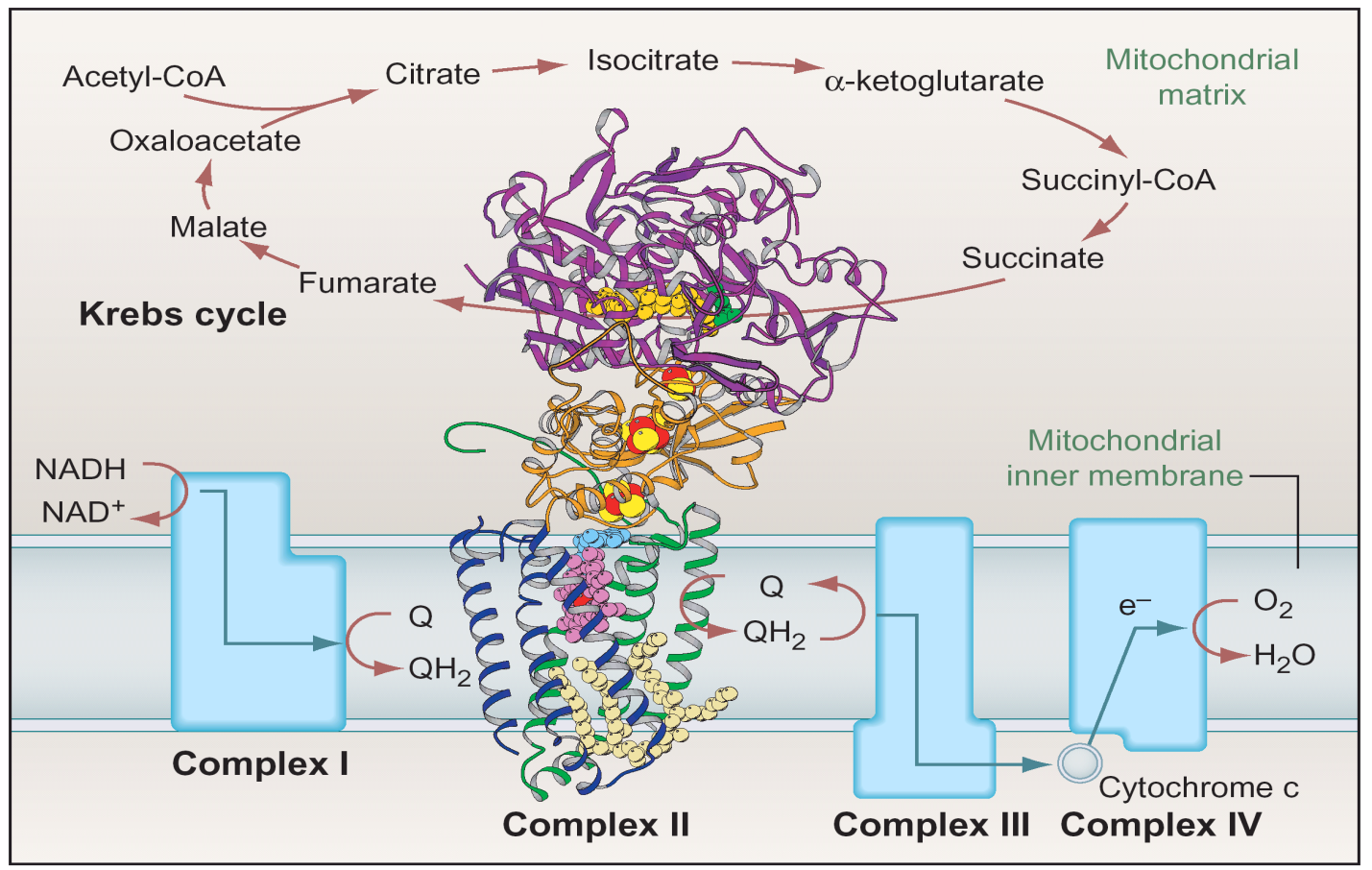
I комплекс – НАДН•Н+- убихинон-оксидоредуктаза – катализирует перенос электронов от НАДН к убихинону (КоQ); II комплекс – сукцинат- убихинон-оксидоредуктаза – катализирует перенос электронов от сукцината к убихинону (КоQ); III комплекс – убихинол-цитохром с -оксидоредуктаза – катализирует перенос электронов от КоQН2 к цитохрому с; IV комплекс – цитохром с -О2-оксидаза – катализирует перенос электронов от цитохрома с к кислороду; V комплекс – АТФ-синтаза (синтез АТФ). Важная роль в передаче электронов от одного комплекса принадлежит КоQ и цитохрому с. Цитохром с является единственным растворимым цитохромом и наряду с коэнзимом Q служит мобильным элементов дыхательной цепи, осуществляя связб межу фиксированными в мембране комплексами. I КОМПЛЕКС – НАДН•Н+- УБИХИНОН-ОКСИДОРЕДУКТАЗА (или НАДН-дегидрогеназа) Это сложный, пронизывающий мембрану полиферментный комплекс, состоящий из 42 полипептидных цепей, обладающий большой молекулярной массой (700 – 900 кДа). Содержит более 30 различных белков, коферментом которых является ФМН. В состав I комплекса входят также 5 железо-серных белков (содержат 20 атомов негеминового железа и 20 атомов серы), содержащие от 7 до 9 FeS-центров (кластеров). По форме комплекс I напоминает английскую букву «L». Комплекс находится в окружении липидов, активный центр обращен в матрикс митохондрий. Комплекс I катализирует 2 сопряженных процесса: 1) экзергонический транспорт электронов к убихинону гидрид-иона от НАДН и протона из матрикса: НАДН•Н+ + КоQ → НАД+ + КоQН2;
2) эндергонический перенос 4-х протонов из матрикса в межмембранное пространство. Комплекс I катализирует перенос гидрид-иона от НАДН к ФМН, от которго 2 е- движутся через ряд FeS-центров к FeS-белку, находящемуся на матричной стороне внутренней мембраны. От него электроны переносятся к КоQ на мембранной части комплекса с образованием восстановленной молекулы КоQН2. Движение протонов в межмембранное пространство приводит к образованию электрохимического потенциала на внутренней мембране митохондрий, который накапливает энергию, высвобождаемую при переносе электронов. При этом наружная сторона внутренней мембраны, обращенная в межмембранное пространство, заряжается положительно, а сторона, обращенная к матриксу – отрицательно. Строение комплекса I дыхательной цепи.
С помощью электронной микроскопии установлено, что I комплекс состоит из 2-х частей, L-формы. Гидрофобный горизонтальный фрагмент находится в толще липидного слоя и содержит субъединицы, которые кодируются митохондриальной ДНК. Вертикальный фрагмент содержит периферические мембранные белки и обращен к матриксу митохондрий. НАДН связывается с вертикальным фрагментом и переносит электроны на ФМН. Затем электроны перемещаются внутри вертикального фрагмента через три FeS-центра (4Fe4S) на прочно связанный КоQ вертикального фрагмента. Пара электронов от КоQ переносится на 2Fe2S-центры и на мобильный КоQ гидрофобного слоя мембраны.
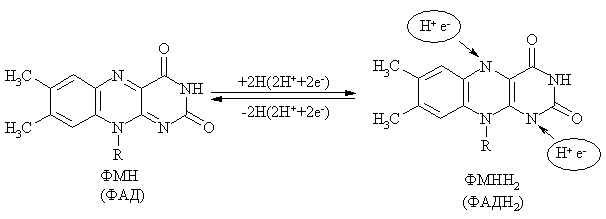
ФМН способен восстанавливаться, присоединяя 2 атома водорода (т.е. 2 протона и 2 электрона), отдаваемых НАДН-зависимыми дегидрогеназами матрикса митохондрий. В переносе двух атомов водорода принимают участие 1-й и 10-й атомы азота ФМН.
Железо-серные белки осуществляют разделение потока протонов и электронов, при этом электроны от ФМНН2 переносятся к внутренней поверхности внутренней мембраны митохондрий (обращенной к матриксу), а протоны – к внешней поверхности внутренней мембраны (в межмембранное пространство) и выделяются в межмембранное пространство. Т.о., железо-серные белки – это «ловушки» для электронов. После того, как железо окисляется следующим акцептором, ФМН передает ему второй электрон.
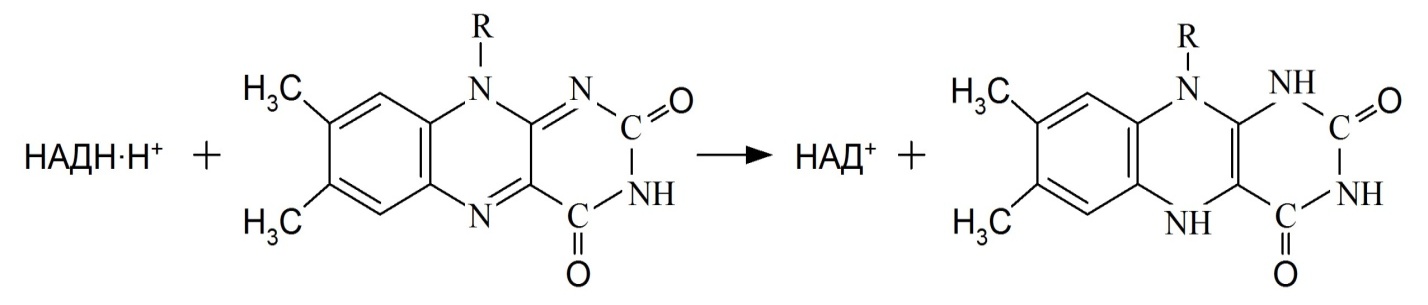
НАДН•Н+ + ФМН → НАД+ + ФМНН2; ФМНН2 + Fe3+ → ФМНН• (семихинон) + Fe2+ + Н+
Комплекс I на каждые два переносимых электрона «закачивает» в межмембранное пространство 4 протона. Механизм этого переноса еще недостаточно изучен. Основной путь переноса электронов: НАДН•Н+ → ФМН → FeS -центры → Ко Q → FeS -белки → Ко Q Н2
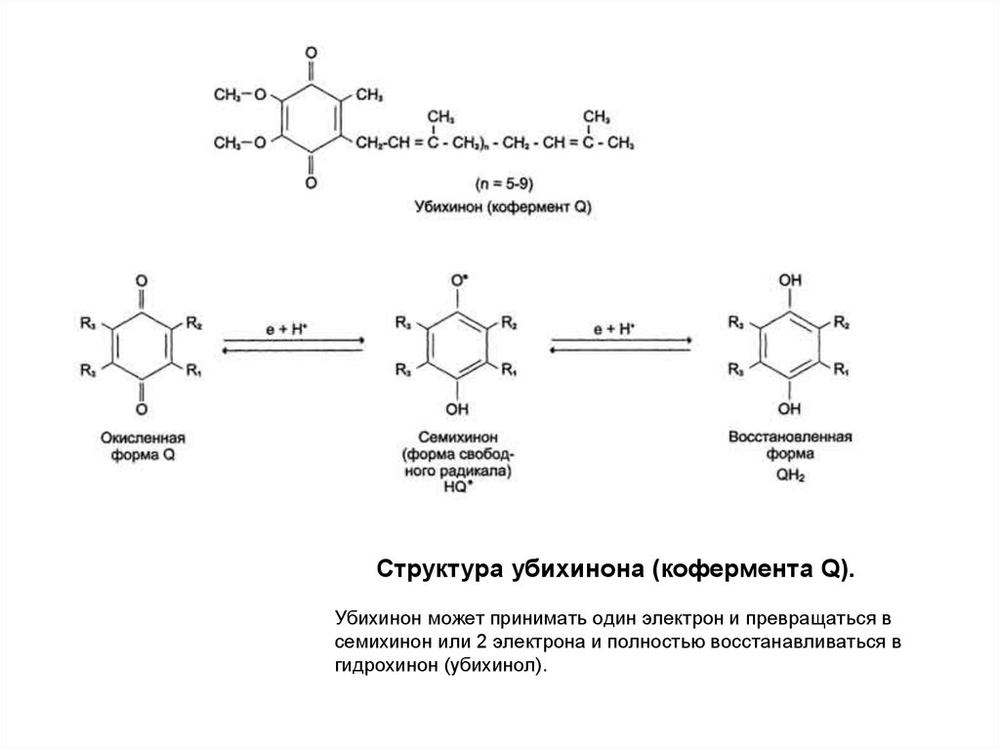
Т.о., комплекс I окисляет НАДН, перенося с него 2 электрона на КоQ и перекачивая 4 протона из матрикса в межмембранное пространство митохондрий. Окисление НАДН•Н+ происходит следующим образом. 1) 2 электронов и 2 протона переносятся с НАДН2 на флавопротеин (комплекс I), который направляет 2 протона (2Н+) в межмембранное пространство, а 2 е- - на FeS-центры дыхательной цепи; 2) с FeS-центров 2 е- передаются далее на убихинон (КоQ), а 2Н+ убихинон захватывает из матрикса, превращаясь в восстановленную форму (КоQН2). Эта пара протонов водорода (2Н+) выталкивается в межмембранное пространство, а электроны далее передаются по дыхательной цепи - на комплекс III (не на II комплекс!). Убихинон (КоQ) может принимать как 1е-, так и 2е-.
Т.о., в результате работы НАДН-дегидрогеназы кофермент НАДН переходит в окисленную форму: НАДН•Н+ + Ко Q → НАД+ + Ко Q Н2
II КОМПЛЕКС ДЫХАТЕЛЬНОЙ ЦЕПИ - СУКЦИНАТ- УБИХИНОН-ОКСИДОРЕДУКТАЗА (или сукцинат-дегидрогеназа)
Комплекс отличается меньшей молекулярной массой – 97 кДа. Состоит из 4-х субъединиц. В состав комплекса также входят железо-серные белки с тремя типами Fe-S-центров: 1) 4Fe-4S; 2) 3Fe-4S; 3) 2Fe-2S С этим комплексом взаимодействуют: 1) сукцинат – поступающий из матрикса митохондрий; 2) жирные кислоты, находящиеся в матриксе митохондрий. Коферментом комплекса является ФАД, который ковалентно связан с комплексом. Первичным акцептором водорода является ФАД: электроны транспортируются от сукцината к ФАД, затем через Fe-S-центры к убихинону. Выталкивание протонов в межмембранное пространство не происходит, т.к. изменения свободной энергии незначительно. Путь, по которому проходят электроны в комплексе:
сукцинат → ФАДН2 → 2 FeS → Ко Q Н2
Комплекс II называют еще флавопротеином 2 (ФП2; ФП1 является комплекс I), т.к. на этом участке ЦПЭ в общий фонд КоQ передают свои электроны другие флавопротеины: 1) ацил-КоА-дегидрогеназа (ФП3), окисляющая активную жирную кислоту – ацил-КоА; 2) глицеролфосфат-3-дегидрогеназа (ФП4), которая окисляет глицерол-3-фосфат, образующийся при распаде ТАГ (триацилглицеролов) или диоксиацетонфосфата при гликолизе. Фермент локализована на наружной стороне внутренней мембраны и передает электроны в дыхательную цепь на. КоQН2 образующийся в результате этих реакций, окисляется комплексом III. КоQ становится, таким образом, своеобразным коллектором всех электронов, поступающих в митохондрию из разных субстратов.
КОМПЛЕКС III – УБИХИНОН-ЦИТОХРОМ С -ОКСИДОРЕДУКТАЗА (или комплекс bc, или QH2-дегидрогеназа) Комплекс III представляет собой олиомерный белок с большой молекулярной массой; это димер, состоящий из 2-х идентичных мономеров, каждый из которых включает 11 субъединиц. Структура мономера. Функциональное ядро состоит из 3 субъединиц: 1) цитохром b с 2-мя геммами (bL и bH);
2) FeS-белок с двумя центрами (2Fe-2S); 3) цитохром c 1 c (содержат гем). Цитохромы различаются по структуре полипептидных цепей. Рабочей частью всех цитохромов является гем, содержащий ион Fe3+, который может принимать электрон и менять свою валентность: + е- → Fe 2+. Гемы цитохрома b имеют различное сродство к электронам из-за различной структуры полипептдной цепи, которая их окружает. Гем bL локализован возле цитозольной стороны внутренней мембраны митохондрий, имеет низкое сродство к электрону по сравнению с гемом bH, который находится в мембране со стороны матрикса. Функциональная единица. Цитохром c 1 и FeS-белок защищены от Р-стороны (внешняя сторона внутренней мембраны) и взаимодействуют с цитохром c (не является частью функционального комплекса) в межмембранном пространстве. Комплекс имеет два различных центра для связывания убихинона – QN и QP, которые являются сайтами действия ингибиторов окислительного фосфорилирования (действие дыхательных ядов). Взаимодействие между мономерами формирует два кармана, каждый из которых содержит QP сайт от одного мономера и QN сайт от другого мономера. Суммарная реакция процессов, протекающих при участии комплекса III выглядит следующим образом: 2е- КоQH2 + 2Н++ 2 цх c (окисл., Fe3+) → 4Н+ + 2 цх c (восст, Fe2+) + КоQ
Т.о., комплекс III забирает электроны у КоQН2 и передает их цитохрому c. Поскольку цитохромы не способны связывать протоны, то 4Н+ переносятся комплексом в межмембранное пространство. Если перенос 4Н+ комплексом I остается до сих пор не исследованным, то перенос протонов комплексом III хорошо изучен. Данный перенос объясняет так называемый Q -цикл. При этом нужно помнить, что во внутренней мембране митохондрий существует фонд КоQ, поскольку другое название этой молекулы «вездесущий хинон», и он в восстановленной форме может располагаться в разных местах мембраны – как на стороне обращенной к матриксу, так и на стороне, обращенной в межмембранное пространство. Q-цикл состоит из 2-х частей. Участвуют 2 молекулы восстановленного КоQ. Вначале одна молекула КоQH2 передает один электрон при участии FeS-белка и цитохрома c , а второй электрон - на молекулу КоQ, находящуюся на матриксной половине мембраны. Посредниками этой передачи являются цитохромы b. Принимающая электрон молекула КоQ переходит в форму семихинона, а два протона донорской молекулы кофермента переходят в межмембранное пространство.
Молекула второго участника Q-цикла полностью повторяет шаги первой молекулы, но один из электронов передает на семихиноновую форму КоQ, полученную в первой половине цикла, последний полностью восстанавливается и, забирая два протона из матрикса (2Н+), вливается в общий мембранный фонд КоQН2. Таким образом, электроны перенесены на цитохром c , а 4Н+ (два – от КоQ и два – из матрикса) – в межмембранное пространство, присоединяясь к протонам, перенесенным туда комплексом I. Получив электрон, цитохром c , утем простой диффузии переносит его на IV комплекс (цитохром- с -оксидазу). Таким образом, механизм переноса электронов в III комплексе достаточно сложен. 1 стадия. Убихинол переносит один из двух электронов на FeS-центр редуктазы. Этот электрон затем переносится на цитохромы с1 и с, который забирает электрон от комплекса. Этот одноэлектронный перенос превращает убихинол (QН2) в анион семихинона (Q•-). Далее, с семихинона электрон переносится к bL и превращается в Q. Гем цх bL восстанавливает цх b Н, который затем восстанавливает прочно связанный КоQ возле цитозольной стороны мембраны и и превращает его в (Q•-). На этой стадии только один из электронов переносится на цх с. 2 стадия. Затем вторая молекула КоQН2 взаимодействует с комплексом анаогично описанному выше механизму. Один из электронов переносится к FeS-кластеру (центру) и на и с. Второй электрон переносится на цх bL, цх b Н, и восстанавливает Q•- (Q-цикл). Таким образом, в результате полного цикла две молекулы Ко Q Н2 окисляются с образованием двух молекул Q и одна молекула восстанавливается до Ко Q Н2. Значение такого механизма заключается в переносе 2-х электронов от одной молекулы Ко Q Н2 к двум молекулам цх с. На наружной стороне внутренней мембраны 2 молекулы КоQН2 окисляются в КоQ, высвобождая 4 Н+ в межмембранное пространство. Каждая молекула КоQН2 отдает один электрон (через FeS-центр) к цитохрому с1 и один электрон (через цх b) к молекуле КоQ на матричной стороне мембраны, восстанавливая его в две стадии до КоQН2. В процессе восстановления используется 2Н+ из матрикса.
Суммарное уравнение восстановления реакций Q-цикла:
КоQН2 + 2 цх с1 (окисл) + 2Н+ (из матрикса) → КоQ + 2 цх с1 (восст) + 4Н+ (в межмембранное пространство)
Q-цикл обеспечивает связь между переносчиком 2-х электронов убихиноном и одноэлектронными переносчиками цитохромами (b, c 1 и c) и объясняет выталкивание 4-х протонов в межмембранное пространство на каждую пару электронов, транспортируемых через комплекс к цх с.. так происходит окисление КоQ Н2 до Ко Q и восстановление 2-х молекул цх с. Цитохром с является растворимым белком межмембранного пространства. После принятия электрона от комплекса III, цх с движется к комплексу IV и отдает электроны атому меди этого комплекса.
КОМПЛЕКС IV – ЦИТОХРОМ С -ОКСИДАЗА (или комплекс bc, или QH2-дегидрогеназа) Комплекс назван оксидазой из-за способности непосредственно взаимодействовать с кислородом. Это крупный трансмембранный комплекс, с молекулярной массой около 200 кДа, состоящий из 6-13 субъединиц, некоторые из которых кодируются митохондриальной ДНК. В состав IV комплекса входят два хромопротеина – цитохром a и цитохром a 3, два атома меди (CuA и CuВ), связанные с белковыми частями цитохромов таким образом, что они снабжены пространственно с атомами железа порфиринов и способны обмениваться с ними электронами и восстанавливаются (Cu2+ ↔ Cu1+).
Электроны передаются на цх с → CuA → Fe гема цх а → Fe гема цх а3 → CuВ. Гем цх а3 вместе с атомами меди CuВ образует «бинуклеарный центр», связывается кислород. Кислород остается связанным между планарной структурой гемма цх а3 и CuВ до полного восстановления. Это препятствует образованию свободных радикалов. Для каждых 4-х электронов, проходящих через комплекс, фермент использует 4Н+ из матрикса, превращая кислород в Н2О. Энергия восстановительной реакции используется для выталкивания в ММП: на каждый один транспортируемый электрон в ММП выталкивается 1Н+. Следовательно, цитохром- с -оксидаза катализирует одноэлектронное окисление 4-х восстановленных молекул цитохрома с и при этом одновременно осуществляет полное (четырехэлектронное) восстановление молекулы кислорода: 4 цх с (восст) + 8Н+(из матрикса) + О2 → 4 цх с (окисл) + 4Н+ (в ММП) + 2Н2О Т.о., в результате последовательного переноса электронов всеми комплексами дыхательной цепи митохондрии образуется вода (одна молекула на каждые два переносимых электрона), и кроме того, энергия, высвобождаемая в реакциях переноса электронов, используется для переноса протонов в ММП.
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 154; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.36.249 (0.047 с.) |