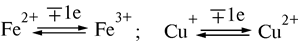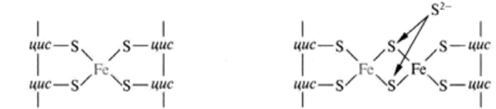Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Аккумуляторы энергии в организме, макроэргические соединения.Стр 1 из 4Следующая ⇒
АККУМУЛЯТОРЫ ЭНЕРГИИ В ОРГАНИЗМЕ, МАКРОЭРГИЧЕСКИЕ СОЕДИНЕНИЯ.
Примерно 40 – 50% энергии, выделяющейся в ходе экзергонических реакций (например, окислительных) запасается в виде макроэргических соединений (в основном в виде АТФ) в специальных «аккумуляторах». Оставшаяся часть (50 – 60%) рассеивается в виде тепла (т.к. мы теплокровные и для нормального протекания процессов метаболизма, необходимо соблюдать температурный гомеостаз). Выделяют три основных «аккумулятора»: 1. внутреннюю мембрану митохондрий (временный аккумулятор для получения АТФ); 2. макроэргические соединения – АТФ, ГТФ, УТФ, ЦТФ, ТТФ, креатинфосфат, некоторые тиоэфиры (ацил-КоА), фосфоеноилпируват, 1,3 дифосфоглицерат и др; 3. НАДН+Н (НАДН2) – биосинтетазы. Разберем аккумуляторы энергии в организме. 1. Внутренняя мембрана митохондрий. Это промежуточный аккумулятор энергии при получении АТФ. За счет энергии окисления веществ происходит выталкивание протонов из матрикса в межмембранное пространство митохондрий (см. далее – цепь переноса электронов). В результат создается электрохимичесий потенциал. При разрядке мембраны энергия электрохимического потенциала трансформируется в энергию АТФ: Еокисл → Еэпх → ЕАТФ
Для реализации этого механизма внутренняя мембрана митохондрий содержит ферментативную цепь переноса электронов на кислород и аденозинтрифосфатазу зависимую (протонзависимую синтазу АТФ).
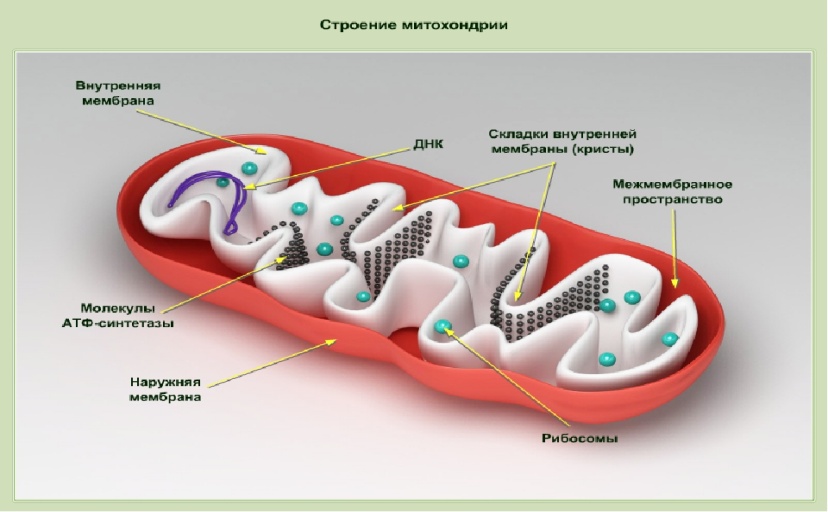
Строение митохондрий.
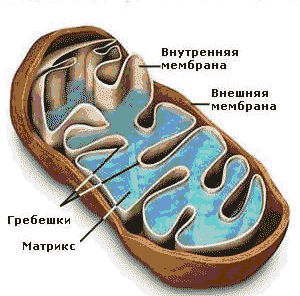
Митохондрии – внутриклеточные компоненты чаще палочковидной (овальной) формы, но могут встречаться и иные формы, например округлые, звездчатые, число которых в клетке составляет сотни или тысячи (число митохондрий может меняться в зависимости от стадии развития клетки и ее функциональной активности).
Внешняя мембрана митохондрий (гладкая) отграничивает внутреннее пространство; проницаема для О2 и ряда низкомолекулярных соединений; содержит ферменты метаболизма липидов и моноаминов (например, ферменты, участвующие в удлинении молекул насыщенных жирных кислот, ферменты, катализирующие окислительные процессы, не связанные с синтезом АТФ (например, моноаминооксидаза и др). Моноаминооксидаза служит маркерным ферментом для идентификации наружной мембраны.
Межмембранное пространство содержит аденилатциклазу (АТФ + АДФ ↔ 2 АТФ) и ферменты фосфорилирования АДФ, не связанные с дыхательными цепями. Кроме аделитациклазы межмембранное пространство содержит нуклеозиддифосфаткиназу. Внутренняя мембрана митохондрий (содержит кристы, или складки, на которых имеются дополнительные грибовидные выросты, где локализована АТФ-синтаза) содержит большое количество ферментов, 30% которых составляют ферменты дыхательной цепи и окислительного фосфорилирования. Проницаема для малых молекул (О2 и мочевины). Маркерным ферментом для идентификации внутренней мембраны является цитохромоксидаза. Матрикс митохондрий одержит ферменты ЦТК, β-окисления жирных кислот, синтеза мочевины, аспартатаминотрансферазу (АсАТ), глутаматдегидрогеназу, фосфоеноилпируваткарбоксикиназу, и т.д. Маркерными ферментами для идентификации внутренней мембраны являются глутаматдегидрогеназа и малатдегидрогеназа.
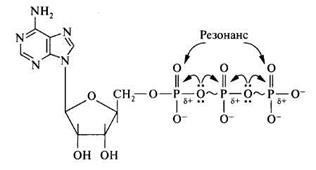
2. АТФ и другие макроэргические соединения. Материальным носителем свободной энергии в органических веществах являются химические связи между атомами. Обычным энергетическим уровнем возникновения или распада химической связи является ≈ 12,5 кДж/моль. Однако имеется ряд молекул, при гидролизе ангидридных и сложноэфирных связей которых выделяется более 21 кДж/моль энергии – макроэргические соединения ( АТФ, ГТФ, УТФ, ЦТФ, ТТФ, креатинфосфат, некоторые тиоэфиры (ацил-КоА), фосфоеноилпируват, 1,3 дифосфоглицерат и др). Из всех известных в настоящее время макроэргических соединений ключевой молекулой в биоэнергетике является АТФ. Почему? Для ответа на этот вопрос надо рассмотреть структуру АТФ. Молекула АТФ представляет собой термодинамически нестойкое соединение. Её нестабильность определяется следующими факторами: 1) электростатическим отталкиванием в области кластера одноимённых отрицательных зарядов, что приводит к напряжению всей молекулы АТФ, но больше всего в месте расположения связи: – Р – О – Р –; 2) конкурентным резонансом, т.к. между атомами фосфора существует конкуренция за неподеленные подвижные пары электронов атома кислорода, расположенного между двумя молекулами фосфора, поскольку на каждом атоме фосфора имеется частичный положительный заряд.
Таким образом, возможность существования АТФ определяется наличием достаточной химической энергии в молекуле, позволяющие компенсировать эти физико-химические напряжения. В молекуле АТФ имеются две пирофосфатные (фосфоангидридные) связи, гидролиз которых сопровождается значительным уменьшением свободной энергии (при рН=7,0 и t=370). Связи, при гидролизе которых изменения свободной энергии системы составляют более 30 кДж/моль, в биохимии называют макроэргическими и обозначают знаком ~ (тильда), а соединения, обладающие такими связями макроэргами. Образование макроэргических соединений в большинстве случаев зависит от энергии, поставляемой АТФ. Следовательно, центральное место в энергетическом обмене занимает цикл: АТФ ↔ АДФ + Р н
В клетках теплокровных АТФ возникает 2-мя путями: 1) аккумулирует энергию более энергоёмких соединений, стоящих выше АТФ в термодинамической шкале без участия О2 – субстратное фосфорилирование: S~Р + АДФ S + АТФ; 2) аккумулирует энергию электрохимического потенциала при разрядке внутренней мембраны митохондрий – окислительное фосфорилирование (Еокис → Еэпх → ЕАТФ). В клетке АТФ выполняет свою биологическую роль в виде комплекса с ионами Mg2+ или Mn2+. Это повышает энергию гидролиза макроэргической связи АТФ до 52,5 кДж/моль. Высвобождение энергии тоже идёт двумя путями: АТФ + Н2О → АДФ + Рн + Н +, ∆G0ʹ = - 31,0 кДж/моль где Рн – фосфор неорганический (ортофосфат), ∆G0ʹ - свободная энергия (знак «-» уменьшение свободной энергии;
АТФ + Н2О → АМФ + РРн + Н +, ∆G0ʹ = - 31,9 кДж/моль где РРн – пирофосфат;
Во время интенсивных упражнений скорость использования АТФ может достигать 0,5 кг/мин. Если ферментативная реакция термодинамически не выгодна, то она может осуществляться при сопряжении с реакцией гидролиза АТФ. Гидролиз молекулы АТФ изменяет равновесие отношение субстратов и продуктов в сопряженной реакции в 108 раз. 3. НАДФН+Н+ (НАДФН2). Никотинамидадениндинуклеотидфосфат (восстановленный) – это специальный аккумулятор с высокой энергией, кторый используется в клетке (локализация – цитозоль) для биосинтезов, например, при обезвреживании ксенобиотиков – чужеродных веществ, попадающих в организм извне. С их помощью происходит введение ОН-групп в субстрат окисления (ксеноботик), который как правило, обладает признаком гидрофобности: S - CH 3 + НАДФН2 + О2 → S - CH 2 ОН + Н2О + НАДФ+, где S-CH3 – гидрофобный субстрат (ксенобиотик). ФАЗЫ ВЫСВОБОЖДЕНИЯ ЭНЕРГИИ 1. Расщепление полимеров до мономеров (энергия не выделяется): белки распадаются до аминокислот, жиры – до жирных кислот и глицерола, полисахара (углеводы) – до моносахаров (глюкоза). 2. Специфические пути превращения мономеров в общие продукты (выделяется до 20% энергии): из аминокислот образуются промежуточные продукты распада – сукцинат, фумарат, ПВК, α-кетоглютарат, ЩУК (или оксалоацетат), ацетил-КоА; из жирных кислот – ацетил-КоА, из глицерола – вначале ПВК, а затем ацетил-КоА; из глюкозы – ПВК, а затем – ацетил-КоА. Как видим, универсальным метаболитом белков, жиров и углеводов явлется молекула ацетил-КоА.
3. Общие пути катаболизма (ЦТК) и сопряженные с ней цепи переноса электронов (выделяется до 80% энергии: в этой фазе (протекает в митохондриях) из субстратов окисления извлекаются атомы водорода, которые передаются на кислород с образованием эндогенной воды и выделением энергии. Эта энергия рассеивается в виде тепла и примерно на 40% запасается в виде АТФ и других макроэргических соединений.
Цитохромы.
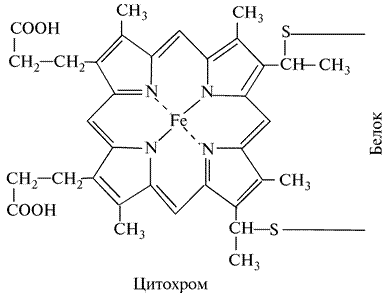
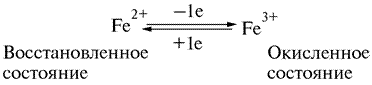
В 1925 г. Кейлиным была открыта ещё одна группа переносчиков электронов – цитохромы. Это электронпереносящие белки-фермены, молекула которых содержит гем и гемоподобные структуры в качестве простетической группы. В отличие от дегидрогеназ, они переносят по одному электрону. Исполнительным элементом в цитохромах является атом железа, способный менять свою валентность:
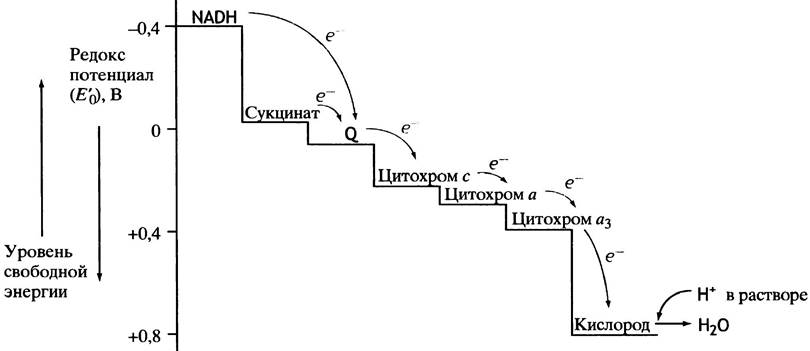
Цитохромы относятся к одноэлектронным окислительно-восстановительным соединениям. Они не могут принимать или отдавать водород, поэтому их называют переносчиками электронов. Известно около 30 различных цитохромов, которые в зависимости от способности поглощать свет разделяются на группы, обозначаемыми строчными английскими буквами (a, b, c и т.д.). внутри каждой группы отдельные виды цитохромов обозначаются цифровыми индексами – b 1, b 2, b 5 и т.д. Цитохромы различаются: 1. по радикалам в порфириновом кольце; 2. по строению апофермента; 3. по типу связи просетической группы с апоферментом. Цитохромы располагаются в митохондриальной цепи между убихиноном и кислородлом в определенной последовательности: b → c 1 → c → aa 3 Цитохромы b, c 1 и c выполняют функцию промежуточных переносчиков электронов, а комплекс цитохромов aa 3, который называется цитохромоксидазой, является терминальным дыхательным ферментом, непосредственно взаимодействующий с кислородом. В цитохроме a простетическая группа через пятую координационную связь железа соединяется с аминогруппой аминосахара, входящего в апофермент, а шестая координационная связь остается свободной. При переносе электрона валентность атома железа меняется: Fe3+ ↔ Fe2+. К шестой координационной связи железа цитохрома a могут присоединяться такие группировки атомов, как HCN, H2S, CO. При этом валентность железа становится постоянной (Fe3+) и поток электронов прекращается. На этом основан механизм действия дыхательных ядов.
Цитохромоксидза (комплекс aa 3) состоит из 6 субъединиц (2 –и 4 - a 3). В цитохроме a 3 имеются атомы меди (Cu2+). Электроны принимаются субъединицами a и передаются цитохрому a 3, который передает их далее на кислород. Перенос электронов комплексом aa 3 включает следующие реакции:
Окисленная форма цитохрома a (Fe3+) принимает электроны от восстановленного цитохрома c, переходя в восстановленную форму (Fe2+), которая затем вновь окисляется в Fe3+ передавая электроны на атомы Cu2+ цитохрома a 3. Этот процесс также сопровождается изменением валентности меди. Атом кислорода, локализованный в углублении цитохрома a 3 с матричной стороны, заряжается отрицательно и приобретает способность взаимодействовать с 2-мя протонами водорода из матрикса, в результате чего образуется молекула воды.
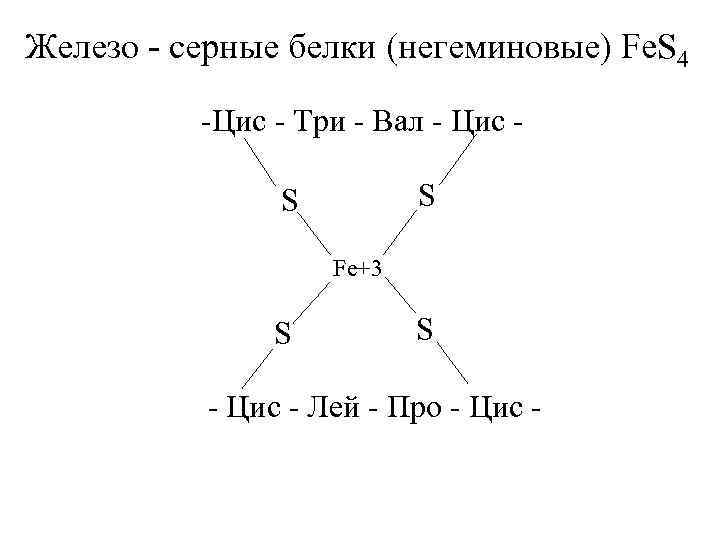
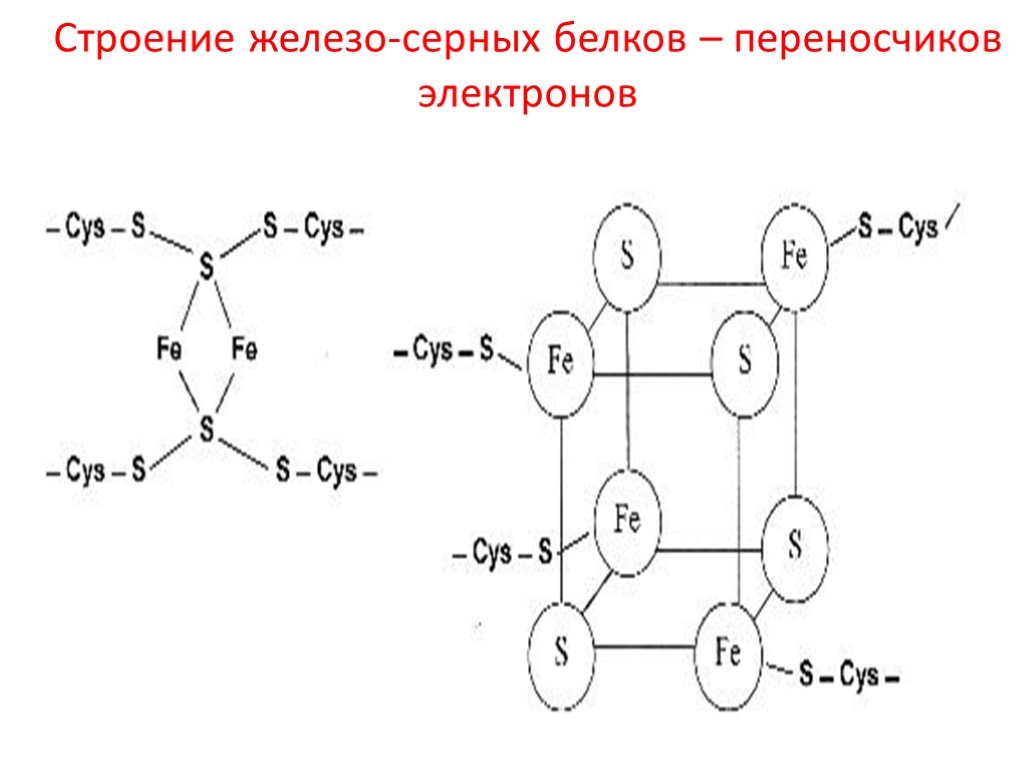
Fe-S белки. Кроме железа, входящего в состав цитохромов, в окислительно-восстановительных реакциях, протекающих на внутренней мембране митохондрий при помощи ферментов ЦПЭ, принимают участие еще одна группа белков, получивших название железо-серных белков (или комплексов). Они входят в состав I, II и III комплексов дыхательной цепи (см.ниже), выполняя роль второй простетической группы в процессе транспорта электронов. Их основная функция – «ловушка электронов». Железо в их составе – негемовое (негеминовые), поэтому их назвали негемовыми железопротеинами.
Атомы железа связаны координационными связями с 4-мя атомами серы 4-х цистеиновых остатков в белке (S2-).
Эти белки играют важную роль в соединении 2-х электронных переносчиков с 1-о электронными в ЦПЭ.
Перечисленные выше белки и ферменты (кроме цитохромоксидазы) используют три из четырех механизмов переноса электронов: 1. перенос электронов (цитохромы и FeS – белки); 2. перенос электронов в составе гидрид-ионов (НАД+ - зависимые дегидрогеназы); 3. перенос электронов в составе атомов водорода (ФМН, ФАД-зависимые дегидрогеназы). БИОЛОГИЧЕСКОЕ ОКИСЛЕНИЕ Биологическое окисление – процесс окисления протонов водорода молекулярным кислородом с образованием эндогенной воды. В настоящее время биологическое окисление определяется как совокупность реакций окисления и восстановления. Вещество окисляется если теряет электроны (е-), или одновременно электроны и протоны, или присоединяет кислород. Противоположный процесс называется восстановлением. Субстраты окисления, отдающие электроны, называются донорами электронов. Электроны, при участии промежуточных переносчиков (ферментативных комплексов, локализованных на внутренней мембране митохондрий), передаются на кислород – конечный (терминальный) акцептор электронов у аэробных организмов. Одновременно с процессами отщепления электронов от субстратов и присоединения их к кислороду в биологических системах происходит образование (синтез) молекул АТФ. Данный процесс, также, локализован в митохондриях, на внутренней мембране, но в грибовидных выростах, где имеется специфический для данной реакции фермент – АТФ-синтаза.
Т.о., процессы биологического окисления тесно связаны с процессами окислительного фосфорилирования (в результате которых синтезируются молекулы АТФ).
Известны четыре основных механизма биологического окисления: 1. дегидрирование субстратов – путем отнятия двух атомов водорода; 2. дегидрирование субстратов – путем отнятия гидрид-иона (:Н-), с высвобождением свободных протонов; 3. путем присоединения кислорода к субстратам окисления; 4. путем отнятия только электронов. Способность молекул отдавать электроны другой молекуле определяется окислительно-восстановительным потенциалом (ОВП или редокс - потенциалом). Редокс - потенциал определяют путем измерения электродвижущей силы в вольтах. В качестве стандарта принят редокс-потенциал водорода: Н2 2Н+ + 2е-; ОВП = -0,42В Запомните! ü Чем меньше потенциал окислительно-восстановительной системы, тем легче она отдает электроны и в большей степени является восстановителем. ü Чем выше потенциал окислительно-восстановительной системы, тем сильнее выражены ее окислительные свойства, т.е. способность принимать электроны присуща только молекулам с более высоким редокс-потенциалом. Это правило лежит в основе последовательности расположения ферментативных систем цепи переноса электронов – промежуточных переносчиков электронов от протонов водорода до кислорода.
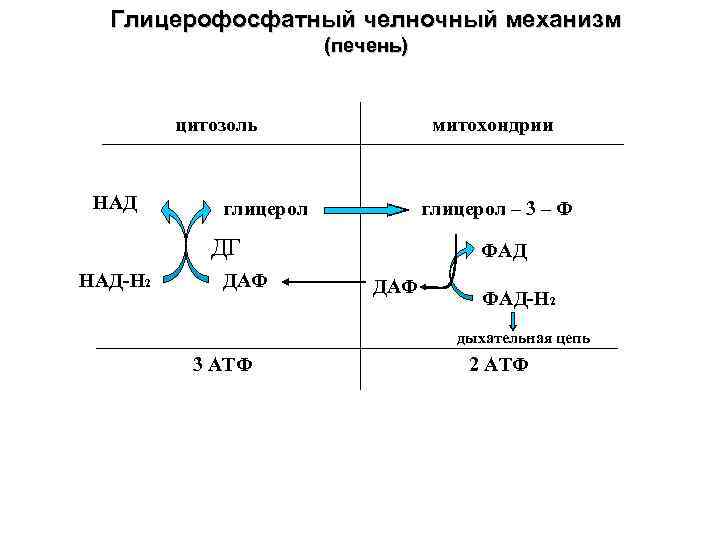
Т.о., транспорт высокоэнергетических электронов восстановленных субстратов происходит в сложной системе, состоящей из окислительно-восстановительных ферментов и коферментов, локализованных на внутренней мембране митохондрий. Ферменты переноса протонов и электронов относятся к классу оксидоредуктаз. Фермент, участвующий в процессах синтеза АТФ – к классу синтаз (АТФ-синтаза). В митохондриях поток электронов устремляется от субстрата, содержащего водород, к молекулярному кислороду. Реакция соединения водорода с кислородом протекает со взрывом («гремучий газ»), т.к. сопровождается выделением большого количества тепла (энергии) – до 239 кДж/моль. В этой реакции водород отдает свои электроны (окисляется), а кислород присоединяет электроны (восстанавливается). Однако в клетках живого организма эта реакция протекает без взрыва (иначе сам процесс существования живой системы был бы невозможен). Почему? Потому что происходит поэтапное выделение энергии в межмембранное пространство митохондрий, где скапливаются протоны водорода, несущие заряд (+). Поэтому, биологическое окисление отличается от реакции образования гремучего газа следующими характеристиками: 1) постепенным выделением энергии; 2) окисляется не молекулярный водород, а водород, включенный в состав субстратов (SH2); 3) энергия высвобождается не только в идее тепла, но и аккумулируется в виде электрохимического потенциала и АТФ. Реакция образования воды протекает не одномоментно, она состоит из большого числа связанных друг с другом реакций, составляющих реакционную цепь. Эта цепь начинается с отрыва водорода субстрата и заканчивается переходом электронов на кислород, поступающий с вдыхаемым воздухом, а переносчиками электронов и протонов водорода являются ферменты дыхательной цепи – оксидоредуктазы. Типы окисляемых субстратов. Субстраты I типа(углевородные) – сукцинат, ацетил-КоА. Средняя энергия отщепления пары электронов около 150 кД/моль. Это меньше, чем энергия электронов в НАДН. Именно поэтому НАД не может участвовать в дегидрировании этих субстратов. Субстраты II типа(спиртовые). При их дегирировании возникают кетоны. Средняя энергия отщепления пары электронов около 200 кД/моль, поэтому НАД может участвовать в дегирировании этих субстратов. Субстраты I II типа(альдегидные). Средняя энергия отщепления пары электронов около 250 кД/моль, поэтому НАД может участвовать в дегирировании этих субстратов. Дегидрогеназы субстратов III типа часто содержат несколько коферментов. При этом часть энергии запасается до цепи переноса электронов. Образование молекулы воды сопровождается переносом 10 или 6 протонов в ММП Как видно из приведенных выше данных, место включения водорода в дыхательную цепь определяет количество протонов, которые переносятся в ММП. Особенно очевидным этот факт становится, если проследить за судьбой водородов НАД+-зависимых дегидрогеназ, которые катализируют окислительные реакции вне митохондрий. Дело в том, что большинство НАД+-зависимых дегидрогеназ, поставляющих водород 1 комплексу дыхательной цели, находятся в матриксе митохондрий. Они катализируют реакции окисления в цикле Кребса (три дегидрогеназы), окислительное декарбоксилирование пировиноградной кислоты, окислительное дезаминирование глутаминовой кислоты, окисление гидроксиацил-КоА и Различают 2 челночных механизма: 1. глицеролфосфатный; 2. малат-аспартатный. Атомы водорода вначале передаются дигидроксиацетонфосфату и затем, при участии rлицерол-З-фосфат' дегидрогеназы (ФП4, см. выше), Атомы водорода вначале передаются дигидроксиацетонфосфату и затем, при участии rлицерол-З-фосфат' дегидрогеназы (ФП4, см. выше),
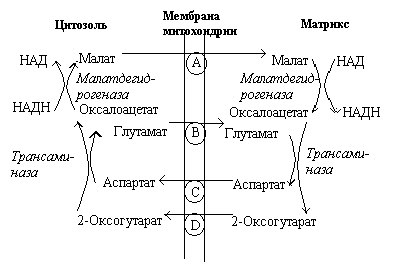
Атомы водорода вначале передаются дигидроксиацетонфосфату и затем, при участии rлицерол-З-фосфат' дегидрогеназы, которая является одним из компонентов II комплекса дыхательной цепи, переносятся на KoQ и по цепи тканевого дыхания доставляются на кислород. Перенос сопровождается высвобождением в ММП щести протонов (III и IV комплексы). Второй челночный механизм. В этом случае водорода НАДН·Н+, полученный в той же реакции, что и в предыдущем примере, передается при помощи фермента малатдегидрогеназы на друrую молекулу - щавелево-уксусную кислоту (ЩУК) с образованием яблочной кислоты (малата). Яблочная кислота свободно проходит через мембрану и в матриксе окисляется НАД+ - зависимой малатдегидрогеназой. НАД•Н+ данной дегидрогеназы затем окисляется I комплексом дыхательной цепи и при переносе электронов на кислород в ММП доставляется 10 протонов.
АККУМУЛЯТОРЫ ЭНЕРГИИ В ОРГАНИЗМЕ, МАКРОЭРГИЧЕСКИЕ СОЕДИНЕНИЯ.
Примерно 40 – 50% энергии, выделяющейся в ходе экзергонических реакций (например, окислительных) запасается в виде макроэргических соединений (в основном в виде АТФ) в специальных «аккумуляторах». Оставшаяся часть (50 – 60%) рассеивается в виде тепла (т.к. мы теплокровные и для нормального протекания процессов метаболизма, необходимо соблюдать температурный гомеостаз). Выделяют три основных «аккумулятора»: 1. внутреннюю мембрану митохондрий (временный аккумулятор для получения АТФ); 2. макроэргические соединения – АТФ, ГТФ, УТФ, ЦТФ, ТТФ, креатинфосфат, некоторые тиоэфиры (ацил-КоА), фосфоеноилпируват, 1,3 дифосфоглицерат и др; 3. НАДН+Н (НАДН2) – биосинтетазы.
|
|||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 1262; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.161.77 (0.076 с.) |