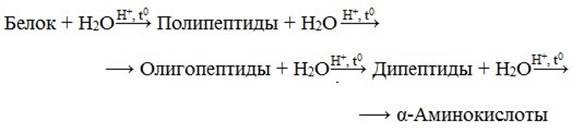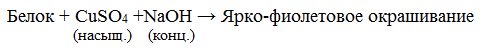Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Белки, их строение, функции, свойстваСтр 1 из 3Следующая ⇒
Белки, их строение, функции, свойства
Белки – это сложные высокомолекулярные природные соединения, непериодические полимеры, мономерами которых являются аминокислоты. В организме человека встречается 5 млн. типов белковых молекул, отличающихся не только друг от друга, но и от белков других организмов. Такое разнообразие обеспечивается сочетанием всего лишь 20 разных аминокислот, составляющих несколько сотен, а иногда и тысяч комбинаций. Порядок их чередования может быть самым разнообразным; благодаря этому возможно существование огромного числа молекул белка, отличающихся друг от друга. Например, из 20 остатков аминокислот теоретически можно составить около 2 • 1018 вариантов белковых молекул, различающихся порядком чередования аминокислот, а значит, и формой, и свойствами. Белки делятся на протеины, содержащие только остатки аминокислот, и протеоды, содержащие еще и небелковую часть (липо-, хромо-, глико-, фосфопротеиды). Молекула белка состоит из углерода, водорода, азота, серы, кислорода. Часть белков образует комплексы с другими молекулами, содержащими железо, фосфор, цинк и медь. Белки имеют большую молекулярную массу: яичный альбумин - 36 000, гемоглобин - 152 000, миозин - 500 000. Для сравнения: молекулярная масса этилового спирта - 46, уксусной кислоты - 60, бензола – 78. Аминокислотный состав белков Белки состоят из б-аминокислот. Основными являются 20 видов б-аминокислот, хотя в клетках и тканях их найдено свыше 170. В организме человека и других животных выделяют: - заменимые аминокислоты - могут образовываться; - незаменимые аминокислоты - образовываться не могут. Незаменимые аминокислоты попадают в организм вместе с пищей. Растения образуют все виды аминокислот. В зависимости от аминокислотного состава различают белки: - полноценные - включают все аминокислоты; - неполноценные - включают только некоторые аминокислоты. Выделяют белки простые и сложные: - простые - состоят только из аминокислот; - сложные - включают кроме аминокислот неаминокислотный компонент (простетическую группу). Она состоит из металлов (металлопротеинов), углеводов (гликопротеинов), липидов (липопротеинов), нуклеиновых кислот (нуклеопротеинов). В аминокислотах различают:
1) карбоксильную группу (-СООН), 2) аминогруппу (-NH2), 3) радикал или R-группу (остальная часть молекулы), отличается у разных видов аминокислот. В зависимости от аминогрупп и карбоксильных групп различают: - нейтральные аминокислоты, содержащие одну карбоксильную группу и одну аминогруппу; - основные аминокислоты, содержащие более одной аминогруппы; - кислые аминокислоты, содержащие более одной карбоксильной группы. Аминокислоты проявляют амфотерные свойства.
Классификация белков в зависимости от строения В зависимости от строения выделяют группы белков: - Фибриллярные белки, их строение высокорегулярно, формируют полимерные соединения. - Глобулярные белки имеют сферическую форму, являются водорастворимыми. - Мембранные белки - имеют пересекающие клеточную мембрану домены, но части их выступают из мембраны в межклеточное окружение и цитоплазму клетки. Различают простые и сложные белки: - простые содержат только полипептидные цепи; - сложные включают дополнительно неаминокислотные группы. Их подразделяют: - Гликопротеины, включают углеводы; - Липопротеины включают липиды; - Металлопротеиды включают ионы металлов; - Нуклеопротеиды включают ДНК или РНК; - Фосфопротеины включают части фосфорной кислоты; - Хромопротеиды включают окрашенные остатки различной химической природы.
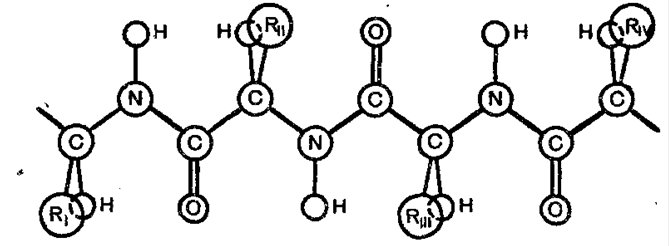
Строение белков Молекулы белков выглядят как линейные полимеры. Белки длиной от 2 до нескольких десятков аминокислотных остатков часто обозначают пептидами, при большей степени полимеризации - белками, но такое деление очень относительно. Пептидные связи в белке формируются в результате взаимодействия б-карбоксильной группы (-COOH) одной аминокислоты с б-аминогруппой (-NH2) другой аминокислоты. Выделяют 4 уровня структурной организации белков: 1. Первичная структура - последовательность аминокислотных остатков в полипептидной цепи. Важными характеристиками первичной структуры становятся устойчивые сочетания аминокислотных остатков, несущие определённую функцию. 2. Вторичная структура - локальное упорядочивание части полипептидной цепи, уравновешенное водородными связями.
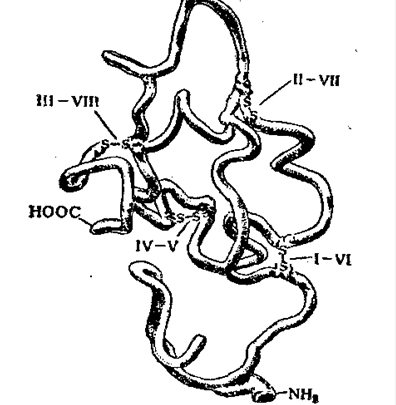
Основные типы вторичной структуры белков: - б-спирали - плотные витки вокруг длинной оси молекулы. - в-листы (складчатые слои) - несколько зигзагообразных полипептидных цепей. - р-спирали и др. 3. Третичная структура - пространственная форма полипептидной цепи. Включает части вторичной структуры, уравновешенные разными видами взаимодействий, но основная роль принадлежит гидрофобным. 4. Четвертичная структура (субъединичная, доменная) - взаимное местоположение нескольких полипептидных цепей в структуре единого белкового комплекса. Молекулы белка с четвертичной структурой синтезируются на рибосомах по отдельности и только затем формируют общую надмолекулярную структуру. В структуре такого белка могут быть идентичные и различающиеся полипептидные цепочки. В уравновешивании четвертичной формы выделяют взаимодействия, как в третичной структуре. Надмолекулярные комплексы могут включать десятки молекул белка.
Эта структура образуется за счет дисульфидных мостиков –S-S- между цистеиновыми остатками. В образовании такой структуры участвуют противоположно заряженные ионы.
Функции белков в организме Белки - это важные компоненты всех живых организмов, они участвуют в жизнедеятельности клетки. Поскольку один и тот же белок может выполнять несколько функций, то классификация белков по ним достаточно условная. Каталитическая функция Ферменты - это белки, катализирующие разные реакции. Они способствуют расщеплению сложных молекул (катаболизм), их образованию (анаболизм) и др. Активный центр - это часть белка, отвечающая за связывание субстрата. Выделяют 6 классов ферментов: КФ 1: Оксидоредуктазы активизируют окислительно-восстановительные реакции; КФ 2: Трансферазы активизируют перенос химических групп с одной молекулы субстрата на другую; КФ 3: Гидролазы активизируют гидролиз химических связей; КФ 4: Лиазы активизируют разрыв химических связей без гидролиза с формированием двойной связи в одном из продуктов; КФ 5: Изомеразы активизируют структурные или геометрические превращения в молекуле субстрата; КФ 6: Лигазы активизируют формирование химических связей между субстратами за счёт гидролиза дифосфатной связи АТФ или трифосфата. Структурная функция Структурные белки отвечают за форму клеток и органов. Многие из них являются филаментозными: например, глобулярные, растворимые мономеры актина и тубулина после полимеризации образуют длинные нити скелета клетки. Коллаген и эластин - главные части межклеточного вещества соединительной ткани (например, хряща), а из кератина формируются волосы, ногти, перья птиц и некоторые раковины.
Защитная функция У белка выделяют следующие виды защитных функций: - Физическая защита организма. В основном это белки со структурной функцией. - Химическая защита заключается в соединении токсинов белками, т.е. в детоксикации. - Иммунная защита - белки отвечают на повреждение и на атаку патогенов. Регуляторная функция Все реакции клетки управляются белками, они регулируют продвижение клетки по клеточному циклу, трансляцию, транскрипцию, сплайсинг, активность других белков и др. Данную функцию белки проявляют за счёт ферментативной активности (например, протеинкиназы), либо в результате специфичного связывания с другими молекулами. Сигнальная функция Это способность молекул передавать сигналы между клетками, тканями, органами и организмами. Часто данную функцию объединяют с регуляторной, так как многие внутриклеточные управляющие белки также выполняют передачу сигналов. Такую функцию проявляют белки-гормоны, цитокины, факторы роста и др. Транспортная функция Белки, участвующие в транспорте, обладают высоким сродством (аффинность) к субстрату, когда его много, и легко высвобождают его там, где его мало. Некоторые мембранные белки осуществляют транспорт малых молекул через мембрану клетки, изменяя её проницаемость. Белки-каналы состоят из заполненных водой внутренних пор, которые помогают веществам перемещаться через мембрану. Рецепторная функция Белковые рецепторы могут быть в цитоплазме и в клеточной мембране. При его воздействии вещества на определённый участок белка происходит его конформационное изменение, в том числе меняется конформация другой части молекулы, и передается сигнал на другие клеточные компоненты. Химические свойства белков Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма. Гидратация. Процесс гидратации означает связывание белками воды, при этом они проявляют гидрофильные свойства: набухают, их масса и объем увеличиваются. Набухание отдельных белков зависит исключительно от их строения. Имеющиеся в составе и расположенные на поверхности белковой макромолекулы гидрофильные амидные (—СО—NH—, пептидная связь), аминные (—NH2) и карбоксильные (—СООН) группы притягивают к себе молекулы воды, строго ориентируя их на поверхности молекулы. Окружающая белковые глобулы гидратная (водная) оболочка препятствует агрегации и осаждению, а следовательно, способствует устойчивости растворов белка. В изоэлектрической точке белки обладают наименьшей способностью связывать воду, происходит разрушение гидратной оболочки вокруг белковых молекул, поэтому они соединяются, образуя крупные агрегаты. Агрегация белковых молекул происходит и при их обезвоживании с помощью некоторых органических растворителей, например, этилового спирта. Это приводит к выпадению белков в осадок. При изменении pH среды макромолекула белка становится заряженной, и его гидратационная способность меняется.
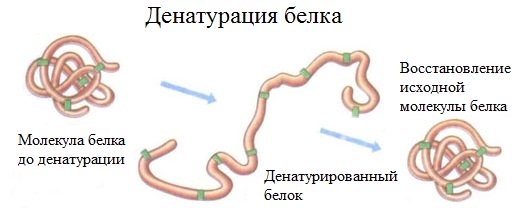
При ограниченном набухании концентрированные белковые растворы образуют сложные системы, называемые студнями. Студни не текучи, упруги, обладают пластичностью, определенной механической прочностью, способны сохранять свою форму. Глобулярные белки могут полностью гидратироваться, растворяться в воде (например, белки молока), образуя растворы с невысокой концентрацией. Гидрофильные свойства белков, т. е. их способность набухать, образовывать студни, стабилизировать суспензии, эмульсии и пены, имеют большое значение в биологии и пищевой промышленности. Очень подвижным студнем, построенным в основном из молекул белка, является цитоплазма — сырая клейковина, выделенная из пшеничного теста; она содержит до 65 % воды. Различная гидрофильность клейковинных белков — один из признаков, характеризующих качество зерна пшеницы и получаемой из него муки (так называемые сильные и слабые пшеницы). Гидрофильность белков зерна и муки играет большую роль при хранении и переработке зерна, в хлебопечении. Тесто, которое получают в хлебопекарном производстве, представляет собой набухший в воде белок, концентрированный студень, содержащий зерна крахмала. Денатурация белков. При денатурации под влиянием внешних факторов (температуры, механического воздействия, действия химических агентов и ряда других факторов) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы, т. е. ее нативной пространственной структуры. Первичная структура, а следовательно, и химический состав белка не меняются. Изменяются физические свойства: снижается растворимость, способность к гидратации, теряется биологическая активность. Меняется форма белковой макромолекулы, происходит агрегирование. В то же время увеличивается активность некоторых химических групп, облегчается воздействие на белки протеолитических ферментов, а следовательно, он легче гидролизуется.
В пищевой технологии особое практическое значение имеет тепловая денатурация белков, степень которой зависит от температуры, продолжительности нагрева и влажности. Это необходимо помнить при разработке режимов термообработки пищевого сырья, полуфабрикатов, а иногда и готовых продуктов. Особую роль процессы тепловой денатурации играют при бланшировании растительного сырья, сушке зерна, выпечке хлеба, получении макаронных изделий. Денатурация белков может вызываться и механическим воздействием (давлением, растиранием, встряхиванием, ультразвуком). Наконец, к денатурации белков приводит действие химических реагентов (кислот, щелочей, спирта, ацетона). Все эти приемы широко используются в пищевой и биотехнологии.
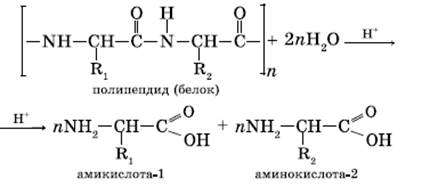
Пенообразование. Под процессом пенообразования понимают способность белков образовывать высококонцентрированные системы «жидкость — газ», называемые пенами. Устойчивость пены, в которой белок является пенообразователем, зависит не только от его природы и от концентрации, но и от температуры. Белки в качестве пенообразователей широко используются в кондитерской промышленности (пастила, зефир, суфле). Структуру пены имеет хлеб, а это влияет на его вкусовые качества. Молекулы белков под влиянием ряда факторов могут разрушаться или вступать во взаимодействие с другими веществами с образованием новых продуктов. Для пищевой промышленности можно выделить два важных процесса: 1) гидролиз белков под действием ферментов; 2) взаимодействие аминогрупп белков или аминокислот с карбонильными группами восстанавливающих сахаров. Под влиянием ферментов протеаз, катализирующих гидролитическое расщепление белков, последние распадаются на более простые продукты (поли- и дипептиды) и в конечном итоге на аминокислоты. Скорость гидролиза белка зависит от его состава, молекулярной структуры, активности фермента и условий. Гидролиз белков. Реакцию гидролиза с образованием аминокислот в общем виде можно записать так:
Или
Горение. Белки горят с образованием азота, углекислого газа и воды, а также некоторых других веществ. Горение сопровождается характерным запахом жженых перьев.
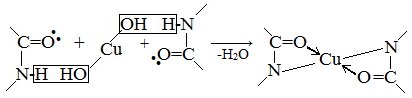
Биуретовая реакция
При действии на белки раствора солей меди (II) в щелочной среде возникает сиреневое или фиолетовое окрашивание. Голубая окраска раствора соли меди изменяется на фиолетовую (или несколько иную в зависимости от природы белка) за счет образования комплексных соединений.
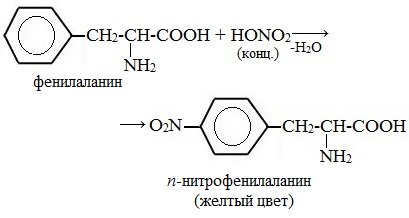
Ксантопротеиновая реакция
При действии на белки концентрированной азотной кислоты образуется желтая окраска, связанная с нитрованием ароматических колец в соответствующих аминокислотах. Если биуретовая реакция универсальна на все белки, то ксантопротеиновую дают только те полипептиды, которые содержат остатки фенилаланина, триптофана, тирозина. Таких аминокислот много в белках мышечных тканей (миозин), но почти нет в соединительных (желатин). Если на скорлупу вареного вкрутую яйца нанести несколько капель концентрированной азотной кислоты, происходит бурное вспенивание. Скорлупа состоит главным образом из карбоната кальция. Разрушая скорлупу, кислота проходит до белка. В месте попадания азотной кислоты осталось желтое пятно. Его окраска усилится и перейдет в оранжевую, если вырезанный фрагмент белка с пятном опустить в раствор щелочи или аммиака (нитроарен переходит в ацинитроформу).
Белки, их строение, функции, свойства
Белки – это сложные высокомолекулярные природные соединения, непериодические полимеры, мономерами которых являются аминокислоты. В организме человека встречается 5 млн. типов белковых молекул, отличающихся не только друг от друга, но и от белков других организмов. Такое разнообразие обеспечивается сочетанием всего лишь 20 разных аминокислот, составляющих несколько сотен, а иногда и тысяч комбинаций. Порядок их чередования может быть самым разнообразным; благодаря этому возможно существование огромного числа молекул белка, отличающихся друг от друга. Например, из 20 остатков аминокислот теоретически можно составить около 2 • 1018 вариантов белковых молекул, различающихся порядком чередования аминокислот, а значит, и формой, и свойствами. Белки делятся на протеины, содержащие только остатки аминокислот, и протеоды, содержащие еще и небелковую часть (липо-, хромо-, глико-, фосфопротеиды). Молекула белка состоит из углерода, водорода, азота, серы, кислорода. Часть белков образует комплексы с другими молекулами, содержащими железо, фосфор, цинк и медь. Белки имеют большую молекулярную массу: яичный альбумин - 36 000, гемоглобин - 152 000, миозин - 500 000. Для сравнения: молекулярная масса этилового спирта - 46, уксусной кислоты - 60, бензола – 78.
|
|||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 180; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.30.253 (0.037 с.) |
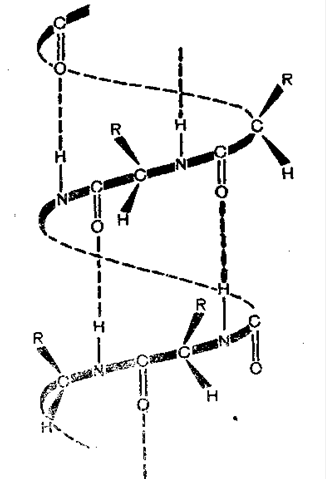 α -спираль
На одном витке укладываются 4 аминокислотных остатка, которые находятся снаружи спирали.
α -спираль
На одном витке укладываются 4 аминокислотных остатка, которые находятся снаружи спирали.
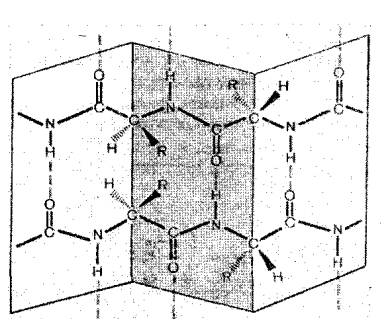 β-структура.
Полипептидная цепь растянута, ее участки располагаются параллельны друг другу и удерживаются водородными связями.
β-структура.
Полипептидная цепь растянута, ее участки располагаются параллельны друг другу и удерживаются водородными связями.