Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 10. Микрокамеры для микроинъекций
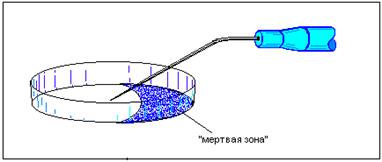
10.1. Микроинъекция в чашке Петри В лабораторной практике чашки Петри имеют самое широкое распространение, так как в них ведут культуру клеток как наиболее частый объект для исследования, культивируют, инъецируют и анализируют, не пересаживая их в другую посуду. Размеры чашек могут быть самыми различными. Но для удобства и обеспечения разумного количества клеток для инъецирования диаметр лучше выбирать около 40 мм. Высота бортиков не очень большая и позволяет выбирать нужный наклон микропипеток и держателей прямого типа и даже иногда контролировать мениск инъецируемой жидкости в процессе микроинъекции, что очень важно. Некоторые исследователи используют микроинструменты изогнутого типа (Вайсман, Голинский, 1985). И хотя такой способ занимает больше времени на подготовку, но в работе горизонтальное расположение микропипетки с мениском в поле зрения микроскопа всегда желательно как для того, чтобы быть уверенным, что микроинъекция происходит, так и для того, чтобы вести количественную оценку инъецируемого материала. Многих вводят в заблуждения так называемые «мертвые зоны» чашки Петри, то есть участки поверхности дна чашки, в которые не может проникнуть микропипетка во время микроинъекции. На рисунке показана эта зона. Наклон микропипетки должен быть таким, чтобы центр чашки Петри был доступен для кончика микропипетки. Так называемая «мертвая зона» ликвидируется разворотом чашки вокруг оси в фокальной плоскости микроскопа.
В некоторых работах инъецируемые клетки маркируют, чтобы не ошибиться в процессе микроинъекции и после нее при обработке результатов. Дно чашки расчерчивают на квадратики и маркируют их. Некоторые авторы используют подложки с готовыми маркированными поверхностями. Система маркировки совершенно произвольна. Подложки очень удобны для работы, так как они легко перемещаются и позволяют вносить любые изменения в маркировку при помощи иглы или тонкого фломастера, или какого-либо красителя. В чашки Петри больших размеров можно поместить несколько подложек (скажем, опыт и контроль одновременно).
Жидкую среду, в которой производят микроинъецирование, часто подкрашивают парафиновым (вазелиновым) маслом для предотвращения испарения. Многие исследователи, использующие чашки Петри, продувают пространство над средой газовой смесью с CO2, чтобы создать анаэробные условия во время инъецирования клеток. Высокие бортики чашки Петри позволяют этой газовой смеси достаточно долго находиться над средой, вытесняя избыток атмосферного кислорода за счет того, что CO2 тяжелее воздуха. Ток газовой смеси, однако, стараются подавать постоянно для более стабильных условий. Использование стеклянных чашек Петри и чашек больших размеров (например, из пирексового стекла и, следовательно, весьма толстостенных) требует применения инвертированного микроскопа с объективом, имеющим большое рабочее расстояние. Кроме того, использование стеклянных чашек Петри может усложнить применение микропипеток прямого типа, так как касание микропипеткой дна чашки часто вызывает поломку инструмента, что маловероятно для пластмассовых чашек. Это не относится к микропипеткам изогнутого типа. На рисунках представлено несколько вариантов использования чашек Петри для микроинъекций. Положение чашек зависит от метода микроинъекции. В перевернутых чашках инъецируют только микропипеткой, проходящей через центральное отверстие конденсора микроскопа. При этом вместо микропипетки может использоваться сплошная микроигла, а вещество для микроинъекции может находиться в тонкой пленке вокруг прикрепленной культуры клеток. Следовые количества вещества, адсорбированного на поверхности иглы, иногда бывают достаточны для проведения инъекции.
10.2. Простейшие камеры для микроинъекции
Простейшая «камера», если ее так можно назвать, в которой можно производить инъекции и даже микрохирургические операции на клетках, — это капля среды на предметном стекле. Желательно, чтобы при этом капля не растекалась по поверхности стекла и имела большой краевой угол смачивания. Удобной подложкой для этих целей является «парафилм» как идеальный, совершенно не смачиваемый материал. Однако из-за непрозрачности его обычно используют для микроинъекции в большие клетки (икра рыбы, ооциты земноводных и др.).
Удобный вариант предложил Лин (Lin, 1971), который ограничил каплю (точнее, несколько капель) вазелиновым кольцом, диаметр которого может определить и высоту капли: небольшое кольцо может позволить создать каплю высотой больше радиуса кольца. Недостатком таких камер, предназначенных для клеток животных и растений, является непосредственное попадание света и кислорода атмосферы. От испарения можно предохранить каплю небольшим слоем парафинового масла (одним касанием каплей масла поверхности среды). Гидрофобизация поверхности предметного стекла — идеальный способ использования нерастекающихся капель в качестве простейших камер. Покрытие можно производить не только кремнийорганическими соединениями, требующими достаточно продолжительной по времени технологии. Для этих целей можно использовать тонкий слой предельных углеводородов, масел и жиров, которые бы не были токсичными для клеток. Если поверхность не гидрофобизирована (лиофильна), положение микроинструмента должно быть таковым, чтобы вдоль его продольной оси капля не растекалась, так как ток ее унесет клетки под микроинструмент. В этом случае предпочтительнее иметь гидрофобизированные микропипетки. Вазелиновое кольцо полностью снимает эффекты растекания капли под микропипетку, и в этом случае микропипетку нет необходимости гидрофобизировать.
10.3. Микрокамера типа Фонбрюна
Подробно описание конструкций этого типа камер можно найти в книге П. Фонбрюна (1951). Их насчитывается несколько разновидностей, смотря по назначению. Камера Фонбрюна представляет собой предметное стекло с полосками (стойками), толщина которых определяет высоту камеры. На стойки накладывают покровное стекло, под которым образуется пространство для клеток со средой. Открытые торцы этой камеры заливают парафиновым маслом.
Микрокамеры типа Фонбрюна выпускали в 1965 году СКБ БП АН СССР как запасные элементы комплекта микроманипуляторов КМ-1. Впоследствии их выпуск был прекращен, хотя иметь такую камеру среди приборов и приспособлений для микроманипуляционных работ было бы весьма полезно. Напомним три варианта использования камеры Фонбрюна в микроманипуляции: Первый вариант: камера полностью заполнена средой с клетками и только торцы ее заливают парафиновым (вазелиновым) маслом, чтобы предотвратить испарение. Сквозь масло можно легко проникнуть микроинструментами внутрь камеры к клеткам. Второй вариант: метод висячей капли. На покровное стекло снизу наносят одну или несколько капель среды с клетками. Затем осторожно заливают все пространство под покровным стеклом и каплей среды с клетками парафиновым (вазелиновым) маслом, которое прижимает каплю к покровному стеклу и уплощает ее, иногда фиксируя клетки, что очень удобно для многих микроопераций. Третий вариант: тоже метод висячей капли, но в окружении воздуха. Торцы камеры заливают парафиновым (вазелиновым) маслом, но так, чтобы оставить воздушные пространства вокруг капли среды с клетками. Давление водяных паров при этом должно быть таковым, чтобы капли с клетками не испарялись долгое время.
Вариант конструкции микрокамеры Фонбрюна. В наших работах с микроинъекциями и сложными микрохирургическими операциями была использована микрокамера Фонбрюна, размеры которой были сведены к минимуму и по высоте и по площади, с целью применения фазового контраста, аноптрального контраста (требующего строго определенных размеров по высоте микрокамеры) или оптики Номарского. Для этого мы разрезали покровные стекла на полоски шириной 3-5 мм, а боковыми стойками камеры служили кусочки предметных стекол, которые и определяли высоту камеры.
Среду с клетками помещали следующим образом: на середину полоски покровного стекла, закрывающего камеру сверху, помещали капельку среды, а клетки с такого же размера капелькой помещали под ней на дно камеры. Затем пинцетом осторожно прогибали покровное стекло до соединения капелек. Между покровным стеклом и предметным образовывался столбик среды, легко доступный для микроинструментов. Для предотвращения испарения этого столбика к его поверхности касались микропипеткой, заполненной маслом. Даже тонкий слой масла позволяет работать с такой микрокамерой несколько десятков минут.
10.4. Микрокамера для микроинъекций в ооциты земноводных и рыб
Микрокамера, в которой мы обычно производим микроинъекцию в ооциты земноводных и рыб, состоит из основания и боковой стенки, которая служит упором для клеток, способствует фиксации клеток и выстраивает их в одну линию с целью проведения микроинъекции с повышенной скоростью. Для изготовления камеры может быть использовано, например, предметное стекло для гистологических работ, тщательно очищенное и склеенное. Толщина и размеры могут быть самыми различными, но лучше всего такими, чтобы удобно было держать готовую камеру между большим и указательным пальцами левой руки, если микроинъекцию производят под стереоскопическим микроскопом типа МБС, или же она должна свободно помещаться в препаратоводителе, если используется любой другой микроскоп. Необходимым условием использования такой камеры является высокая смачиваемость поверхностей, которых касаются клетки. Небольшое количество среды вокруг клеток должно быть таким, чтобы клетки не подсыхали на воздухе, но и не плавали в ней свободно. Угол между боковой стенкой и основанием камеры позволяет излишку среды разойтись по обе стороны камеры. Клетки при этом достаточно хорошо фиксируются за счет поверхностного натяжения среды. Этих усилий, как правило, достаточно, чтобы клетки не скользили вдоль камеры и не отрывались при выведения из них микропипетки.
Кроме того, небольшое количество среды в камере является необходимым условием для преодоления артефакта, возникающего при микроинъекции в ооциты, — спонтанного выхода инъецируемой жидкости через некоторое время после введения ее в клетку. Авторы предлагают во время микроинъекции помещать ооциты в парафиновое масло. Это, конечно, приносит свои плоды, но избавиться после микроинъекции от парафинового масла крайне трудно, и эта работа занимает у экспериментатора довольно большое время. Если же это масло еще и токсично, что бывает при длительном его хранении или при недостаточной степени его очистки, то метод с использованием такого масла вообще нельзя применять. Время работы с 10-20 клетками в такой камере определяется опытом экспериментатора и требуемой точностью введения определенных количеств растворов вещества. Ясно, что чем точнее надо ввести объемы раствора, тем медленнее продвигается процесс микроинъекции. В некоторых случаях можно инъекцию проводить при неподвижной микропипетке, манипулируя камерой руками, накалывая каждую клетку и снимая ее после инъекции с микропипетки. Частота инъекций может быть таким образом несколько увеличена, особенно если исполнительный механизм дозатора механизирован (см. например в сб. «Современные проблемы оогенеза», стр. 288-290, 1977). Линейное расположение клеток позволяет значительно ускорить процесс микроинъекции, так как не надо отыскивать очередные клетки, подлежащие инъецированию. Микрокамера весьма просто освобождается от инъецированных клеток прямым смывом их средой в чашку Петри для дальнейшего культивирования или инкубации. Клетки при этом вообще не подвергаются повреждению и дополнительному введению их в полость пипетки, служащей для отбора клеток. Мы здесь остановились коротко на технологии микроинъекции для того, чтобы показать некоторые достоинства этой камеры. Однако данная камера открытого типа подвержена постоянному действию света и атмосферного кислорода. Поэтому содержать клетки в таких камерах продолжительное время не рекомендуется, если не применять дополнительных мер предосторожности (оптические светофильтры, тепловые фильтры, поддув газовой среды, содержащей смесь 5% CO2, 5% О2 и 90% N2).
10.5. Удержание клеток в процессе микроинъекции
Описывая конструкцию и назначение микрокамер для микроинъекции веществ в клетки или для микроманипулирования, мы специально опустили такой важный вопрос, как фиксация клеток в момент введения микропипеток, микроигл или других микроинструментов. Этот вопрос мы рассмотрим здесь подробно, анализируя достоинства и недостатки каждого способа фиксации отдельных клеток. Фиксация должна отвечать трем основным требованиям. Во-первых, момент прокола мембраны и вход кончика микропипетки в отдельную органеллу не должен сопровождаться перемещением всей клетки, так как оно способствует повреждению цитоплазматического аппарата в целом, при этом возможны нежелательные утечки содержимого клетки и т.п. Во-вторых, фиксация клетки должна быть такой, чтобы не создавать дополнительного внутриклеточного давления, т.к. оно может повлечь дополнительную утечку содержимого через прокол микропипетки или в ее полость, если в пипетке создается отрицательное давление. В-третьих, фиксация не должна деформировать клетку, например, прижимая ее к дну камеры, т. к. не все клетки легко выдерживают излишнюю механическую деформацию. Последнее особенно относится к клеткам с хорошо развитым внутриклеточным мембранным аппаратом.
Среди способов фиксации клеток можно выделить следующие: 1. «Подсушивание» клеток стеклу (к дну микрокамеры, дну чашки Петри, предметному стеклу, часовому стеклу и т. д.). 2. Приклеивание клеток при помощи протамин-сульфата (1%). 3. Приклеивание биологическим клеем (коллодием). 4. Фиксация клеток за счет формы микрокамеры (на примере ооцитов земноводных, см. раздел «Микрокамеры»). 5. Фиксация клеток в агаровых лунках на дне чашки Петри. 6. Заливка клеток в гели или парафин. 7. Использование микродержателей-капсул (для яйцеклеток млекопитающих (Никитин с соавт., 1980) и протопластов растений. 8. Фиксация микроприсосом (или присосом-гребешком) («Современные проблемы оогенеза», стр. 288-290, 1977). 9. Естественная фиксация клеток за счет прикрепления их к подложке в чашке Петри в процессе культивирования. Каждый исследователь может выбрать по желанию один из способов фиксации клеток, и можно не сомневаться, что в процессе работы с определенным типом клеток непременно возникнут и другие способы фиксации, так как их, по-видимому, такое же разнообразие, как и клеток, и особых условий их культивирования, и методов введения в них вещества или органелл. Кратко охарактеризуем каждый из отмеченных нами способов фиксации клеток. 1. «Подсушивание» клеток к стеклу применяют больше всего для икры рыбы. Икринки укладывают монослоем, предварительно подсушивают фильтровальной бумагой и дают слегка подсохнуть сверху (до тех пор, пока они не будут с трудом смещаться по стеклу). Затем полоской фильтровальной бумаги, обильно смоченной питательным раствором или озерной водой, проводят по всем клеткам, смачивая таким образом начинающую подсыхать верхнюю поверхность икринок. 2. Приклеивание клеток при помощи 1%-ного протамин-сульфата описана у Штейнхарда (Steinhardt et al. 1971). Чистую, обезжиренную поверхность стекла смачивают протамин-сульфатом (1%), дают слегка подсохнуть и тут же заливают культуральной средой, фосфатным буфером или синтетической средой с клетками. Осевшие клетки достаточно прочно прикрепляются к слою протамин-сульфата за счет поверхностного электрического заряда. Так можно прикреплять изолированные клетки животных, протопласты растений или микроорганизмов. Авторы отмечают, что сила прикрепления клеток зависит от стадии их развития. 3. Сходным с предыдущим является способ прикрепления клеток при помощи биологического клея (коллодий). Однако для него существует одно ограничение — клетки должны иметь оболочку (например, зона пеллюцида у яйцеклеток) или клеточную стенку. Мембраны клеток приклеиваются иногда практически необратимо, в результате чего наблюдается высокий процент повреждения клеток. 4. На примере камеры для микроинъекции в ооциты земноводных, описанной в разделе «Микрокамеры», можно рассматривать возможность удерживания клеток за счет конфигурации камеры. Однако этот способ применим только для больших клеток ооцитов земноводных и икринок рыб. 5. Удерживание клеток крупных размеров возможно в агаровых лунках, сделанных на застывшем агаре разогретой стеклянной палочкой, предварительно оплавленной. На рисунке показано, как можно размещать клетки в лунке и под углом располагать микропипетку для инъецирования. Бортики лунки не позволяют, однако, клеткам прикрепляться и затрудняют вытаскивание их из лунок микропипетками. 6. Заливка в гели или парафин, а также агар-агар, возможна только для модельных опытов, отдельных морфологических исследований, для клеток, которые могут выдерживать температуру расплавленного парафина или агар-агара. Гели полимеризируются при комнатной температуре и поэтому их можно использовать для заливки любых клеток. Однако отделить затем клетки от геля не так просто. Из литературных данных известно, что кратковременная иммобилизация разных клеток в застывшем геле не сказывается, как правило, на их культивировании. 7. Микродержатели-капсулы изготавливали, для многих клеток (Фонбрюн, 1951), для протопластов растительных клеток и для половых клеток сельскохозяйственных животных (Никитин с соавт., 1980). Этот способ пригоден для изолированных клеток, имеющих любую форму. Объем клеток должен быть хотя бы приблизительно равен внутреннему объему капсулы. Стенки капсулы окружают клетку практически со всех сторон, кроме места, в которое производят инъекцию. Для протопластов, главным образом растительных, которые не удерживаются внутри капсулы из-за своей эластичности, эта капсула может быть несколько уменьшена, чтобы иметь увеличенную поверхность контакта с их стенкой. Сами протопласты присасывают к отверстию капсулы, а прокол делают вблизи места присоса. Микрокапсула, удерживающая протопласт, и микропипетка для инъекции при этом должны находиться на одном микроманипуляторе. 8. Фиксация микроприсосом — это классический способ удерживание ооцитов или ранних зародышей млекопитающих. Он описан во многих работах, связанных с исследованием подобных клеток и организмов с применением микроинъекции. Для скрининга и для большой пропускной способности микроинъектора иногда используют микроприсосы-гребенки для фиксации сразу десятка и больше клеток. Такой способ фиксации пригоден для клеток больших размеров (ооцитов земноводных, икринок рыб и др.). 9. К естественной фиксации следует отнести способность клеток распластываться на подложке или непосредственно в чашке Петри в процессе их культивирования. Инъекцию в такие клетки (культуры клеток) производят в чашках Петри, и после этого в них же ведут последующее культивирование и проводят анализ результатов инъецирования. Рассмотрим более подробно только фиксацию микроприсосом как один из наиболее часто используемых на практике приемов. Учитывая тот факт, что клетки, как правило, плохо переносят отрицательное давление, площадь контакта отверстие присоса и величина отрицательного давления должны быть оптимизированы. Другими словами, при минимальном отрицательном давлении и минимальной площади захвата поверхности клетка должна оставаться на микроприсосе в процессе прокола, введения кончика микропипетки в данную внутриклеточную область и выведение микропипетки. Отрицательное давление в полости микроприсоски должно быть оптимальным и не должно способствовать возникновению избыточного гидростатического давления внутри клетки. Повышенное давление в клетке пагубно сказывается в момент прокола клетки при введении известного количества жидкости внутрь клетки и после выведения микропипетки из клетки. Введенная жидкость часто выходит из клетки или за счет избыточного давления внутри клетки, или за счет плохой репарации отверстия мембраны после выведения микропипетки из клетки. Засасывание части клетки в полость микроприсоса крайне нежелательно не только из-за повышения внутриклеточного гидростатического давления, но и изменения общей поверхности клетки, которое чаще всего дает не свойственное для данной клетки соотношение объем/поверхность. На границе полости микроприсоса и цитоплазмы за счет отрицательного давления создается добавочный градиент давления, способствующий достаточно интенсивному выходу внутриклеточного содержимого через мембрану, что очень хорошо видно визуально и особенно при цейтраферной микрокиносъемке этого участка. Для яйцеклеток млекопитающих это выражается в интенсивном движении цитоплазмы и жидкости перивителлинового пространства по градиенту отрицательного давления. Учитывая сказанное, следует позаботиться о нахождении минимального отрицательного давления и минимальной площади присоса простым эмпирическим способом: опробовать присосы с разным внутренним диаметром и испытав несколько величин отрицательного давления, выбрать только те, которые были бы на границе их возможного применения, но такие, чтобы клетки еще оставались фиксированными при манипулировании с ними при проколе и выводе микропипетки из клетки. Для яйцеклеток мыши внутренний диаметр микроприсоса может быть 10-15 мкм. При этом прогиб зоны пеллюцида в полость микроприсоса должен быть минимален (до нескольких микрометров). Все это относится только к микроприсосам, имеющим идеальный торец, который приходит в контакт с зоной пеллюцида. Микроприсос изготавливают на микрокузнице из стеклянного капилляра (микропипетки) с наружным диаметром торца 50-100 мкм. Торец при этом должен всегда быть тщательно оплавлен. Наружный диаметр микроприсоса не должен превышать диаметр клетки (при оплавлении торцевая часть микроприсоса уменьшается в диаметре), иначе будет сложно манипулировать клеткой в микрокамере. Если при отрезании капилляра на торце остались выщербины и неровности, то после оплавления они, как правило, остаются в виде изгибов по кромке, по которой происходит фиксация клетки. Качество такого присоса резко падает, он требует большого отрицательного давления, а отсюда и возникает большая деформация клетки, большее ее повреждение.
|
|||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 171; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.156.35 (0.027 с.) |