
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 3. Методы слияния клеток с мембранными везикулами и органеллами
3.1. Тени эритроцитов
В 1974 году японскими исследователями был предложен простой и оригинальный метод введения микроколичеств веществ в виде растворов в клетку при помощи «теней» эритроцитов (Furusawa et al.,1974). Производится слияние с клеткой-мишенью «теней» эритроцитов, внутри которых находятся растворы инъецируемых веществ. Вызывая постепенный гемолиз эритроцитов (стандартный способ получения «теней» эритроцитов) и замещая большую часть гемоглобина на инъецируемое вещество, изменяют состав окружающей среды так, чтобы мембрана «теней» становится непроницаемой для заключенных внутри молекул. Дальнейшая манипуляция с этими «тенями» заключается в слиянии с клеткой-мишенью при помощи одного из активных сливающих агентов: полиэтиленгликоля (ПЭГ), с молекулой весом до 6000, или инактивированного вируса Сендай.
Все методические тонкости описаны в работах (Furusawa et al., 1974). Здесь мы остановимся только на некоторых достоинствах и недостатках этого метода, чтобы представить в общих чертах его технические особенности и перспективы практического применения. Достоинства: а) сравнительно за короткое время можно ввести макромолекулы в большое число культивируемых клеток (переносить можно белки, небольшие молекулы РНК или фрагменты ДНК); б) метод обладает высокой эффективностью (до 90% клеток-реципиентов сливаются с эритроцитами); в) в процессе его использования можно в широких пределах варьировать загрузку «теней» эритроцитов (от нескольких молекул до достаточно высоких концентраций), а используя меченые молекулы, определить их концентрацию. Недостатки: а) главный недостаток метода — варьирование объемов инъецируемых макромолекул и фрагментов, определяемое размерами «теней» эритроцитов; б) макромолекулы можно инъецировать только в цитоплазму клеток; в) вместе с внесением содержимого эритроцита в мембрану клетки-реципиента встраивается и его мембрана; г) время, необходимое для проведения микроинъекции, составляет несколько часов для введения («загрузки») макромолекул в эритроциты и около 1 часа для их слияния с клетками в культуре;
д) успех инъекции зависит только от эффективности адсорбирования клетками-мишенями «теней» эритроцитов; е) относительные сложности идентификации и сбора клеток, подвергавшихся микроинъекции; ж) концентрация, введенная в клетку, определяется соотношением объемов клеток-мишеней и объема слившихся теней (для культуры клеток млекопитающих характерно увеличение объема клеток при слиянии вплоть до 10%); з) эритроциты не всех млекопитающих подходят для удовлетворительного слияния с клетками в культуре. Мы охарактеризовали главные достоинства и недостатки не для того, чтобы исключить использование этого метода на практике. В каждом отдельном случае необходимость использования тех или иных методов определяется конкретной задачей. В литературе иногда включают в качестве ключевого слова название этого метода просто как «микроинъекция веществ в клетку». Следует всегда уточнять, что имеется в виду, и не путать с другими, пусть даже сходными по своей сути методами, к одному из которых относится метод микроинъекции при помощи липосом. 3.2. Липосомы Под липосомами часто понимают искусственно созданные липидные (чаще фосфолипидные) пузырьки, полученные путем диспергирования высокоочищенных липидов в растворах, не содержащих ионов Са++ и Mg++. В частности, широко используется фосфатидилхолин, фосфатидилсерин и др. Способы получения липосом описаны в обзоре (Fraley, Papahadjopoulos, 1982). Большое разнообразие способов связано не только с областями применения этих структур. Метод получения липосом весьма чувствителен к чистоте липидов, содержанию различных ионов и компонентов готовой смеси. Липосомы получают многослойные и однослойные. Они по-разному взаимодействуют с клеткой, обладают различными размерами, различной стабильностью и пр. Соответственно, для микроинъекции различных веществ липосомы имеют ряд преимуществ и недостатков. Достоинства, которые свойственны отдельным видам липосом: а) простота получения; б) способность сохраняться длительное время; в) возможность обрабатывать очень большое количество клеток (так же, как метод микроинъекции при помощи «теней» эритроцитов);
г) отсутствие прямого цитотоксического действия на клетку; д) отсутствие ограничения размеров молекул, которые можно заключить в липосомы; е) независимость введения макромолекул от проницаемости мембран клеток; ж) возможность изменять размеры, заряд, текучесть и стабильность липосом в среде; з) можно модифицировать поверхность липосом для придания ей избирательного «сродства» к клеткам, что повышает способность липосом сливаться с клетками, путем введения гликолипидов, лектинов, ковалентно связанных антител. Недостатки: а) многие липиды могут взаимодействовать с заряженными группами инъецируемых молекул; б) при образовании липосом возможны повреждения молекул (например, нуклеиновых кислот), предназначенных для микроинъекции; в) широкий спектр дисперсности (диаметр липосом может быть от нескольких десятков микрометров до десятых долей микрометров), что может сказаться на недостаточной эффективности загрузки инъецируемых молекул, особенно если это молекулы с высоким молекулярным весом; г) при «озвучивании» могут происходить повреждения или разрывы больших макромолекул; д) слишком высокая концентрация липосом может быть токсичной для клеток (это зависит как от типа клеток, так и от состава липосом); е) однослойные липосомы могут быть чрезвычайно маленькими по размерам (объему) и плохо сливаться с клетками. Рассмотренные выше методы инъекции веществ в клетки при помощи липосом (мембранных фосфолипидных пузырьков) и при помощи «теней» эритроцитов во многом сходны между собой. При этом перечисленные достоинства и недостатки далеко не исчерпывают всех тонкостей частного применения мембранных «контейнеров», приготовленных тем или иным способом. Однако прямым и целенаправленным методом введения веществ и отдельных органелл в клетку является в настоящее время микроинъекция под давлением через стеклянные микропипетки.
Глава 4. Микроинъекция под давлением — прямой метод направленного введения веществ, органелл и генетического материала в клетку
4.1. Общие принципы метода
Микроинъекция под давлением является одним из самых распространенных методов направленного, количественного введения различных веществ и некоторых органелл в отдельную клетку. Одним из важных отличий этого метода по сравнению с другими является его «оперативность». При помощи микроинъекции под давлением можно быстро и эффективно ввести необходимое количество веществ в клетку, удалить отдельные компоненты и проделать другие манипуляции для реконструкции клеток можно пересадить органеллы. Именно этот метод предоставляет уникальную возможность для исследования ядерно-цитоплазматического взаимодействия, удаления или комбинирования компонентов клетки и т.п. Он может быть как основным микрохирургическим методом, так и использоваться в сочетании с другими методами, например, электрослиянием выделенных органелл и частей целых клеток при решении таких задач, как клонирование клеток, эмбрионов или отдельных особей. Принцип этого метода заключается в следующем: вещества или органеллы вводятся в клетку через тонкий стеклянный капилляр (микропипетку) под давлением, создаваемым дозатором. Простая схема микроинъектора для такой инъекции в клетку представлена на рисунке 9, где в виде дозатора может быть шприц или микрошприц, а микропипетка устанавливается в специальный держатель микроманипулятора.
Мы не касаемся здесь теории и математического аппарата этого метода. Наша цель — показать, в каких случаях и как использовать этот метод на практике, и дать сравнительную характеристику его достоинств и недостатков, так как именно в таком описании, как мы считаем, подчас можно найти более или менее объективную информацию о возможностях метода и о необходимых предосторожностях, позволяющих избежать возникновения артефактов.
4.2. Достоинства и недостатки метода микроинъекции под давлением
1. Возможна относительно высокая точность микроинъекции. 2. Количественная оценка инъецируемых растворов, сравнительно не сложная и в большинстве случаев доступная. 3. Есть возможность вводить в клетку вязкие растворы, отдельные фрагменты клетки или органеллы, различные красители и инородные частицы. 4. Можно вводить растворы веществ и органеллы в определенную часть клетки (самое важное достоинство этого метода). 5. Имеется возможность вводить в клетку как большие объемы растворов, так и следовые их количества (до нескольких молекул). 6. Количество инъецируемого вещества не зависит от его электрохимических свойств. 7. Засорение микропипетки в большинстве случаев можно ликвидировать прокачиванием раствора через кончик. 8. При инъецировании под давлением нет противотока из клетки в полость микропипетки. 9. При низких скоростях инъекции клетка почти не травмируется, кроме механических повреждений в месте прокола, но их можно свести к минимуму. 10. Микроинъекция под давлением отличается от микроэлектрофореза высокой оперативностью, то есть проведением многодозовых инъекций с относительно большой частотой. 11. Двухканальные и многоканальные микропипетки дают возможность использовать сразу несколько растворов веществ или производить различные микроманипуляционные операции.
12. Всегда есть возможность остановить поток диффундирующего в клетку раствора из кончика микропипетки созданием отрицательного давления дозатора. Эти выводы являются результатом анализа многих литературных работ и собственных экспериментов. Однако они не претендуют на полноту. Так, например, Роберт Мич (Meech, 1981) представляет несколько в другом виде преимущества этого метода. Приведем их здесь полностью: 1. Можно инъецировать незаряженные вещества или вещества с низкой электрофоретической подвижностью (такие, как масла или некоторые красители для внутриклеточного окрашивания). 2. Можно инъецировать сложные растворы (например, буферы Ca/ЭГТА и соединения, недоступные в чистой форме). 3. Микроинъекция удобна для введения красителей в большие области клетки, что в других случаях требует продолжительного ионофореза (например, нейроны Aplysia). 4. Удобна для инъецирования веществ, быстро разрушающихся или изолируемых (ионы кальция). 5. Инъекционная пипетка может быть использована для записи изменения потенциала или введения тока. Записи идут с места наибольшего изменения концентрации. 6. Имеется линейная связь между вводимым объемом и либо приложенным давлением, либо продолжительностью импульса давления. Это означает, что каждую микропипетку можно быстро откалибровать (McCaman et al.,1977). 7. Жидкость вводят в клетку с минимальным повреждением цитоплазмы (Nicaise and Meech. 1980).
Надо учитывать, однако, что в ряде случаев даже некоторые достоинства метода могут оказаться нежелательными для частных задач, в то время как некоторые недостатки метода могут быть полезны на практике. Приведем несколько примеров. Микроинъекцию вязких растворов или изолированных органелл можно производить микропипетками небольших диаметров (от 0.5 до 20.0 мкм). Скорость инъекции и разность давлений полностью определяют возможность сохранить нативным вязкий раствор или органеллы. При малых диаметрах микропипеток и больших давлениях это особенно явно проявляется. При очень больших скоростях и давлении при инъекции вязких растворов или органелл может, по-видимому, происходить гидродинамическое разрушение структур. Другой пример: при отсутствии давления или при отрицательном давлении в полости микропипетки возможен вход веществ из клетки в эту полость, что само по себе является недостатком для метода микроинъекции. Тем не менее, этот момент можно использовать, например, во время пересадок клеточных ядер при заполнении микропипеток отдельными органеллами для дальнейшей их инъекции в другую клетку. В определении недостатков метода микроинъекции под давлением Мич отличает лишь один: «Он менее успешен с клетками, меньшими в диаметре 50 мкм, и при использовании для внутреклеточного окрашивания он иногда повреждает тонкие процессы в нейроне (Kater et al, 1973)». Мы считаем необходимым отметить здесь гораздо больше недостатков, которые, тем не менее, не могут умалить очевидных достоинств метода. Однако многие недостатки могут вносить свои коррективы на пути решения поставленных перед экспериментатором задач.
4.3. Ограничения метода
1. Большая зависимость скорости высвобождения раствора от диаметра кончика микропипетки (скорость пропорциональна третьей степени внутреннего диаметра кончика). Однако, если скорость не лимитирует, то малые размеры (диаметры) кончиков микропипеток являются достоинством этого метода. Для линейных молекул, кальциевых комплексных соединений, малый диаметр кончика не всегда играет положительную роль. 2. При одинаковом давлении из разных микропипеток (с различным диаметром, конусностью, гидрофобностью внутренней поверхности) высвобождается различное количество вещества. Такую многопараметровую систему очень трудно точно учесть при калибровке. 3. При отсутствии давления в микропипетке возможна спонтанная диффузия вещества в клетку или наоборот — выход веществ из клетки или раствора в полость микропипетки. 4. Не всегда возможен контроль количества инъецируемой жидкости по лимбу дозирующего устройства или по показаниям манометра. Особенно это касается очень малых диаметров кончика или нескольких растворов разной вязкости. 5. Гибкие шланги и сочленения могут создавать паразитную деформацию при повышении давления в микропипетке, что приводит к ошибкам при дозировании, так как во время установления равновесия после микроинъекции вводимый объем значительно увеличивается. 7. Использование микропипеток с малым диаметром кончика требует применения тщательно очищенных растворов (от кристаллов, сгустков, частичек) и исключает использование насыщенных растворов. 8. В процессе многодозовых микроинъекций белковых растворов микропипетки с малым диаметром кончика могут постепенно «обрастать», забивая его просвет, что приводит к неравномерному выходу жидкости. Для микропипеток с малым диаметром кончика необходим визуальный контроль за передвижением мениска жидкости или периодический контроль дозируемых объемов. 9. При очень высокой скорости истечения жидкости из кончика микропипетки поток ее (струя, трек) может повредить клетку и внутриклеточные структуры в целом. 10. На наружной поверхности микропипетки остаются следы вводимого вещества, а также следы цитоплазмы и мембраны после микроинъекции. Комментарии и замечания к каждому пункту, характеризующему достоинства и недостатки метода, с подробным разбором их особенностей, будут рассмотрены в практическом ключе в публикуемой работе. В настоящее время этот метод становится, по-видимому, одним из самых распространенных инструментов в исследовании живой клетки и в разработке новых технологий.
4.4. Области применения микроинъекции под давлением
Список областей применения микроинъекции под давлением представлен в таблице.
Глава 5. Краткий обзор истории развития техники микроинъекции под давлением
5.1. Введение
Развитие техники и методов микроинъекции и микроманипуляции связано с успехами развития естественных наук, таких, как цитология, микробиология и медицина. Одна из первых монографий по технике микроманипуляции с микрооптическими объектами и технике микроинъекции Пьера Фонбрюна — «Техника микроманипуляции» (1951) была опубликована в научных трудах Пастеровского института. В настоящее время, в эпоху становления и бурного развития генетической и клеточной инженерии, молекулярной биологии и биотехнологии, вновь увеличивается интерес к технике микроманипуляции и микроинъекции, постоянно растет спрос и множатся предложения различных конструкций микропипеток и микроинъекторов для введения веществ в клетку, приборов и устройств, позволяющих работать с клеткой под микроскопом, позволяющих оперировать клетку и производить пересадку внутриклеточных органелл из клетки в клетку. По мнению ряда авторов (Перфильев, Габе, 1961; El-Badry, 1963; Meech, 1981), основоположником методики микроинъекций в клетки под давлением следует считать Маршаллa А. Барбера (Barber, 1911, 1914). Им созданы первые образцы микропипеток и микроинъекторов. Кроме того, он как бы предвидел большое значение этой техники в будущем. Еще в начале века (Barber, 1911) писал: «Автору представляется, что эта техника в различных формах поможет разрешить различные проблемы биологии микроскопических растений и животных. В конце концов, можно удалять материал из одной клетки и инъецировать в другую, и возможно, что исследования оплодотворения и наследственности могут быть расширены с помощью такой техники» (цитируется по Meech, 1981). Рассмотрим некоторые основные типы конструкций микроинъекторов, которые могут помочь сориентироваться на практике при выборе той или иной техники для решения частных задач по микроинъекции и, быть может, усовершенствовать уже имеющуюся в лаборатории установку для инъекции, помочь учесть ее отдельные недостатки и выявить, применить и расширить на практике ее достоинства.
5.2. Пипетка для микроинъекций Барбера
Пипетка для микроинъекций Барбера (Barber, 1911, 1914) — это микропипетка, у которой один конец оттянут, а другой, широкий, заполнен ртутью и запаян. Запаянный широкий конец с ртутью, выполненный в виде кольца или спирали, погружается в охлажденную смесь или теплую воду. Меняя таким образом температуру конца трубки с ртутью (вынимая его из охлажденной смеси на воздух или погружая в смесь с другой температурой) и изменяя тем самым объем ртути, добиваются перемещения мениска инъецируемой жидкости микропипетки, необходимого для контроля микроинъекции или, наоборот, для засасывания растворов в полость микропипетки. Объемы инъецируемых растворов могут варьировать в самых широких пределах. Этот тип микроинъектора может быть отнесен к медленно работающим, так как до полной остановки мениска проходит несколько десятков секунд или даже минут (до окончательной установки температуры). Для изменения температуры Барбер, помимо ванночек с различной температурой, использовал резиновый баллон с маслом, в который вставлялась маленькая лампочка в качестве нагревателя. Небольшое количество жидкости инъецировать таким способом достаточно трудно, так как для этого необходимо создать очень маленькую разность температур. Еще трудней создавать термоизолирующие условия, чтобы стабилизировать верхний и нижний пределы температуры. Тем не менее, принцип, заложенный в таком способе, иногда может быть полезен, например, для экстракции отдельных внутриклеточных органелл или цитоплазмы при микрохирургических операциях на клетке, когда требуется очень медленное перемещение жидкости в полость микропипетки. Первоначально Барбер использовал микропипетку для отбора отдельных микроорганизмов в микробиологической практике, и она в свое время, по-видимому, удовлетворяла таким целям. Использование такой системы, заполненной ртутью и инъецируемой жидкостью, позволяет проводить микроинъекции вязких растворов через кончик микропипетки, имеющей минимальный диаметр (0.1 — 1.0 мкм). Кроме того, в некоторых пределах расширение ртути пропорционально температуре, и может сделать незаменимой ее использование при инъекциях точно калиброванных объемов. Однако при этом необходимо осуществлять строгий контроль небольших (до десятых или даже сотых долей градуса Цельсия) изменений температуры во всей системе: микропипетка — трубка — термостат. Вся сложность использования температуры для малых и точных доз инъецируемого материала в том, что изменение температуры происходит не скачкообразно с момента начала этого изменения, а асимптотически — до момента установления необходимой температуры. Особо следует отметить, что работать с ртутью следует очень осторожно, в специально созданных условиях (главным образом, в вытяжных шкафах) и с выполнением всех необходимых правил техники безопасности.
На рисунке представлен общий вид микроманипулятора (салазочно-винтового типа, закрепленного на микроскопе) с тремя координатами перемещения микропипетки. Как видно из рисунка, микроманипулятор имел вид вполне современной конструкции.
5.3. Микроинъектор Чемберса Микроинъектор Чемберса (Chembers, 1921, 1923) создан для инъекции веществ в живые клетки под микроскопом. Это, собственно, прототип выпускаемого в настоящее время микроинъектора для микроманипулятора фирмы «Leitz». Вначале это был тонкостенный стальной цилиндр, заполненный ртутью. Деформация этого цилиндра с упругими стенками обеспечивает производство микроинъекций. Позже автор предложил использовать вместо металлического цилиндра тщательно подобранный стеклянный шприц без утечки между поршнем и стеклянным цилиндром. Шприц и микропипетка соединялись тонкой металлической трубкой, эластичной за счет своей длины, изгибов или витков спирали, выполненных по ходу всей трубки. Наличие таких трубок на микроинъекторе является большим качественным шагом в усовершенствовании микроинъекторов. Так, микроскоп, микроманипулятор и микроинъектор закрепляются на массивном плато для того, чтобы как-то избежать посторонних вибраций. Шприц закрепляется на плато микроманипулятора в наклонном положении, удобном для работы, и соединяется с микропипеткой металлической трубкой длиной до 1 метра. Металлическая трубка в нескольких местах скручена в спираль, что позволяет обеспечить для микропипетки достаточную подвижность при установке ее на микроманипулятор. Высокая чувствительность достигается тем, что вся система микроинъектора заполняется ртутью, маслом или водой без пузырьков воздуха, а сочленения шприца и микропипетки практически не претерпевают деформации при создании высоких давлений в системе микроинъектора. Чемберс одним из первых выдвинул идею передачи давления от шприца (датчика давления) к инъецируемому раствору с использованием гидравлики. При этом он исходил из того, что жидкость (ртуть, масло или обезгаженная при помощи кипячения вода), в отличие от воздуха, почти несжимаема и через нее можно получать тонкие и плавные перемещения инъецируемого раствора, проходящего через кончик микропипетки. Заметим, что Чемберс предлагал использовать дважды дистиллированную воду (с целью ее дегазации), так как в обычной воде растворено большое количество воздуха, и создание даже небольшого отрицательного давления в системе гидропровода и шприца может повлечь за собой образование мелких воздушных пузырьков, которые быстро собираются в большие пузырьки и являются большой помехой во время микроинъекции.
5.4. Микропипетка Петерфи
Микропипетка Петерфи (Peterfi, 1923) — это практически готовый микроинъектор, имеющий дозатор в виде платиновой спирали накаливания, кран для сброса давления внутри пипетки, а также герметическую систему для заполнения пипетки инъецируемой жидкостью через ее кончик.
Отросток с краном может служить и для того, чтобы через него медицинским шприцом заполнить микропипетку инъецируемой жидкостью, заменить ее каким-либо другим раствором или промыть внутреннюю полость пипетки. Изменение (увеличение) давления в микропипетке производят при помощи спирали накаливания, пропуская через нее электрический ток от аккумулятора (до 2-х вольт). Нагретая до необходимой температуры спираль (регулировку тока производят реостатом), нагревает воздух внутри пипетки, который, расширяясь, выталкивает жидкость из кончика пипетки. Выключение или уменьшение тока в цепи спирали накаливания приводит к охлаждению воздуха внутри пипетки и, как следствие, к всасыванию жидкости в полость микропипетки. Недостатком такой микропипетки является разогрев стекла в области накаливания, который значительно увеличивает время остановки процесса забора жидкости или окончания микроинъекции, когда необходимо четко остановить вытекание жидкости из кончика пипетки. Кроме того, полностью заполнять всю пипетку жидкостью не имеет смысла, так как в области спирали накаливания образуются воздушные (газовые) пузырьки, которые накапливаются и являются помехой для точной дозировки инъецируемой жидкости в случае использования микропипеток, имеющих кончик диаметром меньше 1-2 мкм. Если на кончик оттянутого участка пипетки Петерфи устанавливать съемные микропипетки, как было описано у Тейлора, данную систему можно применять и для микроинъекций растворов в крупные клетки, например, ооциты земноводных и рыб.
5.5. Микроинъектор Тейлора Микроинъектор Тейлора (Taylor, 1925) представляет собой в принципе идеальный и достаточно широко распространенный в настоящее время прототип микроинъектора и, по-видимому, на эту конструкцию следует обратить особое внимание. Одним из первых вариантов этого инъектора было простое устройство, состоящее из стеклянного капилляра, заполненного ртутью, один конец которого закрывался резиновой пробкой, а другой был соединен с микропипеткой. Через резиновую пробку пропускали стальную иглу, которая служила поршнем, выталкивающим ртуть. Иглу с мелкой резьбой у основания перемещали за счет вращения. Недостатком такого поршня являлось его движение вокруг собственной оси при продольном перемещении, что приводило к быстрому износу резины и, следовательно, образованию утечки ртути. Другой наиболее известный вариант микроинъектора Тейлора состоит из П-образной стеклянной трубки с отростком, к которому на цементе крепится стеклянная микропипетка (Рис.4).
Такое сочленение в настоящее время практически не встречается, так как микропипетка всегда является одноразовой, как с целью стерильности, так и для случая смены ее при засорении или поломке. В двух широких концах П-образной трубки находятся поршни из плотного каучука, перемещаемые при помощи двух винтов. Один винт (на рис. сверху) имеет крупную резьбу, другой — очень мелкую резьбу (40 оборотов на 1 сантиметр). Два винта позволяют быстро устанавливать мениск, образующийся между инъецируемой жидкостью и маслом, разделяющий этот раствор от ртути или воды, находящейся в полости микроинъектора. Этот мениск находится в области кончика микропипетки. При помощи таких винтов можно с высокой точностью перемещать мениск в процессе микроинъекции. Такой принцип сочетания «грубой» и «тонкой» регулировки давления в системе микроинъектора очень часто используется в настоящее время на практике. Это связано прежде всего с использованием растворов с различной вязкостью и для микропипеток, имеющих достаточно широкий диапазон диаметров (от 0.1 — 0.2 мкм до 2 — 3 мкм). Внутренняя полость стеклянной П-образной трубки заполнена ртутью или кипяченой (для удаления растворенного воздуха) водой. Чувствительность таких микроинъекторов чрезвычайно высокая, особенно если учесть, что в рассматриваемом микроинъекторе большей частью полностью отсутствуют демпфирующие элементы сочленения из пластика или резины. Поршни при этом должны быть весьма жесткими, например, их можно было бы изготовить из современного материала — тефлона, как изготавливают поршни шприцов на фирме Гамельтон (Hamelton). К недостаткам микроманипулятора относятся: отсутствие отсчетной шкалы (лимба) на винтах «грубой» и «тонкой» регулировки; громоздкие размеры, не позволяющие использовать его на позиционерах микроманипуляторов отечественного и зарубежного производства; отсутствие дистанционного управления, столь необходимого для такой монолитной системы, как рассматриваемый микроинъектор Тейлора (это, к сожалению, является недостатком практически всех винтовых микроманипуляторов). Кроме того, наличие слишком эластичных поршней может сказаться на образовании разнообъемных доз инъекций. Из конструкции микроманипулятора Тейлора следует, что создавать положительное давление в полости микропипетки двумя винтами можно до достаточно высоких значений. При этом, если винты после этого не трогать, то давление в конце концов в полости микропипетки выравнивается за счет стравливания его через кончик микропипетки. Так как резиновые поршни механически не связаны с винтами, как это следует из рисунка, нет возможности производить постоянное отрицательное давление в полости микропипетки. Небольшое отрицательное давление создается выкручиванием винтов только после сдавливания резиновых поршней. Обсуждение недостатков микроинъектора Тейлора с учетом и многих его достоинств может быть полезным при использовании таких или подобных микроинъекторов на практике.
5.6. Микроинъектор Хиншоу Микроинъектор Хиншоу (Hinshaw,1831, цитируется по Перфильеву, 1961), называемый автором просто микропипеткой, прост по своему принципу, но заслуживает внимания, так как фактически представляет собой, в целом, устройство, состоящее из микроманипулятора, закрепленного на тубусе микроскопа и управляемого винтами, системой кремальер и пружинами. Микроинъекция осуществляется поворотом винта, который перемещает рычаг, закрепленный на оси. Нижнее плечо рычага при этом производит сжатие резинового колпачка, соединенного с микропипеткой. Такой микроинъектор может найти применение только с микропипетками, имеющими большие диаметры кончиков (не менее 5-10 мкм).
Такой микроманипулятор имеет недостатки. Создание давления в полости микропипетки (1) при помощи резинового колпачка (5) не является идеальным, так как не создает прямо пропорционального изменения давления от поворота управляющего винта (4). Отсутствие лимба, по которому мог бы производиться хотя бы приблизительный отсчет доз, и отсутствие дистанционного управления для снижения вибрации микропипетки, находящейся на винтовом микроманипуляторе, в процессе инъекции делает такой микроинъектор пригодным, по-видимому, только для манипулирования с изолированными клетками и для фиксации клеток, часто необходимой при микроинъекции. Самым большим недостатком является то, что все микроинъекции производятся при непосредственном контакте руки оператора с микроинъектором, то есть все вибрации от руки тут же передаются на кончик микропипетки и при отсутствии дистанционного управления микроинъектором выполнить тонкие операции практически очень трудно.
5.7. Микроинъектор Голлербаха Микроинъектор Голлербаха М.М. (цитируется по Перфильеву, 1961) сходен с микроинъектором Хиншоу и отличается тем, что микропипетка соединена с резиновой грушей гибкой трубкой и управляется отдельно от нее при помощи кремальерного микроманипулятора (Рис.14). Устройство микроинъектора чрезвычайно простое, и он может быть собран практически в любой лаборатории.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 155; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.118.198 (0.074 с.) |

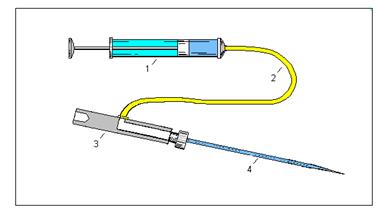


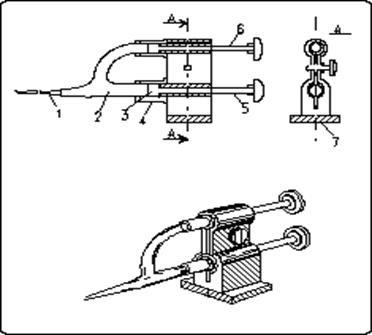

 Рис. 13. Кремальерный микроманипулятор Хиншоу с микроинъектором:
1 — стеклянная микропипетка; 2 — зажимной винт; 3 — кремальерное устройство для перемещения микропипетки по 3 –м координатам; 4 — винт для микроинъекции; 5 — резиновый колпачок
Рис. 13. Кремальерный микроманипулятор Хиншоу с микроинъектором:
1 — стеклянная микропипетка; 2 — зажимной винт; 3 — кремальерное устройство для перемещения микропипетки по 3 –м координатам; 4 — винт для микроинъекции; 5 — резиновый колпачок



