Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Разложение кислородсодержащих кислот
В результате реакции разложения кислородсодержащих кислот всегда образуется вода и оксид.
Из приведённых выше реакций можно увидеть, что карбоновая легко разлагается при обычных условиях, так как является одной из самых слабой кислотой. Для разложения сернистой и кремниевой кислоты их растворы необходимо нагреть. Во всех трёх реакция в результате образуется вода и оксиды кислотных остатков. Характерные химические свойства солей: средних, кислых, оснóвных; комплексных (на примере соединений алюминия и цинка) Соли –это сложные вещества, которые являются продуктами замещения атомов водорода в молекулах кислот атомами металлов. Общим способом получения солей является взаимодействие оснований с кислотами: NaOH + HCl = NaCl + H2O (так же эту реакцию называют реакцией нейтрализации, т.к. соли не имеют среды – она нейтральна) Общая формула солей: Me x (Ac) y, где
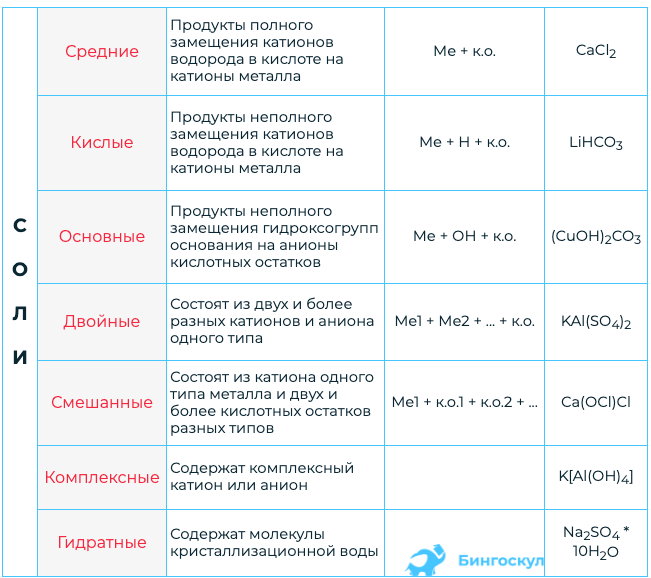
Классификация солей
(III) Приставка «ди» используется, если в молекуле основной соли с одним атомом Me связаны с гидроксильными группами. 1. Средние (нормальные) соли – это продукты полного замещения атомов водорода на металл. Название средней соли = название Ac + название Me + валентность Me o NaCl – хлорид натрия o Fe(NO3)2 - нитрат железа (II)
2. Кислые соли – это продукты неполного замещения атомов водорода на Me. Название кислой соли = «Гидро» или «Дигидро» + название Ac + название Me + валентность Me o NaHCO3 – гидрокарбонат натрия o KH2PO4 – дигидрофосфат калия
3. Основные соли – это соли, которые кроме ионов Me и Ac содержат гидроксогруппы. Название основной соли = «Гидроксо-» или «Дигидроксо-» + название Ac + название Me + валентность Me o CaOHCl – гидроксохлорид кальция o Ca(OH)2SO4 – гидроксосульфат кальция o Fe(OH)2NO3 – дигидроксонитрат железа
4. Комплексные соли – соли, содержащие комплексный ион. o [Ag(NH3)2]Сl – хлорид диаммин серебра (I) o [Cu(NH3)4]SO4 – сульфат тетрааммин меди (II) o K4[Fe(CN)6] – гексацианоферрат (II) калия Химические свойства солей I. Средние соли 1. Растворимые соли в водных растворах диссоциируют на ионы – катионы Me и анионы Ac. К примеру, хлорид калия в водном растворе распадается на катионы калия и анионы хлора. KCl ↔ K— + Cl—
2. Соли могут взаимодействовать с металлами, при этом каждый Me, стоящий левее в ряду напряжений Me, способен вытеснять Me, стоящие правее, из их солей. Щелочные и щелочноземельные металлы с солями реагировать не будут, так как вступают в реакцию с водой. Например, при взаимодействии сульфата меди с железом, происходит замещение меди железом, так как железо более активный металл, чем медь и находится в электрохимическом ряду напряжений левее водорода. CuSO4 + Fe → FeSO4 + Cu↓ При взаимодействии сульфида железа с цинком происходит тот же процесс, но в данной реакции более активным металлом является цинк. Цинк вытесняет железо из соединения, в результате происходит образование чистого железа. FeS + Zn → ZnS + Fe↓ 3. Реакция растворов солей с растворами щелочей возможна в том случае, когда образующиеся основание или соль выпадают в осадок. Взаимодействие хлорида железа (III) с раствором гидроксида калия является качественной реакцией на ионы Fe3+. Продуктом реакции будет гидроксид железа (III), который представляет собой бурый осадок с амфотерными свойствами. FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl 4. При взаимодействии соли с кислотой, для того чтобы осуществилась реакция, необходимо образование более слабой кислоты или нерастворимой соли. В представленной ниже реакции осуществляется взаимодействие между хлоридом бария и серной кислотой. Продуктами реакции являются нерастворимая соль и сильная кислота. Данная реакция является качественной на сульфаты, так как образуется сульфат бария – осадок белого цвета. BaCl2 + H2SO4 → BaSO4↓ + 2HCl 5. Для солей характерно взаимодействие между собой. В этом случае одним из продуктов реакции должна быть нерастворимая соль. Взаимодействие нитрата серебра с хлоридом калия сопровождается выпадением осадка белого цвета – хлорида серебра. Эта реакция является качественной на хлорид-ионы. AgNO3 + KCl → AgCl↓ + KNO3 6. При нагревании разлагаются соли слабых кислот, соли аммония, а также образованные сильными окислителями или восстановителями. o Все карбонаты при термическом разложении распадаются на основный оксид и углекислый газ.
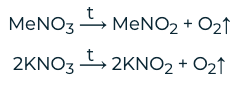
o При разложении нитратов следует учитывать следующие условия:
§ Если металл находится в ряду напряжений левее магния, то в результате реакции образуется нитрит и кислород. Реакция протекает по следующей схеме:
§ Если металл расположен в электрохимическом ряду напряжений между магнием и медью, при этом будет происходить образование оксида металла, диоксида азота и кислорода.
§ Если металл находится в ряду напряжений металлов правее меди, при этом наблюдается образование металла, оксида азота (IV) и кислорода.
o Разложение солей аммония также может протекать по-разному. Во многом это зависит от того, каким кислотным остатком она образована. § Если в состав соли аммония входит кислотный остаток летучей кислоты, то в результате будет образовываться аммиак и летучая кислота.
§ Если соль аммония образована нелетучей кислотой, то продуктами реакции будет аммиак и кислая соль.
§ Если кислотный остаток соли проявляет окислительные свойства, то в результате разложения образуется молекулярный азот или оксид азота (I).
II. Кислые соли 1. Растворимые соли в водных растворах диссоциируют на ионы – катионы Me и сложный анион Ac. Диссоциация протекает в две стадии. Первая стадия всегда необратима, по второй стадии протекает обратимая диссоциация. KHSO4 → K— + HSO4—
2. Кислые соли могут взаимодействовать с металлами, стоящими левее водорода. Не стоит в таких реакциях использовать щелочные металлы, так как они прежде всего реагируют с водой. Реакция щелочных металлов с водой протекает бурно с выделением большого количества энергии, при таких условиях может произойти взрыв. В результате данной реакции образуется средняя соль и водород. Гидросульфат калия при взаимодействии с магнием образует в качестве продуктов реакции молекулярный водород, сульфаты магния и калия. 2KHSO4 + Mg → H2↑ + MgSO4 + K2SO4
3. При взаимодействии кислой соли с раствором щелочи образуется средняя соль и вода. Гидрокарбонат натрия способен вступать в реакцию с раствором щелочи, продуктами реакции будут сульфит натрия и вода. NaHCO3 + NaOH → Na2SO3 + H2O
4. При взаимодействии соли с кислотой, для того чтобы осуществилась реакция, необходимо образование более слабой или летучей кислоты. Этот процесс можно рассмотреть на примере реакции гидросульфида калия с серной кислотой. Продуктами реакции является летучая кислота – сероводородная, а также сульфат калия. 2KHS + H2SO4 → K2SO4 + 2H2S
5. Для кислых солей характерно взаимодействие со средними солями. Однако, при такой реакции должны образоваться вода, газ или осадок. В противном случае взаимодействие происходить не будет. Очень хорошо это просматривается на примере взаимодействия гидросульфата калия и хлорида бария. Продуктами реакции будут сульфат бария – осадок белого цвета, сульфат калия и хлороводородная кислота. 2KHSO4 + BaSO4↓ + K2SO4 + 2HCl
6. При нагревании некоторые соли разлагаются. Ярким примером может служить разложение гидрокарбонатов. В результате реакции образуется вода, углекислый газ и карбонат натрия.
Реакции разложения гидрокарбонатов кальция и магния являются причиной образования накипи в водонагревательных приборах.
III. Основные соли 1. Способны в водных растворах разлагаться на сложные катионы и анионы Ac. Диссоциация проходит в несколько ступеней, причем по первой ступени разложение проходит необратимо. Все последующие ступени протекают обратимо.
Al(OH)2CH3COO → Al(OH)2+ + CH3COO—
2. Основные соли могут взаимодействовать с растворами щелочей с образованием нерастворимого основания и кислой соли. Гидроксонитрат железа (III) и раствор едкого калия при взаимодействии друг с другом образуют нитрат калия и гидрокисд железа (II) – осадок белого цвета. Fe(OH)NO3 + KOH → Fe(OH)2↓ + KNO3
3. При взаимодействии основной соли с кислотой, образуется средняя соль и вода. Взаимодействие гидроксохлорида меди (II) и соляной кислоты протекает с образованием хлорида меди (II) и воды. CuOHCl + HCl → CuCl2 + H2O
4. Характерно термическое разложение основных солей. При разложении дигидроксокарбоната меди (II) образуется оксид меди (II), углекислый газ и вода.
IV. Комплексные соли 1. Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы, то есть как сильные электролиты (первичная диссоциация). K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4— Комплексные ионы, в свою очередь, диссоциируют как слабые электролиты, многоступенчато и обратимо. Это - вторичная диссоциация комплексных ионов. [Fe(CN)6]3— ⟷ [Fe(CN)5]2— + CN— Данную многоступенчатую диссоциацию можно выразить суммарно в виде следующего уравнения: [Fe(CN)6]3— ⟷ Fe3+ + 6CN—
2. Комплексные соли способны вступать в реакции обмена со средними солями. В результате такой реакции образуется две другие соли – комплексная и средняя. FeCl3 + K4[Fe(CN)6] = Fe4[Fe(CN)6]↓ + 3KCl Данная реакция является качественной реакции на ионы Fe3+. Нерастворимое соединение, образовавшееся в результате реакции, обладает ультрамариновым цветом и получило название «берлинской лазури» или гексацианоферрат(II) железа(III)-калия.
3. При нагревании комплексных солей происходит их разложение. Тетрагидроксоалюминат натрия распадается на алюминат натрия и воду. Na[Al(OH)4] → NaAlO2 + 2H2O
4. При взаимодействии комплексной соли со средней, происходит разрушение комплексов за счёт образования малорастворимых соединений. 2[Cu(NH3)2]Cl + K2S → CuS↓ + 2KCl + 4NH3↑ Электролитическая диссоциация (ЭД) электролитов в водных растворах. Сильные и слабые электролиты
|
||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 726; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.90.141 (0.024 с.) |