
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ташкентский химико-технологический институтСтр 1 из 13Следующая ⇒
МИНИСТЕРСТВО ВЫСШЕГО И СРЕДНЕГО СПЕЦИАЛЬНОГО ОБРАЗОВАНИЯ РЕСПУБЛИКИ УЗБЕКИСТАН
ТАШКЕНТСКИЙ ХИМИКО-ТЕХНОЛОГИЧЕСКИЙ ИНСТИТУТ
На правах рукописи УДК 678.063. 541.64.
Кафедра «ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ ПЕРЕРАБОТКИ НЕФТИ И ГАЗА»
М АНСУРОВА М АДИНА А ЛЬБЕРТОВНА
ОЧИСТКА ОТРАБОТАННЫХ АМИНОВЫХ РАСТВОРОВ ОТ ПРОДУКТОВ ДЕГРАДАЦИИ ДИССЕРТАЦИ ОННАЯ работа на соискание ученой степени магистра по специальности 5А321302 – Технология переработки нефти и газа
Научный руководитель, к.х.н., доцент Каримов К.Г.
Представлено к защите на основании решением заседания кафедры «Химическая технология переработки нефти и газа» №____ от “__”______2013 года
Заведующий кафедры, к.х.н. Зиядуллаев О.Э.
Начальник отдела «Магистратура», к.т.н., доцент Мухамедов К.Г.
ТАШКЕНТ – 2013
ОГЛАВЛЕНИЕ ВВЕДЕНИЕ.........................................................................................................3 ГЛАВА I. Литературный обзор 1.1. Современные методы очистки углеводородных газов от сернистых соединений……………………………………………………………………...5 1.1.1. Очистка газов физическими и комбинированными поглотителями…8 1.1.2. Методы очистки газов от трудноудаляемых примесей……………...14 1.1.3. Выбор метода очистки кислых газов………………………………….18 1.2. Физико-химические свойства алканоламинов и их водных растворов………………………………………………………………………20 1.3. Химизм взаимодействия Н2S, CО2 и других компонентов с алканоламинами………………………………………………………………25 ГЛАВА II. Объекты исследования 2.1. Образование продуктов деградации в аминовых растворах…………..30 2.2. Осмоление аминовых растворов………………………………………...37 2.3. Пенообразование на установках очистки кислых газов……………….38 2.4. Коррозия аппаратуры…………………………………………………….42 ГЛАВА III. Технологическое оформление процесса 3.1. Наиболее перспективныетпроцессы аминовой очистки………………50
3.2.Теехнологическое оформление установок аминовой очистки газов…52 3.3. Технические решения, положенные в основу проекта………………...55 3.3.1 Описание технологической схемы…………………………………….61 3.3.1.1. Блок очистки газа................................................................................61 3.3.1.2. Блок регенерации раствора амина…………………………………..63 3.3.1.3. Блок фильтрации раствора амина…………………………………...64 3.4. Области использования получаемых продуктов……………………….67 ЗАКЛЮЧЕНИЕ ……………………………………………………………...69 СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ …………………..….71 ПРИЛОЖЕНИЕ ……………………………………………………………...76
ВВЕДЕНИЕ Актуальность проблемы. Узбекистан богат природными ресурсами, одним из которых является природный газ. В настоящее время использование природного газа, являющегося экологически чистым видом ископаемого топлива и химического сырья, покрывает ~25% мировой потребности в нем, а в настоящее время эта доля будет увеличиваться [2]. Как известно, природный газ содержит агрессивные компоненты, помимо токсичного и коррозионно агрессивного сероводорода, природные газы содержат СО2, тиолы, СОS, CS2 и алкилсульфиды, которые должны быть извлечены на начальной стадии переработки газа [3, 4]. Как показал анализ мировой практики, одним из лучших методов очистки природного газа от агрессивных компонентов, в частности от сероводорода является абсорбционный метод с использованием аминовых растворов. Как известно, этаноламины подвержены деградации в реакциях с кислородом по нескольким направлениям: - это прямое окисление амина до органических кислот и косвенная реакция кислорода с сероводородом до образования элементарной серы, которая затем реагирует с аминами и образуются дитиокарбаматы, тиомочевина и др.продукты. Третий способ разложения аминов под действием кислорода – это окисление H2S до более сильных кислотных анионов, таких как тиосульфат, который связывает амин в термоустойчивую соль. Вторичные продукты разложения аминов способствуют пенообразованию, потере активности аминов, уменьшении концентрации раствора.
Исследование процесса разложения и потери активности аминовых растворов и устранение этих негативных явлений является актуальной задачей Цель и задача работы. Осуществить подбор способов удаления продуктов деградации и разработать технологию этого процесса. В настоящее время эта проблема частично решалась фильтрованием отработанного раствора аминов через активированный уголь. Научная новизна. Предложен экстракционный способ очистки растворов аминов от вторичных продуктов окисления, разработана технология процесса. Объект и предмет исследования. Объектом исследования является природный газ и раствор алканоламина, а также экстрагент. Предметом исследования является увеличения степени очистки аминовых растворов, восстановления активности. Практическая значимость результатов исследований. Внедрение результатов исследований позволит уменьшит пенообразование, сокращается потери, способствует восстановлению активности аминовых растворов. Апробация работы. Содержание диссертационной работы доложено на научно-практической конференции «Умидли кимёгар 2013».
Таблица 1.1.1.1. Таблица 1.1.1.2. Избирательность физических поглотителей при атмосферном давлении и температуре 25 оС Поглотитель | Растворимость, м3/м3 | Избирательность, % | ||||||||
| СО2 | H 2 S | C3H8 | ECO2 | EH2S | |||||||
| Глютаронитрил | 2.65 | 11.5 | 1.16 | 2.29 | 9.91 | ||||||
| Диметилформамид | 4.86 | 38.1 | 3.89 | 1.25 | 9.79 | ||||||
| Диметиловый эфир ДЭГа | 4.63 | - | 4.68 | 0.99 | - | ||||||
| Метанол | 3.50 | - | 5.80 | 0.60 | - | ||||||
| Метилметоксиацетат | 3.41 | - | 2.34 | 1.46 | - | ||||||
| Метилцианоацетат | 3.22 | 10.7 | 1.34 | 2.40 | 8.2 | ||||||
| N-Метилпирролидон | 4.56 | - | 3.78 | 1.21 | - | ||||||
| Сульфолан | 2.82 | - | 1.22 | 2.31 | - | ||||||
| Триацетин | 3.54 | - | 3.03 | 1.17 | - | ||||||
| Триметилцианогидрин | 3.30 | 15.4 | 1.98 | 1.67 | 7.78 | ||||||
| Смесь этиленкарбоната (70% масс.) и припиленкарбоната (30%) | 3.07 | - | 0.94 | 3.27 | - | ||||||
| Смесь этиленкарбоната (70% масс.) и нитрометана (30%) | 3.25 | - | 1.14 | 2.85 | - | ||||||
В таблице 1.1.1.2 избирательность показывает отношение растворимости Н2S и СО2 в поглотителе к растворимости в нем пропана.
Влияние температуры и удельного расхода поглотителя на степень извлечения кислых компонентов из газа аналогично влиянию этих факторов на характер извлечения углеводородов из газовых смесей углеводородными абсорбентами.
Ограничением их широкого применения (помимо стоимости) является повышенная растворимость углеводородных компонентов газа в абсорбенте, что особенно критично при очистке жирного газа. Это усложняет технологическую схему процесса, приводит к повышенному содержанию углеводородов в кислом газе. Данная группа процессов не всегда может обеспечить глубокую степень очистки.
В качестве физических абсорбентов для очистки газов применяются различные классы соединений: алифатические спирты, эфиры гликолей, гетероциклические соединения и др.
Имеются данные о работе установок с использование в качестве рабочего вещества следующих физических абсорбентов: метанол, N–метилпирролидон, пропиленкарбонат, диметиловый эфир ПЭГ. В промышленности наибольшее распространение получили моно- и диалкиловые эфиры полиэтиленгликолей (ПЭГ), имеющие фирменное название "Селексол" и "Сепасолв" [23, 24].
При проектировании установки очистки основные решения относятся к выбору физического абсорбента и условий ведения процесса, определение параметров аппаратуры и технологии, обеспечивающих заданную степень очистки газа.
|
|
Синтетические цеолиты (NaA, CaA, NaX) обладают рядом уникальных свойств, отличающих их от адсорбентов других типов, из которых для целей сероочистки первостепенное значение имеют следующие:
ярко выраженная избирательность адсорбции полярных молекул;
высокая адсорбционная емкость при повышенных температурах (до 100 °С) и малых парциальных давлениях извлекаемого компонента;
близость диаметров входных окон в полости цеолита к размерам молекул, что позволяет осуществить селективную адсорбцию.
Сравнение данных о емкости различных адсорбентов (силикагель, активированный уголь, магниевый силикат и проч.) по отношению к сульфиду водорода и меркаптанам показывает, что наибольшей емкостью к этим компонентам обладают цеолиты. Высокая емкость цеолитов по серосодержащим компонентам обусловлена наличием сильного электр-остатического поля в адсорбционных полостях.
Установки адсорбционной газоочистки с использованием цеолитов проектируются в 2-х, 3-х и 4-х адсорберном исполнении. Их технико – экономические показатели во многом определяются принятой схемой утилизации газов регенерации.
При проектировании основные решения относятся к выбору марки цеолита, структурной схемы установки, условий ведения процесса. Большое значение для повышения эффективности процесса имеет применение гибких схем автоматического регулирования.
Таблица 1.1.3.1.
Основные процессы с использованием физических поглотителей
| Процесс | Поглотитель | Фирма-разработчик (страна) | Число установок |
| «Ректизол» | Метанол | «Лурги» ФРГ | 65 |
| «Пуризол» | N-метилпирролидон | «Лурги» ФРГ | 5 |
| «Флюор» | Пропиленкарбонат | «Флюор» США | 11 |
| «Селексол» | Смесь диметиловых эфиров полиэтиленгликолей | «Норнтон» США | 35 |
| «Сепасолв» | 4 |
Таблица 1.2.1.
Физико-химические свойства алканоламинов (массовое содержание вещества не менее 99%)
| Показатели | МЭА | ДГА | ДЭА | ДИПА | ТЭА | МДЭА |
| Молекулярная масса | 61,1 | 105,1 | 105,1 | 133,2 | 149,2 | 119,2 |
| Плотность, г/см3 (при Т, оС) | 1,015 (20) | 1,085 (20) | 1,011 (25) | 0,992 (40) | 1,119 (25) | 1,030 (20) |
| Температура (при атм. давлении), оС: | ||||||
| - кипения | 170,3 | 221 | 268,4 | 248,7 | 338,8 | 231 |
| - застывания | 10,3 | -9,5 | 27,5 | 32,4 | 20,4 | -21,0 |
| Давление паров при 60 оС, Па | 860 | 33 | 4,7 | 4,0 | 0,1 | 27 |
| Динамическая вязкость, *103 Па·с (при Т, оС) | 18,9 (25) | 26 (25) | 352 (30) | 870 (30) | 590 (25) | 101 (20) |
| Удельная теплоемкость, кДж/(кг· оС) (при Т, оС) | 2,72 (30) | 3,4 (80) | 2,47 (30) | 2,51 (30) | 2,34 (30) | 1,71 (30) |
| Теплота реакции, кДж/кг: | ||||||
| - с H2S | 1511 | 1566 | 1147 | 1218 | 930 | 1047 |
| - c CO2 | 1909 | 1976 | 1511 | 1628 | 1465 | 1340 |
Некоторые физико-химические свойства водных растворов алканоламинов приведены на рисунках 1.2.1 – 1.2.6.
|
|
Рисунок 1.2.1. Измерение рН 2н растворов аминов при нейтрализации
СО2 (t=25 оС): 1 – МЭА; 2 – ДЭА; 3 – МДЭА; 4 – ТЭА.

Рисунок 1.2.2. Кривые температур замерзания водных растворов аминов: 1 – МЭА; 2 – МДЭА; 3 – ДЭА.

Рисунок 1.2.3. График температуры кипения водных растворов аминов при давлении 101,333 кПа.

Рисунок 1.2.4. Зависимость плотности водных растворов МДЭА от температуры при различной массовой доле МДЭА, %: 1 – 60; 2 – 40; 3 – 20.
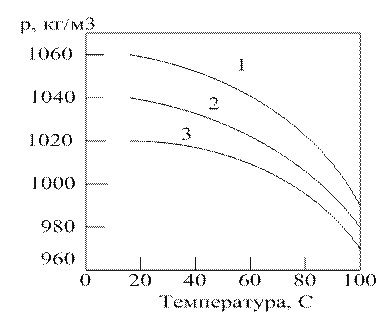
Рисунок 1.2.5. Зависимость теплоемкости водных растворов МДЭА от температуры при различной массовой доле МДЭА, %: 1 – 25; 2 – 50; 3 – 75;
4 – 100.
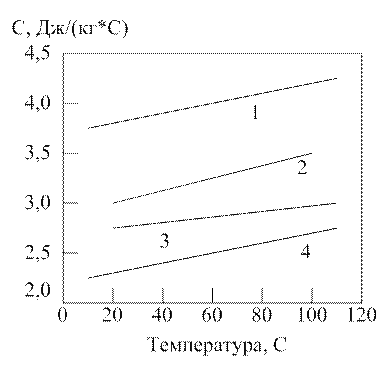
Рисунок 1.2.6. Зависимость теплопроводности растворов МДЭА от массовой доли МДЭА при температуре 40 оС.

Хемосорбенты применяют, как правило, в виде водных растворов. Концентрация амина в растворе может изменяться в широких пределах, ее выбирают на основании опыта работы и по соображениям борьбы с коррозией. Массовая концентрация алканоламинов в воде составляет 10-60%.
Чистые амины – вязкие жидкости с высокой температурой замерзания (за исключением ДГА и МДЭА). Однако водные растворы этаноламинов менее вязкие и замерзают при низких температурах (ниже минус 10⁰С), что делает возможным их применение в промышленности.
1.3. Химизм взаимодействия Н2 S, C О2 и других компонентов с алканоламинами
Механизм поглощения Н2S и СО2 водными растворами аминов подробно рассмотрен в работах [28-31].
Алканоламины, будучи щелочами, легко вступают в реакцию с кислыми газами Н2S (СO2), образуя водорастворимые соли. При этом протекают следующие реакции:
Н2S + [Амин] ↔ [Амин ∙ Н]+ + НS- (мгновенно);
СO2+2∙ [Амин] ↔ [Амин х Н]+ + [Амин ∙ СОО]- (быстро);
СO2 + Н2O ↔ Н2СO3 (медленно);
Н2СO3 ↔ Н+ + НСO3- (быстро)
НСO3- ↔ Н+ + СO3- (быстро)
[Амин] + Н+ ↔ [Амин ∙ Н]+ (быстро).
Все амины реагируют с Н2S одинаковым образом с образованием гидросульфида или сульфида амина, причем реакция классифицируется как мгновенная.
Первичные и вторичные амины могут реагировать с СO2 с образованием карбамата (соли замещенной карбаминовой кислоты - амин∙СОО-∙Н+), которая трактуется как быстрая реакция второго порядка. Кроме того, с СO2 образуются карбонаты и бикарбонаты аминов, но образованию их предшествует медленная реакция растворения СO2 в воде с образованием угольной кислоты Н2СO3. Считается, что при умеренных степенях карбонизации амина (до 0,5 моль СO2/моль амина) преимущественно протекает быстрая реакция образования карбамата. Карбаматы аминов - нестойкие соединения и в слабощелочной среде они медленно разлагаются с образованием бикарбоната (на примере вторичного амина):
|
|
R2NCOOR2NH2 + H2O ↔ R2NH + R2NH2HCO3
где R – HOCH2CH2-.
У третичного алканоламина нет подвижного атома Н+ в аминовои группе (N -), поэтому становится невозможным про-текание прямой и быстрой реакции с СO2 по карбаматному типу, а взаимодействие осуществляется через предварительную и медленную стадию образования и диссоциации угольной кислоты:
СО2+Н2О ↔ Н2СО3;
Н2СО3 ↔ Н+ + НСО3-,
[Амин] + Н++ НСО3- ↔ [Амин ∙ Н]+х НСO3-.
Конечными продуктами реакции являются бикарбонат и карбонат. Таким образом, разница в скоростях реакций третичных аминов с Н2S (мгновенная реакция) и СO2 (медленная реакция) гораздо значительнее, чем для первичных и вторичных аминов. Это позволяет использовать на практике третичные амины для селективного извлечения Н2S из смесей его с СO2.
Реакционная способность алканоламинов изменяется в ряду: первичные > вторичные > третичные и коррелируется с их щелочностью. Диоксид углерода образует с алканоламинами различные побочные продукты. Механизм их образования изучен не полностью.
Часть из них на стадии регенерации абсорбента разрушается и снова выделяет алканоламин, другая часть нерегенерируется, что является одной из причин потерь амина. Наибольшее количество нерегенерируемых соединений характерно для первичных алканоламинов.
Меркаптаны, будучи кислотами, обратимо реагируют с алканоламинами с образованием водородрастворимых меркаптидов:
[Амин]+RSН ↔ [Амин ∙ Н] + ∙ RS-,
где R - углеводородный радикал.
Реакции предшествует растворение меркаптанов в абсорбенте и диссоциация на ионы:
Н2O
RSН ↔ RS- + Н+.
Кислотность меркаптанов значительно ниже, чем Н2S и СO2, вследствие чего последние вытесняют меркаптаны из их соединения с аминами. Меркаптиды - нестойкие соединения, легко разрушающиеся при нагревании.
На растворимость меркаптанов в алканоламинах значительное влияние оказывает наличие СO2 в растворе. Равновесная растворимость С2Н5SН в аминах при наличии СO2 в растворе в количестве 2 г/л (глубокая регенерация) снижается в 2,5 - 4 раза. С увеличением содержания СO2 в растворе растворимость С2Н5SН приближается к растворимости его в воде. При этом характер изменения растворимости соответствует изменению рН раствора.
Таким образом, на промышленных установках аминовой очистки газа от Н2S и СO2 не представляется возможным одновременно полностью очистить газ от меркаптанов.
Сероокись углерода в водных растворах аминов гидролизуется:
СOS+Н2S ↔ СO2+Н2S.
Образовавшиеся Н2S и СO2 реагируют с аминами. Однако ввиду того, что в исходном газе концентрация СОS по сравнению с Н2S и СO2 невелика, прямая реакция никогда не доходит до конца. Лимитирующая стадия процесса - растворение в абсорбенте.
Сероокись углерода может непосредственно вступать в реакции с первичными и вторичными аминами с образованием тиокарбаматов (аналогично СO2). СOS способна вступать также в другие реакции с аминами, механизм которых изучен не до конца. При этом с первичными аминами образуются нерегенерируемые продукты: вторичные и третичные амины реагируют обратимо.
При создании в абсорбенте аминовой очистки газа зоны гидролиза СОS, состоящей из 6 - 10 практических тарелок, при температуре 60 - 80 °С можно извлечь из газа значительную (до 80 %) часть сероокиси углерода.
Аналогичным образом реагирует с алканоламинами и сероуглерод. Побочные продукты он образует и с первичными и с вторичными аминами. Сульфиды и дисульфиды с алканоламинами не взаимодействуют.
Процесс поглощения COS аминами определяется как физической растворимостью, так и химическим взаимодействием растворенной сероокиси углерода с аминами.
С повышением температуры ратворимость COS в воде уменьшается.
Хемосорбция COS водным раствором ДЭА сопровождается образованием тиокарбаминовой кислоты, которая диссоциирует в растворе и взаимодействует с ДЭА с образованием тиокарбамата амина. Тиокарбамат в водной среде гидролизуется, в результате чего образуется Н2S и СO2 , которые легко связываются с ДЭА.
Образование продуктов деградации в аминовых растворах
Расход аминов – один из важных показателей работы установок очистки газов, поскольку стоимость абсорбентов высока и затраты на абсорбент составляют существенную часть эксплуатационных затрат.
Основные составляющие потерь аминов на установках: унос с газом, термохимическая деструкция аминов, механические потери [45, 46].
Унос с газом. Общий унос амина с газом определяется уносом в паровой фазе и в капельном виде. Величина первого определяется давлением паров амина над водными растворами и зависит от температуры, типа и концентрации амина в растворе. Хотя давление паров аминов относительно невелико, потери их из-за испарения значительны, вследствие больших объемов очищаемого газа.
Потери амина за счет уноса в капельном состоянии зависятот нагрузок по газу и раствору, от эффективности работы сепарирующих устройств на газовых потоках, от вида применяемых контактных элементов в колонных аппаратах. Капельный унос резко возрастает при вспенивании поглотительного раствора. Эта величина потерь амина при нормальной работе заводских установок составляет 20-30 мг/м³ газа и возрастает до 100 мг/м³ при вспенивании раствора.
Термическое разложение аминов без углекислоты протекает в малой степени и усиливается с повышением температуры и степени насыщения аминов СО2. Потери ДЭА под действием СО2 незначительны при температуре 100ºС и давлении 1,2 МПа и достигают более 90% при температуре 175ºС и давлении 4,1 МПа. Насыщенный СО2 водный 20%-ый раствор ДЭА в течении 8 ч при давлении 1,7 МПа и температуре 125ºС разлагается на 22%. При нагревании раствора ДЭА без СО2 в атмосфере азота в течение 8 ч при давлении 4,1 МПа и температуре 205ºС не наблюдается значительных изменений концентрации ДЭА или образования продуктов деструкции амина [47, 48].
Механизм взаимодействия СО2 с аминами с образованием побочных нерегенерируемых или труднорегенерируемых соединений изучен не полностью. Считают [39], что на первой стадии карбонаты или карбаматы, образовавшиеся в результате взаимодействия СО2 с аминами, превращаются в оксазолидон-2, который затем образует оксиэтилимидазолидон-2. Замещенный имидазолидон гидролизуется до оксиэтилэтилен-диамина. В растворах ДЭА оксазолидон при повышенных температурах может превратиться в другое термически стойкое соединение – оксиэтилпиперазин. Оксазолидон-2 может образовываться и при обычных температурах, если в газе имеется сероокись углерода. В растворах амина были обнаружены и другие содержащие азот и имеющие сложную структуру не идентифицированные продукты разложения.
Скорости побочных реакций обычно низки. Однако при длительной циркуляции поглотительного раствора происходит накопление труднорегенерируемых продуктов в системе. Это приводит к снижению концентрации активного амина, повышению вязкости раствора и в целом к уменьшению эффективности процесса абсорбции. Кроме того, наличие продуктов деградации аминов вызывает вспенивание и усиливает коррозионную агрессивность раствора.
Установлено [48], что продукты превращения ДЭА несколько тормозят реакции его разложения; сероводород тормозит деструкцию ДЭА под воздействием СО2.
Сложность происходящихв растворе процессов деструкции аминов и отсутствие в литературе представительных данных по кинетике и механизму побочных реакций СО2 с ДЭА и МДЭА затрудняют количественную оценку этой статьи потерь аминов.
В связи с этим в работе [49] было проведено экспериментальное исследование термохимической деструкции ДЭА и МДЭА под действием СО2 в автоклавах при температуре до 250ºС и парциальном давлении СО2 до 5 МПа.
Было установлено, что процесс деградации аминов подчиняется кинетическому уравнению первого порядка:
d [ A ]/ dτ =- K [ A ]. (2.1.1)
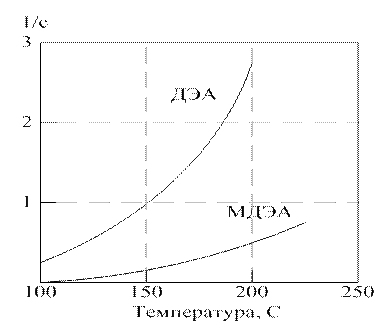
Зависимость константы K от скорости деструкции аминов под действием СО2 от температуры приведена на рисунке 2.1.1. Представленные данные свидетельствуют о значительно более высокой термохимической стабильности МДЭА по сравнению с ДЭА, причем это различие с ростом температуры проявляется все сильнее.
Рисунок 2.1.1. Зависимость константы скорости процесса термохимической деструкции аканоламинов от температуры
при pСО2 > 0,1 МПА.
Экспериментальные данные по зависимости константы скорости процесса деструкции аминов (К, моль/(л*ч) от парциального давления СО2 (рСО2 , МПа) и температуры (ºС) описываются следующими критериальными уравнениями:
Для МДЭА при рСО2 > 4 МПа:
К = -0,0846+0,169*ln рСО2 (2.1.2)
t = 185ºC;
К = exp(-15.1335+0.0749* t), (2.1.3)
100ºС < t < 165ºС;
К = -0,8505+5,5*10-3-3 t, (2.1.4)
165ºС < t < 205ºC.
Для МДЭА (при рСО2 > 2 МПа):
К = exp (-12.05+0.03856* t) (2.1.5)
По уравнениям (2.1.2-2.1.5) можно рассчитать примерный расход аминов с учетом технологических режимов работы установок сероочистки газа и состава перерабатываемого сырья.
Следует отметить, что в промышленных условиях наибольшую деструкцию амина следует ожидать в зонах с повышенной температурой и степенью насыщения СО2. Такой зоной, по-видимому, является линия насыщенного раствора в интервале температур 80-110ºС.
В производственном цикле очистки газа водные растворы ЭА постояноо испытывают термическое воздействие и в процессе абсорбции, и особенно десорбции, где температура достигает 120-130 оС. В этих условиях даже химически стабильные ЭА подвергаются побочным превращениям, в частности, окислению под воздействием кислорода. Кислород обычно присутствует в небольшом количестве и в воде, идущей на приготовление раствора ЭА, и в очищаемом природном газе [42]. В промышленных растворах ДЭА и МДЭА установлено наличие до 1,3% масс. щавелевой, уксусной и муравьиной кислот в виде их солей с ЭА [45]. Последние, термостабильные соли, не регенерируются, снимают концентрацию ЭА и вызывают коррозию.
H2S обратимо реагирует с этаноламином, но в присутствии кислорода реакция идет с побочным получением тиосульфата (ЭА)2∙S2O3, не разлагающегося при десорбции кислых газов из растворов ЭА [45]. Известны [25] совместные окислительные первращения ЭА, тиолов, моно- и диалкилсульфидов, тиофенов, приводящие к образованию микропримесей тиомочевины, тиосульфатов ЭА и других солей тиосерной кислоты.
COS и CS2 также частично по необратимым реакциям взаимодействуют с ЭА, особенно с первичным МЭА, давая соли N-(гидроксиэтил)-тиокарбаминовой и N-(гидроксиэтил)-дитиокарбаминовой кислот [48].
Установлено [51], что под влиянием COS (парциальное давление 0,3-1,17 МПа) и нагревании (t=120-180 оС) развивается деградация растворов ДЭА с образованием производных этилендиамина, имидазолидона и пиперазина, а также других соединений.
При нагревании (t=180 оС, τ=144 ч.) водного раствора, содержащего 4,28 моль/л МДЭА, в нем обнаружены 2-(диметиламино)-этанол, 1,4-диметилпиперазин, N-(гидроксиэтил)-метилпиперазин, N,N'-бис-(гидроксиэтил)-пиперазин, ТЭА, триметиламин, этиленгликоль, оксид этилена и метанол [51]. Константа скорости деструкции МДЭА меньше, чем ДЭА, примерно в 10 раз. Изучение превращений смесей МДЭА+ДЭА и МДЭА+МЭА под действием CO2 (парциальное давление ~2,6 МПа) при t=120-180 оС [52] показало, что скорость образования побочных продуктов увеличивается в ряду МДЭА<МЭА<ДЭА согласно кинетическим уравнениям (2.1.6 – 2.1.8):
ln kМДЭА = 20,34 – 96,420/RT (2.1.6)
ln kМЭА = 19,36 – 85,476/RT (2.1.7)
ln kДЭА = 12.60 – 58.212/RT (2.1.8)
Соответственно, уменьшается энергия активации (Ea) протекающих с CO2 реакций.
В таблице 2.1.1 указаны основные изученные продукты деградации аминовых растворов.
Таблица 2.1.1.
Таблица 2.2.1.
Коррозия аппаратуры
Практически все оборудования и коммуникации установок очистки газа от кислых компонентов подвергаются коррозии. Основной причиной коррозии считается наличие в системе сероводорода и диоксида углерода, который является более агрессивным, чем H₂S [14].
Принято считать, что СО₂ при взаимодействии с материалом оборудования и труб образует растворимый бикарбонат железа. При подогреве раствора происходит выделение СО₂ и осаждение железа в виде нерастворимого карбоната.
Сероводород приводит к образованию сернистого железа. Частично это соединение может образовывать на поверхности металла защитную пленку. Однако одновременное наличие в газе СО₂ и H₂S в определенных условиях может обусловить синэргический эффект, т.е. каждый из этих компонентов может усилить коррозионное действие другого.
Коррозии оборудования также способствует накопление в растворе твердых частиц, которые разрушают защитные пленки, вызывают эрозию металла. Такими твердыми частицами являются сульфид железа, окись железа, пыль, песок, прокатная окалина, которые попадают в абсорбер вместе с потоком газа.
В определенных условиях, особенно при повышенной температуре, возможно образование комплексов железа с моноэтаноламином хелатного типа
 ,
,
 .
.
Такие же соединения могут образовывать диамины и другие полиамины. При охлаждении раствора и взаимодействии этих соединений с сероводородом выпадает в осадок сернистое железо, а исходный компонент, участвующий в образовании хелата, регенерируется и вновь реагирует с железом в тех частях установки, где поддерживается высокая температура.. Таким образом, продукты коррозии не расходуются в процессе коррозии, а накапливаются в растворе.
При высоких температурах может протекать реакция между металлическим железом и угольной кислотой с образованием растворимого бикарбоната железа Fe(HCO3)2. При десорбции СО2 в регенераторе бикарбонат железа превращается в нерастворимый карбонат железа FeCO3, который осаждается на стенках аппаратов и трубопроводов [53].
Оборудование установок аминовой очистки газов помимо общей коррозии подвергается и другому виду разрушения – коррозионному растрескиванию низколегированных и углеродистых сталей в регенерированных и насыщенных сероводородом и углекислым газом (или одним из этих газов) аминовых растворах. Верятность растрескивания возрастает с повышением температуры. Зарегистрированы случаи появления коррозионных трещин в абсорберах, десорберах, теплообменниках, трубопроводах.
Таблица 2.4.1.
Скорость коррозии стали 20 в различных абсорбентах (p =50 МПа, t=90 оС, ∑α =0,5 моль/моль, H2S/СО2=2:1)
| Абсорбент, % масс. | Скорость коррозии, мм/год |
| ДЭА (40 %) | 0,06 |
| МДЭА (40 %) | 0,074 |
| МДЭА + ДЭА (40 %) | 0,09 |
| Укарсол-702 (70 %) | 0,05 |
Ещё одним видом коррозии оборудования установок сероочистки является расслоение углеродистых и низколегированных сталей под действием водных сероводородсодержащих сред, образующихся в результате десорбции кислых газов.
В отдельных видах оборудования установок сероочистки при изготовлении его из углеродистых и низколегированных сталей скорость электрохимической коррозии столь значительна, что не может быть обеспечен проектный срок службы таких аппаратов из-за утонения стенок. Это относится к кипятильникам (ребойлерам) колонн, десорберам, сепараторам и некоторым другим аппаратам, эксплуатирующимся в среде кислых газов, поступающих из десорбера. Перечисленные аппараты или отдельные их элементы рекомендуется изготавливать из легированных сталей (Х18Н10Т; Х17Н13М2Т и др.) [54]. Стоимость оборудования в этом случае возрастает в несколько раз.
При очистке газа водными растворами аминов коррозия происходит по всему тракту поглотительного раствора. Наиболее интенсивная коррозия наблюдается в зонах с максимальной концентрацией кислых газов и максимальной температурой, поэтому в промышленных условиях наиболее интенсивной коррозии обычно подвержены теплообменники, кипятильники, конденсаторы, десорберы.
Скорость коррозии увеличивается с повышением температуры, концентрации кислых компонентов и количества воды в системе, а также при наличии продуктов реакций окисления и разложения аминов, минеральных солей, увеличение скорости насыщенного абсорбента в коммуникациях и т.д. Следовательно, в этих условиях скорость коррозии может быть снижена при соответствующем увеличении производительности разгонки и фильтрации.
Скорость коррозии зависит от материала оборудования и качества его изготовления. Легированные стали менее подвержены коррозии, следовательно, наиболее уязвимые места установок (коммуникация насыщенного раствора от рекуперативного теплообменника до десорбера, верхняя часть десорбера, конденсатор-холодильник, используемый для охлаждения верхнего продукта десорбера, трубный пучок испарителя и т.д.) должны быть изготовлены из легированных сталей.
Следует отметить, что на надежную эксплуатацию установок очистки высокосернистых газов влияет выбор материала для тех частей установки, которые непосредственно контактируют с высокосернистым газом. С увеличением прочности сталей их чувствительность к водородной коррозии возрастает.
Продукты разложения вызывают повышенный, нежели сами чистые растворы аминов, износ аппаратов и коммуникаций, поэтому их следует периодически удалять из раствора.
Скорость коррозии стали различных марок в водном растворе аминов, содержащем СО2, изучена в ряде работ [53, 54]. Установлено, что скорость коррозии стали Ст.3 в 10-100 раз выше скорости коррозии нержавеющей стали марки 1Х18Н10Т [14]. Кроме того, коррозия углеродистой стали резко возрастает в местах ее контакта с легированными сталями [ 29]. Наблюдались случаи коррозии нержавеющих сталей [38]. Наибольшей стойкостью к коррозионному растрескиванию и межкристаллитной коррозии обладает сталь марки 0Х21Н6М21 [54].
При неблагоприятных условиях эксплуатации и отсутствииспециальных мер коррозия может принять катастрофический характер и за 5-6 месяцев вывести из строя почти все оборудование, работающее при температуре выше 100 оС (включая насосы). Эрозионно-коррозионному разрушению подвергается даже оборудование, находящееся в контакте с жидкостью при температуре окружающей среды. Наиболее сильной коррозии обычно подвержены теплообменники, кипятильники, а также конденсаторы флегмы, регенераторы и дроссельные вентили на линии насыщенного раствора.
На скорость коррозии оказывает влияние также соотношения СО₂:H₂S в очищаемом и десорбированном газах. Принято считать, что H₂S при взаимодействии с железом образует сульфид железа. При отсутствии эрозии сульфид железа на поверхности металла создает защитную пленку. Учитывая это, наибольшее насыщение раствора допускается при очистке газов с меньшим содержанием СО₂ и большим содержанием H₂S. В обратном случае степень насыщения раствора должна быть как можно меньше [9].
Выбор концентрации применяемого раствора также осуществляется с учетом отношения H₂S:СО₂. Чем выше его значение, тем более концентрированный раствор можно применять.



