
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Квантовая теория атома водорода
Дальнейший шаг в развитии теории Бора был сделан А. Зоммерфельдом (1868–1951). В теории Бора рассматривались только круговые движения электронов и правила кванто-вания распространялись только для одной степени свободы. Зоммерфельд использовал общее решение кеплеровой задачи и ввел в теорию Бора эллиптические орбиты, причем ядро должно находиться в одном из фокусов эллипса. Для эллиптических орбит необходимы правила квантования для системы с двумя степенями свободы, так как положение электрона на орбите определяется двумя параметрами: радиусом-вектором Атом водорода является простейшим атомом. Он состоит из протона (ядра) и электро-на, между которыми действует сила электростатического притяжения. Потенциальная энергия электрона в центральном сферически-симметричном поле ядра равна
очень громоздко и приводить его не будем, но результаты этого расчета подвергнем детальному обсуждению. Атом является своеобразным видом потенциальной ямы, которая изображена на рисунке 72. Эта яма не имеет дна, а ее стенки – гиперболы, ось or является одной из асимптот. Электрон внутри атома обладает отрицательной потенциальной энергией (такой выбор начала отсчета потенциальной энергии имеет то преимущество, что различные атомы имеют одинаковое значение Из сферической симметрии задачи следует, что наиболее подходящей координатной системой для ее решения является сферическая (рисунок 73).
В этой системе координат положение электрона в пространстве определяется тремя сферическими координатами
Уравнение Шредингера (80), как всякое дифференциальное уравнение, имеет бесчисленное множество решений. Но физический смысл имеют лишь некоторые из них, отвечающие следующим требованиям: быть конечным, однозначным, непрерывным и обращаться в нуль на бесконечном расстоянии от ядра. Решение уравнения Шредингера, удовлетворяющее этим условиям, существует не при всех значениях энергии Квантовый характер движения электрона проявляется в появлении некоторых квантовых чисел в выражении для волновых функций. Общий вид волновых функций можно представить так
где Величина Как видно из рисунка 74, атом с квантовомеханической точки зрения не имеет четко выраженных геометрических размеров, в том смысле, какой мы вкладываем в это понятие, имея в виду, например, бильярдный шар. Плотность электронного облака максимальна при
Угловая часть волновой функции описывается так называемыми сферическими функциями Набор трех квантовых чисел В основном состоянии электрон характеризуется одной функцией В зависимости от значений орбитального квантового числа
Описанные выше волновые функции и расчет энергии электрона являются точными только для водорода и водородоподобных атомов, т.е. состоящих из ядра с зарядом 1 Спин. Несмотря на значительные достижения квантовой механики в описании электронной структуры атомов, многие факты оставались необъяснимыми. Например, при анализе спектров щелочных металлов с помощью спектроскопических приборов высокой разрешающей силы обнаружилось, что некоторые спектральные линии, считавшиеся синглетами, в действительности расщеплены на две линии, т.е. являются дублетами. Это указывает на то, что энергия уровней зависит не только от главного квантового числа В 1925 году Гаудсмит и Уленбек для объяснения этого эффекта выдвинули гипотезу о наличии у электрона собственного момента импульса, не связанного с орбитальным моментом импульса
где спиновое квантовое число
где Полный момент электрона получается путем сложения орбитального момента с его спином, т.е.
где Введение спина для электрона позволяет объяснить дублетный характер спектров щелочных металлов, так как с ним связано дополнительное взаимодействие, которое называется спин-орбитальным. Его наличие приводит к расщеплению всех состояний с ненулевым орбитальным моментом импульса на два состояния с
Рисунок 76
Переходы из образовавшихся двух Принцип Паули и электронная структура атомов. Точное решение уравнения Шредингера не получено ни для одного из атомов с двумя или более электронами. Орбитали многоэлектронных атомов отличаются от орбиталей атома водорода, тем не менее, можно ожидать, что число орбиталей и характер их угловых частей будут такими же, как и для атома водорода. Поэтому для описания электронного строения многоэлектронных атомов можно использовать орбитали атома водорода. В этом случае каждое квантовое состояние электрона характеризуется набором четырех квантовых чисел – 1. Принципу Паули, согласно которому в одном и том же квантовом состоянии (с одинаковыми квантовыми числами) не может одновременно находиться более одного электрона. Это означает, что любые два электрона в атоме находятся в различных квантовых состояниях, которые должны отличаться хотя бы одним из четырех квантовых чисел.
2. Принципу минимума энергии: при данном общем числе электронов осуществляется такое их расположение в нейтральном атоме, при котором полная энергия системы Максимальное число электронов, которыми можно заселить данное орбитальное состояние Таблица 3а
Группы орбиталей s, p, d, f и т.д. иногда называют подоболочками. Совокупность подоболочек, имеющая одно и то же значение Таблица 3б
Заполнение квантовых состояний начинается с самого наинизшего энергетического уровня, которому соответствует
Порядок заполнения электронных подоболочек таков: 1 s, 2 s, 2 p, 3 s, 3 p, 4 s, 3 d, 4 p, 5 s, 4 d, 5 p, 6 s, 5 d, 4 f. Он, кроме вышеуказанных принципов, определяется еще правилом Гунда: орбитали с одинаковой энергией заполняются электронами так, чтобы суммарный спин системы (атома, молекулы) был максимальным. В этом суть принципа максимальной мультиплетности. Под мультиплетностью понимается число возможных ориентаций в пространстве полного спина атома или молекулы. Мультиплетность ( Таким образом, структура периодической системы Менделеева полностью определя-ется порядком заполнения электронных оболочек и подоболочек. Число химических элементов в периоде равно числу электронов в слое, которое строго определено в соответствии с принципом Паули. В 1869 году Д.И. Менделеев, расположив химические элементы в порядке возраста-ния атомных масс и сгруппировав элементы с аналогичными физическими и химическими свойствами, предложил первую Периодическую систему, которая получила широкое признание. Периодическая система элементов отражает открытый Менделеевым периодический закон, который является важнейшим фундаментальным законом природы. Он соста-вляет основу не только химии, но и всего современного естествознания. Содержание периодического закона связано с установлением периодической зависимости физических и химических элементов от их атомного веса. Несмотря на то, что атомный вес, как выяснилось впоследствии, не может считаться константой, однозначно определяющей индивидуальные свойства атомов. В действительности существуют вещества, которые в химическом отношении ведут себя практически одинаковым образом, хотя их атомные веса различны. Такие вещества называются изотопами, так как вследствие их химической тождественности их необходимо помещать на одно и то же место в периодической системе (изотоп означает занимающий одно и то же место). Химические элементы на самом деле являются смесями изотопов, а их атомные массы являются средними из атомных масс всех образующих их изотопов (по этой причине атомные массы имеют нецелочисленные значения). Наряду с изотопами существуют также атомы, обладающие различными свойствами при одинаковых атомных массах (изобары). Поскольку атомная масса не является единственным существенным признаком атома, основной характеристикой элемента следует считать его порядковый номер ( Свойства атомов элементов определяется числом электронов во внешней оболочке, поэтому элементы, имеющие одинаковое строение внешней оболочки, принадлежат к одной группе периодической системы и обладают сходными физическими и химическими свойствами. В современной периодической системе все известные химические элементы образуют восемь вертикальных столбцов – групп, обозначаемых римскими цифрами. Каждая группа делится на подгруппы. Номер группы в периодической системе соответствует высшей положительной валентности элемента. Элементы в группах имеют сходные свойства, которые, однако, изменяются монотонно с ростом атомного номера. Так, например, элементы с атомными номерами Горизонтальные ряды периодической системы называются периодами (их всего семь) и обозначаются арабскими цифрами. Внутри каждого периода имеет место равномерный переход от активных металлов через менее активные металлы и слабоактивные неметаллы к очень активным неметаллам и, наконец, к инертным газам. Большинство редкоземельных элементов еще не были известны в то время, когда Менделеев создавал свою периодическую систему. Эти элементы образовали в периоди-ческой системе отдельную серию редкоземельных элементов, или лантанойдов, начиная с лантана (атомный номер 57) и кончая лютецием (атомный номер 71). Лантанойды обладают столь близкими химическими свойствами, что в периодической системе им уделена одна клетка, а весь ряд приводится отдельно. Серия актинойдов образует ряд элементов от актиния (атомный номер 89) до элементов с большими атомными номерами, таких как нептуний, плутоний и америций, полученных в лабораторных условиях. К 1973 году все природные 87 элементов были открыты и самый тяжелый из встречающихся в природе элементов – уран (92). Дальнейшее пополнение химических элементов могло идти лишь за счет искусственного синтеза их. В США и СССР были синтезированы в лабораторных условиях все 15 трансурановых элементов – от Если первые трансурановые элементы Принцип тождественности. Микрочастицы, обладающие одинаковыми физическими свойствами, массой, зарядом и спином называются тождественными. К примеру, тождественными частицами являются электроны, протоны, нейтроны и др. Тождественные частицы подчиняются фундаментальному принципу квантовой механики – принципу тождественности. Согласно этому принципу состояния системы частиц, которые получаются перестановкой тождественных частиц местами, являются неразличимыми, и такие состояния следует рассматривать, как одно физическое состояние. Принцип тождественности является одним из основных различий между классической и квантовой механикой. В классической физике в принципе всегда можно проследить за движением отдельных частиц по траекториям и таким образом отличить частицы друг от друга. Непрерывность траекторий позволяет идентифицировать частицу в любой момент времени. В квантовой механике такая идентификация микрочастиц становится невозможной в силу соотношения неопределенностей Гейзенберга, ограничивающего точность определения Квантовомеханический принцип неразличимости одинаковых частиц можно сформулировать математически с помощью волновых функций. Если система состоит из двух тождественных частиц, то ее волновая функция
Отсюда вытекают две возможности Так как все взаимодействия одинаковых частиц симметричны относительно переменных «1» и «2», то свойства симметрии или антисимметрии волновых функций сохраняются во времени. Если при перемене частиц местами волновая функция не меняет знака, то она называется симметричной, если меняет на противоположный – антисимметричной. В системе из произвольного числа тождественных частиц должна иметь место симметрия или антисим-метрия относительно перестановки любой пары частиц. Соответственно, все частицы делятся на два класса: частицы, описываемые симметричными волновыми функциями, называются бозонами, антисимметричными функциями – фермионами. Существует тесная связь между симметрией, спином частиц и их волновых функций. Частицы с целым значением спина являются бозонами, а с полуцелым – фермионами. Это правило сначала было установлено эмпирически, а затем получило теоретическое обоснование в работах Паули. В частности, электроны, протоны, нейтроны являются фермионами, а фотоны, Свойства симметрии волновых функций определяют статистические свойства системы из тождественных частиц. Состояние такой системы можно определить заданием числа частиц (числа заполнения), находящихся в каждом данном (индивидуальном) состоянии. Но если тождественные частицы имеют одинаковые квантовые числа, то их волновая функция симметрична относительно перестановки частиц. Отсюда вытекает следующая формулировка принципа Паули: полная волновая функция двух электронов должна быть антисимметричной функцией относительно их перестановки. Условие антисимметричности волновых функций для фермионов приводит к тому, что они при большой плотности как бы эффективно отталкиваются друг от друга, даже если между ними не действуют никакие силы. В то же время между бозонами, которые описываются симметричными волновыми функциями, возникают как бы силы притяжения: чем больше бозонов находится в данном состоянии, тем больше вероятность перехода других бозонов системы в это состояние (этот эффект лежит в основе работы квантовых генераторов и квантовых усилителей). В соответствии с принципом Паули числа заполнения для фермионов могут принимать лишь значения 0 или 1. Для бозонов числа заполнения могут быть произвольными. Поэтому в силу квантовомеханических свойств тождественных частиц существует два вида статистических распределений. Статистика для фермионов Ферми–Дирака и статистика для бозонов Бозе–Эйнштейна. Рассмотренные выше свойства симметрии волновых функций должны сохраниться и в случае взаимодействия между частицами, поскольку эти свойства симметрии являются следствием тождественности частиц, которая сохраняется и при наличии взаимодействия между частицами. Взаимодействие тождественных частиц проявляется в возникновении специфического, не имеющего аналога в классической физике, обменного взаимодействия. Характерной особенностью этого вида взаимодействия является его зависимость от спинов частиц. Непосредственно спины во взаимодействии не участвуют, но в зависимости от их ориентации волновая функция может быть симметричной или антисимметричной. От симметрии волновой функции зависит знак обменной энергии, что определяет эффективное притяжение или отталкивание частиц в результате обменного взаимодействия. Обменное взаимодействие играет существенную роль во многих явлениях, например, при объяснении ферромагнетизма, сверхпроводимости и химической связи. Квантово-полевые концепции
|
|||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 95; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.218.184 (0.044 с.) |
||||||||||||||||||||||||||||||||||||||||||||
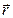 и полярным углом
и полярным углом  . В случае учета пространственной ориентации орбиты электрону необходимо приписать три степени свободы. Пространственное квантование Бора–Зоммерфельда позволило объяснить эффект Зеемана (расщепление энергетических уровней в магнитном поле). Однако, несмотря на ряд частных успехов, к середине 20-х годов стало ясно, что теория Бора–Зоммерфельда не может дать полного и удовлетворительного объяснения физических свойств атомов. Полуквантовая модель атома уступила место квантовой теории движения микрочастиц.
. В случае учета пространственной ориентации орбиты электрону необходимо приписать три степени свободы. Пространственное квантование Бора–Зоммерфельда позволило объяснить эффект Зеемана (расщепление энергетических уровней в магнитном поле). Однако, несмотря на ряд частных успехов, к середине 20-х годов стало ясно, что теория Бора–Зоммерфельда не может дать полного и удовлетворительного объяснения физических свойств атомов. Полуквантовая модель атома уступила место квантовой теории движения микрочастиц. где
где  – заряд электрона; а
– заряд электрона; а 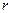 – расстояние электрона от ядра. Однако даже для этого простейшего атома решение уравнения Шредингера
– расстояние электрона от ядра. Однако даже для этого простейшего атома решение уравнения Шредингера (80)
(80) при
при 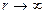 .
.

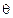 ,
,  ,
,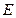 , а только при определенных дискретных значениях
, а только при определенных дискретных значениях 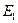 ,
,  ,
,  ,…. Этим собственным значениям энергии соответствует дискретный набор волновых функций – решений уравнения Шредингера
,…. Этим собственным значениям энергии соответствует дискретный набор волновых функций – решений уравнения Шредингера 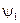 ,
,  ,
, 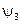 ,…, которые называются орбиталями, в отличие от боровских орбит-траекторий.
,…, которые называются орбиталями, в отличие от боровских орбит-траекторий. ,
, представляет собой радиальную часть волновой функции;
представляет собой радиальную часть волновой функции; 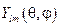 – угловую.
– угловую. дает радиальную плотность вероятности нахождения электрона на некотором расстоянии
дает радиальную плотность вероятности нахождения электрона на некотором расстоянии 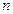 и
и 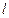 ;
; 
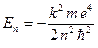 , (
, (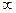 ). Квантовое число
). Квантовое число  и принимает при данном
и принимает при данном  , которое вытекает из реше-
, которое вытекает из реше-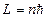 ). Последнее можно рассматривать как приближе-
). Последнее можно рассматривать как приближе- , где
, где  – первый боровский радиус. Плотность вероятности нахождения электрона на расстоянии
– первый боровский радиус. Плотность вероятности нахождения электрона на расстоянии 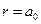 , т.е. на первой боровской орбите, и под размером атома условно можно подразумевать эту его часть.
, т.е. на первой боровской орбите, и под размером атома условно можно подразумевать эту его часть. . Число
. Число  называют магнитным квантовым числом, так как в магнитном поле с индукцией
называют магнитным квантовым числом, так как в магнитном поле с индукцией  электрон обладает дополнительной энергией
электрон обладает дополнительной энергией 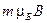 , обусловленной его орбитальным магнитным моментом. Оно определяет возможные значения проекции момента импульса электрона на ось
, обусловленной его орбитальным магнитным моментом. Оно определяет возможные значения проекции момента импульса электрона на ось 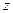 в магнитном поле
в магнитном поле  . При данном
. При данном  до
до  , т.е. всего
, т.е. всего 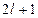 значения.
значения. . На рисунке 75 приведены угловые и радиальные части некоторых волновых функций и соответствующие им распределения электронной плотности для электрона в атоме водорода.
. На рисунке 75 приведены угловые и радиальные части некоторых волновых функций и соответствующие им распределения электронной плотности для электрона в атоме водорода. . Что касается возбужденных состояний, то все они являются вырожденными
. Что касается возбужденных состояний, то все они являются вырожденными 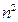 -кратно. Этот термин означает, что энергии
-кратно. Этот термин означает, что энергии 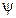 -функции, энергии
-функции, энергии 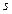 ,
, 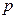 ,
, 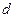 ,
,  , …. Число впереди буквы используется для указания главного квантового числа. Например,
, …. Число впереди буквы используется для указания главного квантового числа. Например,  состояние – это состояние с
состояние – это состояние с 


 ,
,  и т.д.). В атомах, содержащих более одного электрона, следует учитывать межэлектронное взаимодействие, а также экранирование заряда ядра другими электронами. Рассчитать форму электронного облака в сложных атомах удалось лишь после работ советского физика В.А. Фока (1898–1974) и английского ученого Д. Хартри (1897–1958). Расчеты электронной структуры атомов по методу Хартри–Фока стали возможными только благодаря современным вычислительным машинам.
и т.д.). В атомах, содержащих более одного электрона, следует учитывать межэлектронное взаимодействие, а также экранирование заряда ядра другими электронами. Рассчитать форму электронного облака в сложных атомах удалось лишь после работ советского физика В.А. Фока (1898–1974) и английского ученого Д. Хартри (1897–1958). Расчеты электронной структуры атомов по методу Хартри–Фока стали возможными только благодаря современным вычислительным машинам. . С точки зрения квантовой теории, такая классическая трактовка спина не имеет смысла, и мы можем говорить только о собственном моменте импульса, являющегося таким же фундаментальным свойством электрона, как его масса и заряд. Спин электрона определяется выражением, аналогичным для орбитального момента:
. С точки зрения квантовой теории, такая классическая трактовка спина не имеет смысла, и мы можем говорить только о собственном моменте импульса, являющегося таким же фундаментальным свойством электрона, как его масса и заряд. Спин электрона определяется выражением, аналогичным для орбитального момента: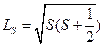 ,
, имеет единственное значение
имеет единственное значение  . Проекции этого момента на некоторое преимущественное направление (например, на направление внешнего магнитного поля) могут иметь только два значения
. Проекции этого момента на некоторое преимущественное направление (например, на направление внешнего магнитного поля) могут иметь только два значения ,
, – магнитное спиновое квантовое число, которое принимает лишь два значения
– магнитное спиновое квантовое число, которое принимает лишь два значения 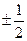 (
(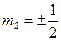 ). Наряду со спином электрон обладает магнитным моментом, связанным со спином соотношением
). Наряду со спином электрон обладает магнитным моментом, связанным со спином соотношением 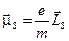 , а его проекция на ось
, а его проекция на ось 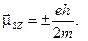 Эта величина называется магнетоном Бора (
Эта величина называется магнетоном Бора ( ). Из-за отрицательной величины заряда электрона, спиновый магнитный момент и спиновый момент импульса коллинеарны, но антипараллельны.
). Из-за отрицательной величины заряда электрона, спиновый магнитный момент и спиновый момент импульса коллинеарны, но антипараллельны. . Так как
. Так как  и
и  квантуются, то полный момент
квантуются, то полный момент 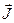 имеет такое же свойство
имеет такое же свойство
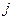 – квантовое число полного момента импульса, которое для данного значения
– квантовое число полного момента импульса, которое для данного значения 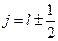 , за исключением
, за исключением  , когда возможно только
, когда возможно только 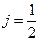 .
.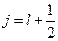 и
и  (рисунок 76).
(рисунок 76).
 состояний в
состояний в  -состояние дает узкий дублет, например, в спектре атома натрия, где наблюдаются две желтые линии при 589,0 и 589,6 нм.
-состояние дает узкий дублет, например, в спектре атома натрия, где наблюдаются две желтые линии при 589,0 и 589,6 нм. и
и 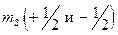 , могут иметь одинаковые значения всех орбитальных квантовых чисел (
, могут иметь одинаковые значения всех орбитальных квантовых чисел ( , а состояние
, а состояние  , с точки зрения принципа Паули, является невозможным.
, с точки зрения принципа Паули, является невозможным.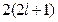 . Число
. Число 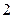 учитывает наличие двух спиновых состояний (
учитывает наличие двух спиновых состояний ( число состояний (таблица 3б).
число состояний (таблица 3б).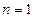 ,
, 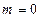 ,
,  ) и (
) и ( ), кото-рые согласно принципа Паули могут быть заполнены двумя электронами с антипараллельными спинами, образуя
), кото-рые согласно принципа Паули могут быть заполнены двумя электронами с антипараллельными спинами, образуя 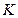 -оболочку. Электронная конфигурация обычно записывается символически следующим образом. Сначала указывается главное квантовое число, затем символ состояния по орбитальному квантовому числу (s, p, d, f и т.д.) и в виде степени у этого символа – число электронов в данном состоянии. Например, электронные конфигурации первых двух элементов периодической системы Д.И. Менделеева имеют вид:
-оболочку. Электронная конфигурация обычно записывается символически следующим образом. Сначала указывается главное квантовое число, затем символ состояния по орбитальному квантовому числу (s, p, d, f и т.д.) и в виде степени у этого символа – число электронов в данном состоянии. Например, электронные конфигурации первых двух элементов периодической системы Д.И. Менделеева имеют вид:  – для водорода и
– для водорода и  – для гелия. Гелием (инертным газом) заканчивается заполнение
– для гелия. Гелием (инертным газом) заканчивается заполнение  мы имеем два
мы имеем два 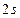 -состояния (
-состояния ( -состояний (два состояния с
-состояний (два состояния с  ,
,  ,
, 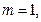
 . Затем следует бериллий (
. Затем следует бериллий (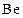 ) с конфигурацией
) с конфигурацией  , бор (
, бор ( )
)  и заканчивается заполнение
и заканчивается заполнение  , где
, где  )
)  Мультиплетность принимает четные значения (
Мультиплетность принимает четные значения (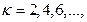 ). Если
). Если 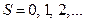 ), мультиплетность нечетная
), мультиплетность нечетная  Так, для систем с одним электроном (например,
Так, для систем с одним электроном (например,  ), для которых
), для которых  , т.е. получаются лишь дублетные состояния; для систем с двумя электронами
, т.е. получаются лишь дублетные состояния; для систем с двумя электронами 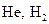 – синглетные состояния (
– синглетные состояния ( ), спины электронов антипараллельны и триплетные состояния (
), спины электронов антипараллельны и триплетные состояния ( ), спины параллельны.
), спины параллельны. ) в таблице Менделеева. Это понятие было введено еще самим Менделеевым, поскольку в ряде мест своей таблицы он отступил от исходного принципа – расположения элементов по возрастающему атомному весу, и придал большее значение периодичности химических свойств. Фундаментальное значение атомного номера состоит в том, что он является не просто порядковым номером элемента, а имеет глубокий физический смысл. Как установлено Резерфордом и Мозли атомный номер (
) в таблице Менделеева. Это понятие было введено еще самим Менделеевым, поскольку в ряде мест своей таблицы он отступил от исходного принципа – расположения элементов по возрастающему атомному весу, и придал большее значение периодичности химических свойств. Фундаментальное значение атомного номера состоит в том, что он является не просто порядковым номером элемента, а имеет глубокий физический смысл. Как установлено Резерфордом и Мозли атомный номер ( . Вместе с тем этот номер для нейтрального атома равен числу электронов в атоме. С введением понятия атомного номера, изотопами стали называть атомы, имеющие один и тот же номер
. Вместе с тем этот номер для нейтрального атома равен числу электронов в атоме. С введением понятия атомного номера, изотопами стали называть атомы, имеющие один и тот же номер 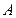 (различ-
(различ-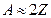 , что означает приблизительное равенство числа
, что означает приблизительное равенство числа  можно получать в больших количествах в результате облучения урана и плутония в атомных реакторах, то тяжелые актиноиды (
можно получать в больших количествах в результате облучения урана и плутония в атомных реакторах, то тяжелые актиноиды ( ) можно получить только на ускорителях тяжелых частиц, причем ядра этих элементов нестабильны.
) можно получить только на ускорителях тяжелых частиц, причем ядра этих элементов нестабильны. нахождения частицы в данной точке пространства. В случае перекрытия в пространстве волновых функций двух (или более) тождественных частиц невозможно, даже в принципе, различить эти частицы в области перекрывания. Следовательно, одинаковые частицы становятся полностью неразличимыми – тождественными.
нахождения частицы в данной точке пространства. В случае перекрытия в пространстве волновых функций двух (или более) тождественных частиц невозможно, даже в принципе, различить эти частицы в области перекрывания. Следовательно, одинаковые частицы становятся полностью неразличимыми – тождественными. будет зависеть от пространствен-ных и спиновых координат обеих частиц, которые для кратности обозначены «1» и «2». Ввиду тождественности частиц, плотность вероятности обнаружения первой частицы в состоянии «1», а второй – в состоянии «2» равняется плотности вероятности найти вторую частицу в состоянии «1», а первую – в состоянии «2». Поэтому можно написать
будет зависеть от пространствен-ных и спиновых координат обеих частиц, которые для кратности обозначены «1» и «2». Ввиду тождественности частиц, плотность вероятности обнаружения первой частицы в состоянии «1», а второй – в состоянии «2» равняется плотности вероятности найти вторую частицу в состоянии «1», а первую – в состоянии «2». Поэтому можно написать =
=  .
.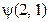 и
и 


